加工处理方式对冲菜中硫代葡萄糖苷的影响
王会霞,李 晨,薛 峰,董方晓,李 瞾,潘思轶,*
(1.国家饮料及粮油制品质量监督检验中心,湖北 武汉 430061;2.华中农业大学食品科学技术学院,湖北 武汉 430070;3. 华中农业大学动物科学技术学院,湖北 武汉 430070)
加工处理方式对冲菜中硫代葡萄糖苷的影响
王会霞1,李 晨2,薛 峰2,董方晓3,李 瞾2,潘思轶2,*
(1.国家饮料及粮油制品质量监督检验中心,湖北 武汉 430061;2.华中农业大学食品科学技术学院,湖北 武汉 430070;3. 华中农业大学动物科学技术学院,湖北 武汉 430070)
采用高效液相色谱法,对冲菜中主要的硫代葡萄糖苷种类和含量进行分析,并选择微波、热烫和蒸汽3种方法对冲菜进行处理,研究冲菜中硫代葡萄糖苷在不同处理过程中的热降解情况。结果表明:冲菜中含有两类硫代葡萄糖苷:脂肪族和吲哚族硫苷,其中含量较高的3种硫代葡萄糖苷分别为Progoitrin、Glucobrassicin和4-Methoxyglucobrassicin;硫代葡萄糖苷在微波、热烫和蒸汽3种处理过程中的热降解均符合一级热降解动力学模型,其中Glucotropaeolin的热稳定性均最差;对冲菜中总硫代葡萄糖苷的降解作用从大到小的顺序依次为:蒸汽、热烫、微波,但是微波处理最能促使对十字花科蔬菜中风味贡献最大的脂肪族硫苷的降解。
硫代葡萄糖苷;微波处理;热烫处理;蒸汽处理;一级降解动力学
硫代葡萄糖苷(glucosinolates,简称硫苷)是仅在双子叶植物中生成的一种次生代谢产物,尤其在十字花科蔬菜如卷心菜、花椰菜和甘蓝等中含量最高。按照硫苷结构的不同,可将硫苷分为脂肪族、芳香族、ω-甲基硫碱族和杂环族(也称吲哚族)4类[1]。硫苷是十字花科蔬菜风味和气味形成的重要的前体物质,其含量越高,蔬菜的营养价值就越低。硫苷可以通过酶降解、热降解和化学降解3种降解途径生成具有鲜香冲辣风味的物质[2-3]。
诸多加工生产过程常用到的工艺都会引起十字花科蔬菜中的硫苷种类及其含量的变化。如打浆、蒸煮、冷冻、脱水、发酵等都会使硫苷发生不同程度的降解[3]。除此之外,热烫、切碎、蒸煮、蒸汽和微波5种处理方式也是硫苷降解研究的热点[4-6]。以上工艺主要是使硫苷发生热降解而减少硫苷含量和种类,因此也决定了硫苷热降解研究的重要性。硫苷降解的研究国外从80年代开始就对其产生了极大的关注,而国内的研究却寥寥可数。
冲菜(Brassica junceavar.latipa)是长江三角洲流域的一种传统蔬菜,因其鲜香冲辣的特殊风味而受到研究者们的广泛关注[7]。本实验采用高效液相色谱法,研究各种加工工艺情况下冲菜中各种硫苷的热降解动力学特征,并探讨热烫、蒸汽和微波3种加工处理方式对冲菜中硫苷含量的影响,旨在为冲菜的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
新鲜冲菜由湖北省野风食品有限公司提供,储藏于-18℃冷库中。
甲醇(分析纯) 国药集团化学试剂有限公司;甲醇、乙腈均为色谱纯 美国Tedia公司;硫酸酯酶(12.3U/mg)、烯丙基硫代葡萄糖苷(sinigrin)标品 美国Sigma公司。
1.2 仪器与设备
TDL-5-A低速离心机 上海安亭科学仪器厂;HH-2数显恒温水浴锅 国华电器有限公司;BUCHI CH-9230旋转蒸发仪 瑞士Buchi公司;LC-20高效液相色谱仪(配有可变波长紫外检测器和LC Solution色谱工作站) 日本岛津公司;DEAE Sephadex A-25 广州伟伯化工有限公司;层析柱(1.0cm×40cm)、C18-H色谱柱(3.9mm×159mm,5μm) 美国Sepax Technologies公司。
1.3 方法
1.3.1 冲菜的加工处理
冲菜的微波处理:将100g新鲜冲菜放置于微波炉中进行微波处理,利用恒定的微波频率保持恒温,将数显温度计探针置于微波炉内,读取炉内温度,待温度稳定后迅速将已称质量的冲菜放入微波炉内进行微波处理,其间微波炉内温度为80℃,处理时间分别为10、20、30s和 40s。
冲菜的热烫处理:将100g新鲜冲菜浸没于3000g沸水中进行烫漂,利用电磁炉对加热频率进行恒定,以恒定水温。将数显温度计探针置于沸水内,读取水温,待水温稳定后将将已称质量的冲菜放入进行热烫处理,其间水温为98℃,处理时间分别为10、20、30s和40s。
冲菜的蒸汽处理:将100g新鲜冲菜悬挂于3000g水加热时形成的蒸汽之中受热,利用电磁炉对加热频率进行恒定,以恒定水温,将数显温度计探针固定于沸水形成的蒸汽之上,待蒸汽温度恒定后迅速将已称质量的冲菜放入进行蒸汽处理,其间蒸汽温度为100℃,处理时间分别为10、20、30s和40s。以上3种工艺完成后立即将处理后样品取出进行硫苷的提取和纯化。
1.3.2 硫苷的提取
称取5g处理后的冲菜鲜样,加入12mL甲醇并煮沸以使冲菜中的黑芥子酶失活,75℃水浴25min后,以4200r/min离心10min,沉淀用10mL 70%热甲醇再提取两次,再次离心,合并上清液可得硫苷粗提物。
1.3.3 硫苷的分离纯化
1.3.3.1 硫苷DEAE Sephadex A-25预处理
称取10g填料粉末加入蒸馏水,1h后倾去上层细粒。按每克干粉末加入15mL 0.5mol/L NaOH 溶液的比例,将填料浸泡于NaOH溶液中,搅匀后静置30min,反复用蒸馏水洗涤至pH值为中性,再以0.5mol/L HCl溶液重复上述操作。之后再用0.5mol/L NaOH溶液处理一次。最后,将填料浸泡于0.1mol/L,pH7.4的磷酸缓冲液中过夜。
1.3.3.2 硫苷的纯化
装柱后,用67%的甲醇对层析柱进行彻底清洗,上样5mL后在层析柱中加入硫酸酯酶100μL,12h以后,用40mL 60%甲醇和40mL 纯水分别对脱硫苷进行洗脱,洗脱后的溶液用旋转蒸发仪蒸干,溶于10mL水中,溶液用0.45μm的微孔滤膜过滤,进液相色谱仪分析。
1.3.4 硫苷HPLC分析
采用C18-H (4.6mm×250mm,5μm)色谱柱;柱温:25℃;检测波长:229nm;流速:1mL/min;以水(A相)和乙腈(B相)为流动相进行梯度洗脱,洗脱程序为:1min时,100% A;21min时,100% B;26min时,100% A,保持5min后结束,整个程序为31min;进样50μL。烯丙基硫代葡萄糖苷标品作为外标,HPLC条件同上。
1.4 硫苷含量的计算
烯丙基硫代葡萄糖苷标品的标准曲线为:y= 2×10-6x+0.3273(R2=0.9997)。利用标曲计算冲菜中各种硫苷的含量(μmol/100g),以鲜质量计。
硫苷的热降解用一级反应动力学模型描述,一级反应速率常数可采用公式(1)计算得出:

Arrhenius公式可以用来表明硫苷降解速率常数对于温度的依赖性。活化能Ea可以采用以下公式计算得出[8]:

式中:c0为硫苷起始含量;c为在选择温度下加热t段时间后的硫苷含量;k为一级反应速率常数/(min-1);k0为频率常数/(min-1);t为热处理时间/(s);Ea为活化能/(kJ/mol);R为气体常数(8.314J/(mol·K));T为绝对温度/K。
2 结果与分析
2.1 冲菜中硫苷的含量和种类
根据Oerlemans等[9]对红球甘蓝中的硫苷以及ISO 9167-1—1992[10]中对油菜籽中硫苷定性所采用的方法,采用保留时间法对本研究冲菜中硫苷进行定性。检测出9种硫苷,如表1所示。其中4-Hydroxyglucobrassicin、Glucobrassicin和4-Methoxyglucobrassicin为脂肪族硫苷,其余6种均为吲哚族硫苷。
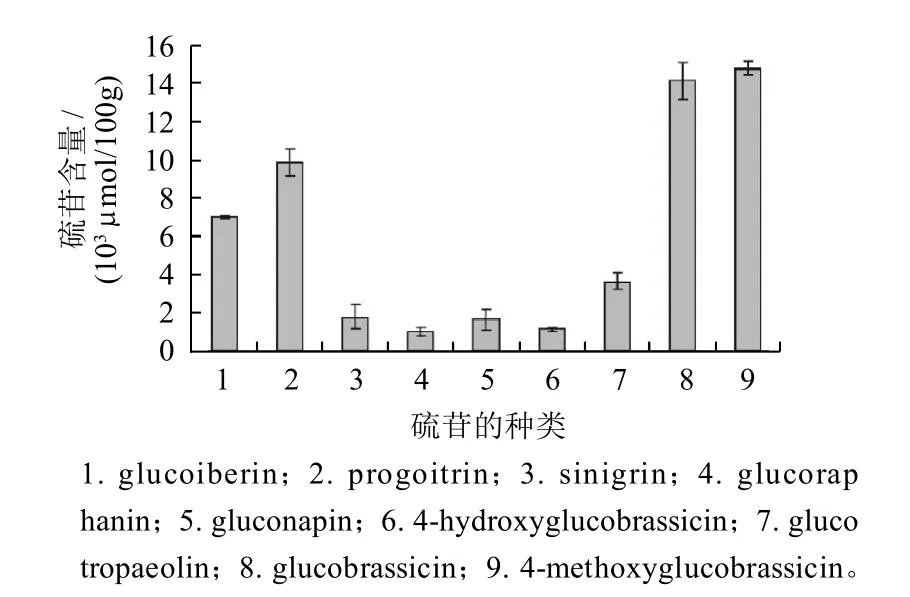
图1 高效液相色谱法检测冲菜中硫苷的含量Fig.1 The contents of identified glucosinolates in fresh Brassica juncea var. latipa
由图1可知,吲哚族硫苷总量大于脂肪族硫苷。其中含量较高的硫苷分别为Progoitrin、Glucobrassicin和4-Methoxyglucobrassicin。然而在Volden等[5]对5个品种的花椰菜(Aviso、Dania、Grafitti、Emeraude和Celio)硫苷研究中发现,Progoitrin为Aviso中的主要硫苷,Glucobrassicin为其余4种花椰菜中的主要硫苷,而4-Methoxyglucobrassicin在5种花椰菜中含量均为最低。在冲菜中含量最低的3种硫苷分别是Glucoraphanin、Gluconapin和4-Hydroxyglucobrassicin,然而这3种硫苷是红球甘蓝中的主要硫苷[11]。从总的硫苷含量来看,该冲菜中硫苷总含量远远高于国家标准规定100μmol/g,因此属于高硫苷蔬菜品种[12]。
2.2 硫苷热降解动力学

表1 高效液相色谱法检测冲菜中硫苷的种类Table 1 HPLC retention times of identified glucosinolates in fresh Brassica juncea var. latipa
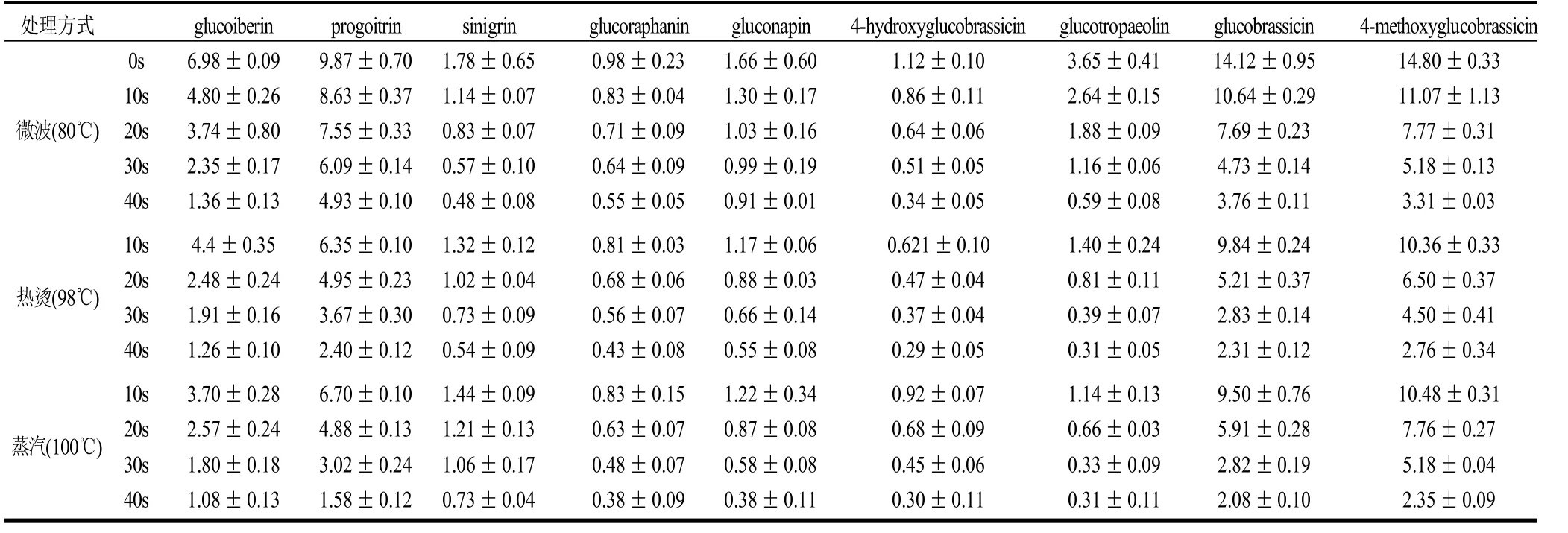
表2 不同处理方式对硫苷含量的影响Table 2 Influence of different processing methods on the kind and amout of glucosinolates in Brassica juncea var. latipa 103μmol/100g
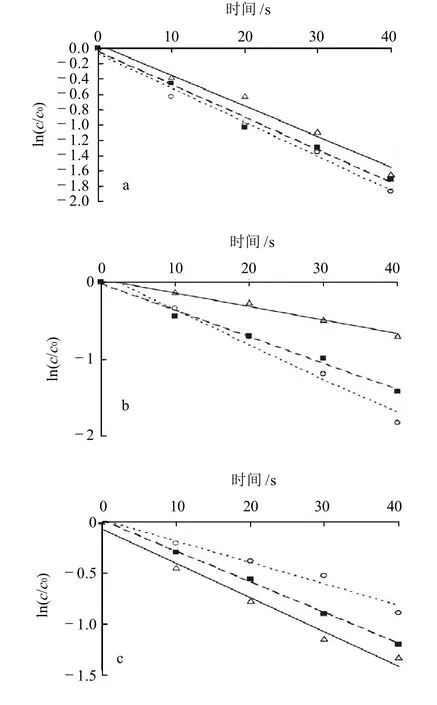
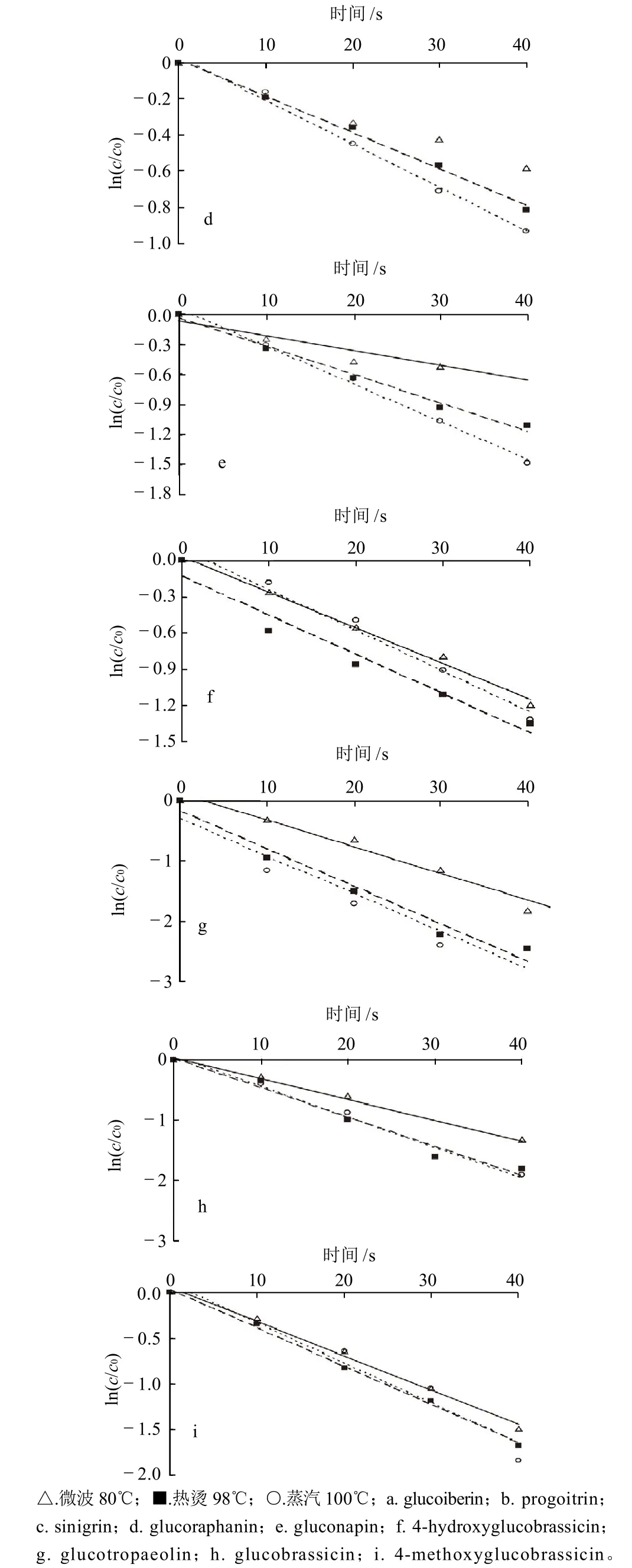
图2 在不同处理方式下冲菜中硫苷的热降解动力学曲线Fig.2 Degradation kinetic curves of glucosinolates in Brassica juncea var. latipa during processing by different methods
由表2可知,微波、热烫和蒸汽3种加工工艺都能显著降低冲菜中各硫苷的含量。并且随着处理时间的增加,硫苷的含量越来越低。降低的程度随着硫苷种类的不同而有较为显著的差别。将表2数据按照热降解动力学公式进行作图(图2),以表征这9种硫苷在不同加工工艺下的降解规律。
由图2可知,3种处理方式,不同种类的硫苷恰好符合一级热降解动力学模型。说明,在这3种处理方式中,温度是最能促使冲菜中硫苷降解的因素。根据Arrhenius公式,由lnk对1/T作图,可以计算出各硫苷的活化能Ea值。得到9种硫苷主要的一级热降解动力学参数见表3。
表3 在不同处理方式下硫苷的一级热降解动力学参数
Table 3 First-order degradation kinetic parameters for glucosinolates inBrassica junceavar.latipatreated by different methods
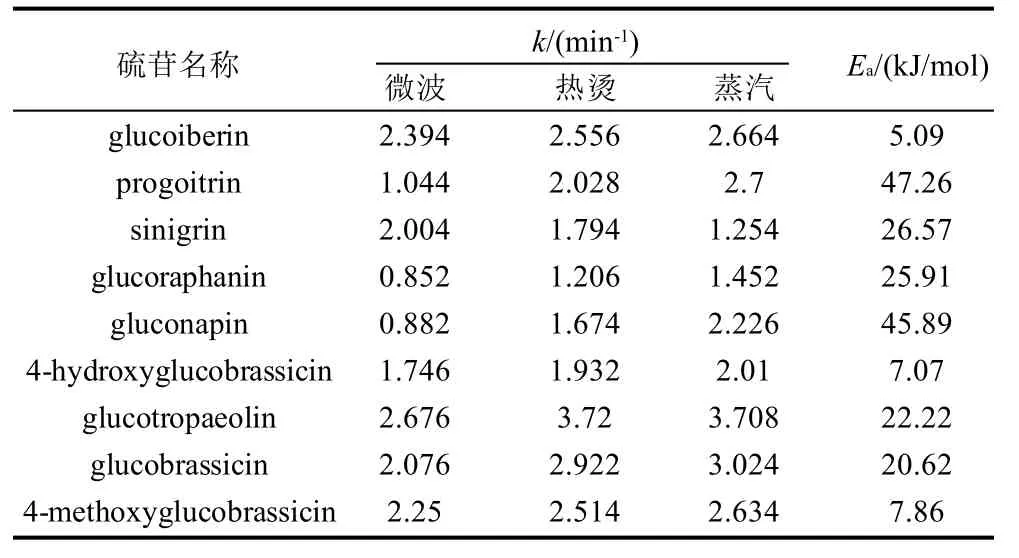
硫苷名称 k/(min-1) Ea/(kJ/mol)微波 热烫 蒸汽glucoiberin 2.394 2.556 2.664 5.09 progoitrin 1.044 2.028 2.7 47.26 sinigrin 2.004 1.794 1.254 26.57 glucoraphanin 0.852 1.206 1.452 25.91 gluconapin 0.882 1.674 2.226 45.89 4-hydroxyglucobrassicin 1.746 1.932 2.01 7.07 glucotropaeolin 2.676 3.72 3.708 22.22 glucobrassicin 2.076 2.922 3.024 20.62 4-methoxyglucobrassicin 2.25 2.514 2.634 7.86
Ea值代表硫苷对温度的依赖性,Ea值越大,表明该种硫苷的热敏感性越大,由表3可知,9种硫苷中对温度依赖性最大的是Progoitrin,而Glucoiberin、4-Hydroxyglucobrassicin和4-Methoxyglucobrassicin对温度的依赖性都较小。通过比较一级热降解动力学反应常数k值可知,Glucotropaeolin在3种加工工艺处理下,k值都比同种工艺处理下其他硫苷的k值大,证明其热稳定性最差;除此之外,微波工艺还最能促使Glucoiberin和4-Methoxyglucobrassicin的降解,热烫工艺最能促使Glucoiberin和Glucobrassicin的降解,蒸汽工艺也最能促使Glucoiberin和Glucobrassicin的降解。以上几种热稳定性较差的硫苷中,除Glucobrassicin和4-Methoxyglucobrassicin为吲哚族硫苷外,其余均属脂肪族硫苷。Ciska等[13]通过研究发现,蒸煮时吲哚族硫苷的损失量大于脂肪族硫苷;Oerlemans等[9]对红球甘蓝中硫苷的热降解研究也表明与脂肪族硫苷相比,吲哚族硫苷热稳定性较差,当发生热降解时,损失较多。而本研究结果却显示了冲菜中有两种脂肪族硫苷表现出较强的热不稳定性,这可能是由于蔬菜的种类不同,导致叶片的厚度、柔软度以及蔬菜纤维网络中的纤维含量和种类不同,从而造成不同蔬菜种类的硫苷降解情况有所变化[14-15]。
2.3 影响硫苷降解的处理方式
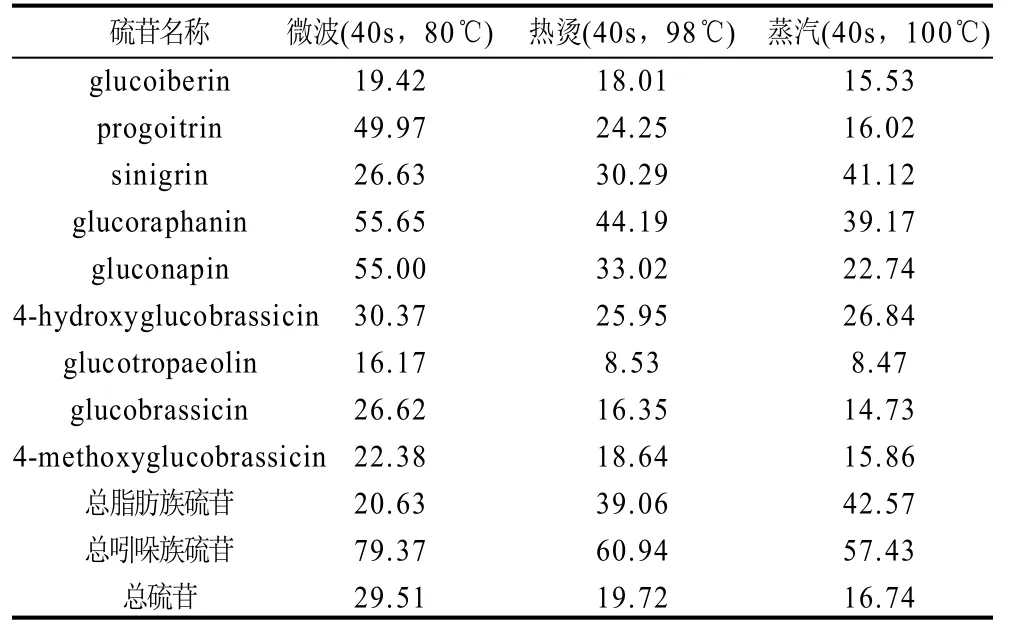
表4 不同处理方式对硫苷剩余量的影响Table 4 Influence of different processing methods on glucosinolates residue in Brassica juncea var. latipa %
由表4可知,除Sinigrin 之外,3种处理方式对总硫苷降解影响由大到小的顺序依次为蒸汽>热烫>微波,此顺序与工艺温度高低顺序相一致,进一步证明了3种加工工艺下,温度也即热因素最能影响冲菜中各种硫苷的含量。因此总硫苷的降解可能与温度的高低相关,温度高时,硫苷热降解发生较多,剩余量也就越少。对于单个硫苷而言,3种处理方式都能促使Glucotropaeolin发生最大程度的降解,其次是4-Methoxyglucobrassicin。3种处理方式对吲哚族硫苷的减少影响不大,主要造成的是脂肪族硫苷的降解。还值得注意的是在3种处理方式中,微波处理对脂肪族硫苷的影响最大,蒸汽处理反而影响最小。这也说明了虽然本研究中3种处理方式中的热因素对硫苷降解产生了不可忽视的影响,还存在其他因素例如微波穿透作用等能够影响冲菜中的硫苷含量的变化。由于脂肪族硫苷对十字花科蔬菜的特征风味贡献最大[16],因此可以看出,传统加工方法对冲菜中风味物质的生成影响不显著,有赖于依靠新技术、新工艺,减少十字花科蔬菜中的脂肪族硫苷,以增强冲菜的风味。关于这3种处理方式如何影响冲菜中特有的风味,后续研究中将有说明。
3 结 论
本研究采用高效液相色谱法,检测出了冲菜中9种主要的硫代葡萄糖苷的含量。选用微波、热烫和蒸汽,分别对3种处理方式造成的各种硫苷的热降解情况进行了研究。结果表明:冲菜中9种主要硫苷均符合一级热降解动力学模型,并且Glucotropaeolin在3种处理方式中的热稳定性均最差。3种处理方式对不同硫苷的影响各有不同,重点作用于脂肪族硫苷,对于吲哚族硫苷的降解效果不明显,因此可能会对冲菜的风味产生显著影响,3种处理方式中以蒸汽处理最能促使冲菜中总体硫苷的降解,而以微波处理最能促使对十字花科蔬菜中风味贡献最大的脂肪族硫苷的降解。
[1] FAHEY J W, ZALCMANNL A T, TALALAY P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants[J]. Phytochemistry, 2001, 56(1): 5-51.
[2] BONES A M, ROSSITER J T. The enzymic and chemically induced decomposition of glucosinolates[J]. Phytochemistry, 2006, 67(11): 1053-1067.
[3] de VOS R H, BLIJLEVEN G H. The effect of processing conditions on glucosinolates in cruciferous vegetables[J]. Ubersichtsbericht, 1988, 187(6): 526-529.
[4] VERKERK R, GAAG V D, DEKKER M, et al. Effects of processing conditions on glucosinolates in cruciferous vegetables[J]. Cancer Letters,1997, 114(1/2): 193-194.
[5] VOLDEN J, BORGE G I A, HANSEN M, et al. Processing (blanching,boiling, steaming) effects on the content of glucosinolates and antioxidant-related parameters in cauliflower (Brassica oleraceaL. ssp.botrytis)[J]. LWT-Food Science and Technology, 2009, 42(1): 63-73.
[6] VERKERK R, DEKKER M. Glucosinolates and myrosinase activity in red cabbage (Brassica oleraceaL. Var.capitataf.rubraDC.) after various microwave treatments[J]. J Agric Food Chem, 2004, 52(24):7318-7323.
[7] 牛丽影, 肖华志, 胡小松, 等. 冲菜辛辣风味物质的顶空固相微萃取-气质联用法测定[J]. 中国食品学报, 2005, 5(3): 122-123.
[8] REYES F L, CISNEROS-ZEVALLOS L. Degradation kinetics and colour of anthocyanins in aqueous extracts of purple- and red-flesh potatoes (Solanum tuberosumL.) [J]. Food Chemistry, 2007, 100(3): 885-894.
[9] OERLEMANS K, BARRETT D M, SUADES C B, et al.Thermal degradation of glucosinolates in red cabbage[J]. Food Chemistry, 2006,95(1): 19-29.
[10] International Organization for Standardization. ISO 9167-1—1992 Rapeseed: determination of glucosinolates content-Part 1: Method using high-performance liquid chromatography[S]. Switzerland: ISO, 1992.
[11] VOLDEN J, BORGE G I A, BENGTSSON G B. Effect of thermal treatment on glucosinolates and antioxidant-related parameters in red cabbage (Brassica oleraceaL. ssp.capitataf.rubra)[J]. Food Chemistry,2008, 109(3): 595-596.
[12] 李培武, 赵永国, 张文, 等. 中国甘蓝型油菜硫苷含量及组分分析[J].中国农业科学, 2005, 38(7): 65-71.
[13] CISKA E, KOZLOWSKA H. The effect of cooking on the glucosinolates content in white cabbage[J]. European Food Research and Technology,2001, 212(5): 582-587.
[14] WENNGERG M, EKVALL J, OLSSON K, et al. Changes in carbohydrate and glucosinolate composition in white cabbage (Brassica oleraceavar capitata) during blanching and treatment with acetic acid[J]. Food Chemistry, 2006, 95(2): 226-236.
[15] ROSA E A S, HEANEY R K. The effect of cooking and processing on the glucosinolate content: Studies on four varieties of portuguese cabbage and hybrid white cabbage[J]. Journal of the Science of Food and Agriculture, 1993, 62(3): 259-265.
[16] DEKKER M, VERKERK R. Dealing with variability in food production chains: a tool to enhance the sensitivity of epidemiological studies on phytochemicals[J]. European Journal of Nurition, 2003, 42(1): 67-72.
Influence of Different Processing Methods on Glucosinolates inBrassica junceavar.latipa
WANG Hui-xia1,LI Chen2,XUE Feng2,DONG Fang-xiao3,LI Zhao2,PAN Si-yi2,*
(1. National Drink and Provisions Oil Product Supervision and Inspection Center of Product Quality, Wuhan 430061,China;2. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;3. College of Animal Sciences and Technology, Huazhong Agricultural University, Wuhan 430070, China)
In order to elucidate the decomposition of glucosinolates inBrassica junceavar.latipaduring thermal processing by different methods, microwave radiation, water blanching and steam blanching were separately used to process the plant that is popular in Yangtze river delta as a traditional vegetable, and the untreated and treated samples of the vegetable were analyzed for their kind and amount of glucosinolates by high performance liquid chromatography (HPLC). The results showed thatBrassica junceavar.latipacontained two groups ofβ-thioglucoside-N-hydroxysulfates, namely the fatty group and indole group, and among them, progoitrin, glucobrassicin and 4-methoxyglucobrassicin were the most abundant compounds. The decomposition of glucosinolates inBrassica junceavar. latipaobeyed the first-order kinetics model regardless of which of the three processing methods was used. Glucotropaeolin displayed the worst thermal stability during the three processes. The decreasing order of the decomposition of glucosinolates inBrassica junceavar.latipawas found to be: steam blanching, water blanching and microwave radiation. Microwave radiation, however, could best drive the decomposition of glucosinolates from the fatty group making the largest contribution to the flavor of cruciferous vegetables.
glucosinolates;microwave;blanching;steaming;first-order degradation kinetics
TS255.1
A
1002-6630(2011)07-0168-05
2010-12-28
王会霞(1973—),女,工程师,本科,主要从事理化检验研究。E-mail:whx097@126.com
*通信作者:潘思轶(1964—),男,教授,博士,主要从事农产品加工化学研究。E-mail:pansiyi@mail.hzau.edu.cn

