补阳还五汤预处理对缺血再灌注损伤沙鼠脑组织血流量的影响
吴晓光,李 强,郭园园,陈文燕,任艳玲
(1.承德医学院,河北承德 067000;2.宽城县医院;3.承德医学院附属医院)
基础医学
补阳还五汤预处理对缺血再灌注损伤沙鼠脑组织血流量的影响
吴晓光1,李 强2,郭园园1,陈文燕1,任艳玲3
(1.承德医学院,河北承德 067000;2.宽城县医院;3.承德医学院附属医院)
目的:探讨补阳还五汤对缺血再灌注损伤沙鼠脑微循环血流量的影响。方法:48只长爪沙鼠随机分为4组:假手术组、模型组、补阳还五汤组和尼莫地平组。Kirino法制作沙鼠前脑缺血模型;应用激光多普勒血流仪观察脑组织血流量变化,伊文思蓝法观察血脑屏障通透性,干湿法观察脑组织含水量。结果:补阳还五汤能增加缺血1min、5min海马CA1区血流量(P<0.05);抑制再灌注15min急性高灌注(P<0.05),增加再灌注60min、120min、180min延迟性低灌注期的血流量(P<0.05);降低再灌注48h脑组织依文思蓝含量及脑组织含水量(P<0.05)。结论:补阳还五汤预处理对脑缺血再灌注损伤具有保护作用,作用机制可能与调节脑组织血流量,降低血脑屏障通透性,抑制脑水肿有关。
补阳还五汤;缺血再灌注;血流量
补阳还五汤具有益气、活血、通络的功效,是临床治疗中风的经典方剂之一。研究表明,补阳还五汤可抑制脑缺血后的钙离子超载、拮抗氧化损伤、阻断炎性反应、抑制细胞凋亡等[1-2]。但补阳还五汤对微循环血流量及血脑屏障通透性的影响少见报道。本研究通过观察脑缺血再灌注动物模型脑组织血流量、脑组织含水量以及血脑屏障通透性的变化,探讨补阳还五汤的保护作用及其机制。
1 材料方法
1.1 药物及仪器 补阳还五汤按《医林改错》原方所载的药方比例,按每钱3g换算(生黄芪120g,当归6g,赤芍4.5g,地龙、桃仁、红花、川芎各3g。药材购自北京同仁堂承德分公司)。水煎两次,40min/次,合并后浓缩为含生药4g/ml,4℃冷藏备用。尼莫地平:山东方明药业股份有限公司生产。MP-150多普勒血流计:美国BIOPCA公司,立体定位仪:日本NARISHIGE公司,电子分析天平:上海第二仪器厂。
1.2 实验动物分组及给药 雄性长爪沙鼠48只(首都医科大学实验动物科学部提供),体重65-80g。随机分为4组:假手术组、模型组、补阳还五汤组和尼莫地平组,每组12只。补阳还五汤用量为51g/kg/d,尼莫地平用量为20mg/kg/d,模型组和假手术组给予生理盐水1ml/100g灌胃;各组动物均每日灌胃1次,连续7d。
1.3 脑缺血再灌注动物模型的制作 沙鼠末次给药1h后,据Kirino法[3]制作沙鼠前脑缺血模型:2%戊巴比妥钠(30mg/kg)腹腔注射麻醉,分离暴露双侧颈总动脉,以无创性微动脉夹夹闭双侧颈总动脉,缺血45min后松开动脉夹,实行再灌注。模型组、补阳还五汤组和尼莫地平组沙鼠均建立脑缺血再灌注动物模型;假手术组仅分离暴露血管,不夹闭颈总动脉。
1.4 海马CA1区脑组织血流量监测 沙鼠头部水平固定于立体定位仪上,颅顶正中矢状切口,于前囟后2.0mm、中线向右旁开2.3mm,用颅钻钻一直径为1.5mm的小孔,将MP-150型激光多普勒血流计探头插入右侧鼠脑皮质下2.5mm,固定探头。连续测定每只沙鼠从缺血前10min至再灌注180min的海马CA1区脑组织血流灌注量。规定缺血前10min沙鼠脑血流量的平均值为该只沙鼠的基础血流量。
1.5 脑血管通透性测定 每组随机选取6只沙鼠,根据文献[3]制作伊文思蓝(Evans Blue,EB)标准曲线,测定再灌注48h缺血脑组织的EB含量(μg/g湿重脑组织)。方法:沙鼠经尾静脉注入2%EB(2ml/kg),2h后3%戊巴比妥钠(30mg/kg)麻醉下心内灌注生理盐水200ml,迅速断头取脑,称脑湿重后置于甲酰胺(1ml/100g脑组织)中,60℃孵育24h。1000rpm离心5min,分光光度计(λ=632)测定上清液OD值。根据标准曲线计算EB含量。
1.6 脑组织含水量测定 每组余下的6只沙鼠断头取脑,电子天平称脑湿重后,置于95℃烤箱中烤干至恒重,按公式计算大脑半球含水量:含水量(%)=[(湿重-干重)/湿重]×100%
2 结果
2.1 沙鼠海马CA1区血流量 见表1。缺血后,脑组织血流量迅速下降,约10min趋于稳定;恢复再灌10min,模型组海马CA1区可见急性高灌注(152.3±28.1)%,然后组织血流量又缓慢下降并出现延迟性低灌注。补阳还五汤组,恢复再灌后血流趋向稳定,缺血后急性高灌注和延迟性低灌注得到有效抑制。补阳还五汤组与模型组相比,缺血1min、5min及再灌注10min、60min、120min、180min的血流量均有统计学差异(P<0.05);与尼莫地平组相比无显著性差异。表明补阳还五汤预处理能调节缺血再灌注脑组织的血流量,但尚不能恢复到正常水平。
2.2 沙鼠脑组织EB含量 见表2。脑缺血45min再灌注48h,模型组脑组织EB含量显著升高,与假手术组比较有显著差异(P<0.01)。补阳还五汤组脑组织EB含量较模型组明显降低(P<0.05);与尼莫地平组相比无明显差异(P>0.05)。
表1 沙鼠海马CA1区血流量(%基值)(±s,n=12)

表1 沙鼠海马CA1区血流量(%基值)(±s,n=12)
与假手术组比较:*P<0.01,与模型组比较:#P<0.05
组别 缺血时间(min) 再灌注时间(min) 1 5 10 45 10 60 120 180假手术组 98.3±2.7 99.1±1.6 99.7±1.4 99.2±1.7 98.4±1.5 99.7±1.4 99.5±1.4 98.8±1.2模型组 11.6±3.3* 2.1±0.9* 0.4±0.3 0.4±0.2 152.3±28.1*62.7±14.5*53.6±15.6*42.4±16.1*尼莫地平组 13.7±2.3# 4.1±1.6# 0.3±0.2 0.2±0.1 142.4±18.9# 76.3±9.6#65.6±8.5#59.4±12.3#补阳还五汤组 14.1±2.6# 4.6±1.1# 0.4±0.2 0.3±0.2 134.3±12.3#85.1±11.8#72.2±9.4#68.3±15.1#
2.3 沙鼠脑组织含水量 见表2。脑缺血45min再灌注48h,模型组脑组织含水量显著高于假手术组(P<0.01)。补阳还五汤组脑组织含水量比模型组显著降低(P<0.05),与尼莫地平组比较无明显差异(P>0.05)。
3 讨论
脑组织急、慢性供血不足或血流中断可引起脑组织缺血、缺氧以及葡萄糖耗竭,触发能量代谢和电解质紊乱、无氧酵解及酸中毒等一系列病理生理变化,导致脑损伤。研究脑缺血再灌注后血流量的变化,对保护神经组织和促进康复具有重要意义[4]。
高颖等[5]发现,再灌20min内血流量可升至缺血前的180.3%,再灌后3h血流量降为缺血前的50.5%。本研究发现,在沙鼠脑组织恢复再灌后15min,同样观察到急性高灌注(140.3%);再灌后3h的血流量仅相当于缺血前的45.65%,表明脑组织血流量的异常改变在此时仍未恢复。研究认为,再灌注早期微循环血流逐渐恢复的同时,微血管却因酸中毒、缓激肽等多种因素的影响失去自动调节功能,导致再灌注后的急性高灌注[6];继高灌注之后,由于内皮细胞肿胀、红细胞阻塞微循环、白细胞滚动贴壁及纤维蛋白微血栓致微静脉末端阻塞等现象,并未因再灌注而完全缓解,故出现迟发性低灌注[7]。本实验结果还显示,补阳还五汤能有效增加沙鼠前脑缺血时脑组织血流量,抑制再灌注早期急性高灌注,增加再灌注后迟发性低灌注期的组织血流量。可能机制为[2]:下调缺血再灌注损伤诱导ET-1基因的表达,提高再灌注后期NOS活性和NO含量,缓解脑血管痉挛,调节脑血流量;抑制血管内皮细胞ICAM-1表达,减少中性粒细胞浸润;促进VEGF mRNA表达,调整血管的新生过程,改善缺血区组织血液灌流等。
表2 沙鼠脑组织EB含量和含水量(±s)
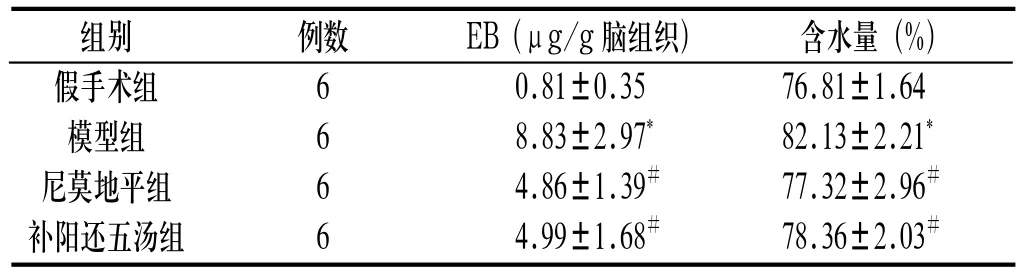
表2 沙鼠脑组织EB含量和含水量(±s)
与假手术组比较:*P<0.01,与模型组比较:#P<0.05
组别 例数 EB (μg/g脑组织) 含水量(%)假手术组 6 0.81±0.35 76.81±1.64模型组 6 8.83±2.97* 82.13±2.21*尼莫地平组 6 4.86±1.39# 77.32±2.96#补阳还五汤组 6 4.99±1.68# 78.36±2.03#
血脑屏障是存在于脑组织与血液之间的复杂细胞系统,能选择性地将血液中的物质向中枢组织转运,以保证中枢神经系统内环境的稳定及脑的正常功能。脑缺血再灌注时,各种损伤机制会导致血脑屏障基底膜的成分降解及微血管完整性破坏和功能受损,从而引起脑水肿、脑缺血缺氧等一系列病理生理变化,导致不可逆性神经元损害[8]。本研究发现补阳还五汤能降低脑缺血再灌注沙鼠脑组织EB含量,减轻脑组织水肿,对维持血脑屏障的完整性,减轻血管源性脑水肿具有重要意义。
因此,补阳还五汤可能因其多靶点的作用特性而具有良好的改善微循环血流量的作用,保证脑组织血液灌流,保持微血管、血脑屏障结构和功能的完整性,从而起到保护脑组织的作用。
[1]关莉,闫福曼,张哓东,等.补阳还五汤对全脑缺血模型大鼠再灌注不同时点皮质神经细胞钙超载的影响[J].安徽中医学院学报,2008,4(27):45-49.
[2]陈冬,杨洁红.补阳还五汤抗脑缺血作用的研究进展[J].中华中医药学刊,2010,28(1):72-74.
[3]Kirino T.Delayed neuronal death in gerbil hippocampus following ischemia[J]. Brain Res,1982,23(9): 57-69.
[4]Zhao I, Nowak TS Jr.CBF changes associated with focal ischemic preconditioning in the spontaneously hypertensive rat[J]. J Cereb Blood Flow Metab, 2006, 26(9):1128-1140.
[5]高颖,蔡定芳. MCAO大鼠MMP-9蛋白表达及补阳还五汤干预作用[J].复旦学报,2003,30(5):470-473.
[6]Joutel A, Monet-Leprêtre M, Gosele C, et al. Cerebrovascular dysfunction and microcirculation rarefaction precede white matter lesions in a mouse genetic model of cerebral ischemic small vessel disease[J]. Clin Invest, 2010, 120(2):433-445.
[7]Tseng MY, Hutchinson PJ, Richards HK, et al. Acute systemic erythropoietin therapy to reduce delayed ischemic deficits following aneurysmal subarachnoid hemorrhage: a Phase II randomized, double-blind,placebo-controlled trial.Clinical article[J]. J Neurosurg, 2009,111(1):171-80.
[8]Hua Q,Qing X,Li P.Brain microvascular endothelial cells mediate neuroprotective effects on ischemia/reperfusion neurons [J]. J Ethnopharmacol, 2010,13(4):11-28.
EFFECTS OF BUYANGHUANWU DECOCTION PRETREATMENT ON MICROCIRCULATION BLOOD FLOW OF CEREBRAL ISCHEMIA AND REPERFUSION IN GERBILS
WU Xiao-guang, LI Qiang, GUO Yuan-yuan, et al
(Chengde Medical College, Hebei Chengde 067000, China)
Objective:To explore the protective mechanism of BuYangHuanWu Decoction (BHD) on microcirculation blood flow in gerbils with cerebral ischemia-reperfusion.Methods:48 male gerbils were randomly divided into 4 groups (n=12): model group, sham operation group, BHD group and Nimodipine group. Transient forebrain ischemia animal model was established by using Kirino method. The microcirculation blood flow was detected with laser-Doppler; The permeability of BBB (blood brain barrier) was assessed using evan’s blue (EB) method; The water content in brain was tested with dry-wet method.Results:BHD could increase blood flow of hippocampus CA1 region at ischemia 1min and 5 min; inhibit hypertransfusion at 15min after reperfusion; increase blood flow at 60min, 120min and 180min after reperfusion(P <0.05). Meanwhile, BHD could decrease BBB permeability and water content of brain tissue after reperfusion (P <0.05).Conclusions:BHD pretreatment can protect brain ischemia-reperfusion injury through regulating cerebral microcirculation blood flow, decreasing BBB permeability and inhibiting cerebral edema.
BuYangHuanWu Decoction; Ischemia-reperfusion; Blood flow
R285.5
A
1004-6879(2011)02-0115-03
2010-11-02)

