破裂颅内微小动脉瘤介入栓塞技术探讨
徐浩文 付振强 孙石磊#
郑州大学第一附属医院 1)介入放射科 2)神经内科 郑州 450052
随着介入栓塞技术和介入材料的进步,介入治疗已经成为颅内动脉瘤的主要治疗手段。国际动脉瘤性蛛网膜下腔出血研究(ISAT)的1 a随访结果显示,颅内动脉瘤的介入栓塞较外科夹闭的相对和绝对危险性分别下降了22.6%和6.9%。然而该研究入选患者并未包括微小动脉瘤患者,故其结论尚不能适用于微小动脉瘤(最大径≤3 mm)[1]。由于微小动脉瘤通常瘤壁薄,瘤腔狭小,微导管到达动脉瘤腔难度较高,微导管和弹簧圈操作空间小,术中动脉瘤破裂风险较高;Van Rooij等将微小动脉瘤称为介入治疗的“高危动脉瘤”[2]。因此,破裂颅内微小动脉瘤的介入栓塞技术需作进一步成熟和完善。本研究回顾性分析了2007-01~2010-11我院介入栓塞治疗的破裂颅内微小动脉瘤22例患者的临床和影响结果,评估该方法的安全性和可行性,探讨介入栓塞微小动脉瘤技术要点。
1 临床资料
1.1 一般资料 蛛网膜下腔出血患者22例(全脑血管造影发现22个颅内微小动脉瘤),其中男13例,女9例;年龄34~78岁,平均54.5岁。Hunt-Hess分级:Ⅰ~Ⅱ级12例,Ⅲ~Ⅳ级10例。微小动脉瘤定义为脑血管造影显示动脉瘤最大径≤3 mm。
1.2 影像学资料 22个动脉瘤中,前交通动脉、大脑中动脉、后交通动脉和颈内动脉动脉瘤依次分别为7、2、8和5个;宽颈动脉瘤(瘤颈:体≥0.67)9个。
1.3 介入栓塞治疗方法 本组所有患者均全麻下行介入栓塞治疗,术中全身肝素化,尼莫地平持续静注。Seldinger技术穿刺股动脉,行全脑血管造影检查,了解动脉瘤大小、形态、位置,测量瘤颈、瘤体的直径。应用DSA三维重建技术,观察动脉瘤与其载瘤动脉的关系。根据动脉瘤的形态、位置、瘤颈、动脉瘤与载瘤动脉角度等情况准确塑形微导管,并选择不同的血管内栓塞技术。13个动脉瘤选择采用单纯弹簧圈栓塞,7个动脉瘤采用了支架辅助弹簧圈栓塞,2个采用了球囊辅助弹簧圈栓塞。所使用的弹簧圈包括GDC、Matrix、Microplex、Orbit、Axium,支架为Neurform、Enterprise、Solitare,球囊为Hyperglide和Hyperform。预期采用支架辅助技术治疗的患者,术前6 h口服负荷量的抗血小板聚集药物(阿司匹林300 mg+氯吡格雷300 mg),不能口服者,药物碾碎后经胃管内注入;术后服用阿司匹林100 mg/d和氯吡格雷75 mg/d,至少6个月。如果术中出现动脉瘤破裂出血,则立即鱼精蛋白中和肝素、控制血压,并继续填塞弹簧圈直至对比剂不再外溢。出现脑血管痉挛,则经动脉给予罂粟碱10~30 mg。
1.4 治疗效果评价 术后即刻造影评价栓塞结果,根据Raymond等[3]提出的颅内动脉瘤栓塞程度评估标准。完全栓塞:瘤腔、瘤颈均不见造影剂充盈;瘤颈残留:见瘤颈有造影剂充盈;瘤腔残留:瘤腔内填塞疏松,瘤颈和瘤腔内有造影剂充盈。术后随访病人有无再出血等并发症,造影复查有无复发。
2 结果
2.1 影像结果 栓塞后即刻造影发现22例微小动脉瘤中,完全栓塞17个,瘤颈残留1个,瘤腔残留4个,未出现弹簧圈脱出瘤腔和载瘤动脉血栓形成,术中动脉瘤破裂出血2例,继续填塞弹簧圈,动脉瘤得到致密栓塞,对比剂不再外溢。见图1、图2。
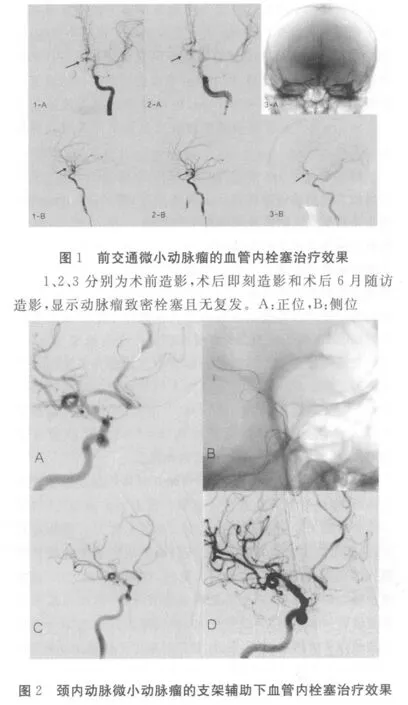
A:术前造影;B:支架及微导管放置于载瘤动脉;C:术后即刻造影显示动脉瘤致密栓塞;D:术后8个月随访造影,显示动脉瘤无复发
2.2 随访结果 本组所有患者截止到2011-02均通过电话或门诊随访3~38个月。22例患者中,2例死亡,1例系血管内治疗术中动脉瘤破裂患者,虽然动脉瘤最后得到致密栓塞,但该患者颅内出血量大,最终1周后死亡;1例于术后20个月死于交通事故。另1例术中动脉瘤破裂的患者,由于出血量较小,无明显神经功能障碍。随访未发现动脉瘤患者再次动脉瘤破裂出血,6例患者行脑血管造影复查未见动脉瘤复发。
3 讨论
Toshihiro等[4]对 419例颅内未破动脉瘤患者(529个动脉瘤)平均跟踪905 d,发现未破动脉瘤每年破裂率为1.4%。未破裂颅内动脉瘤国际合作研究(ISUIA)发现颅内动脉瘤破裂率与动脉瘤直径成正比,直径<7 mm动脉瘤每年破裂率仅为0.1%,微小动脉瘤(≤3mm)破裂率应该更低[5]。但是临床工作中微小动脉瘤破裂所致SAH的病例并不少见。有学者发现微小动脉瘤破裂所引起蛛网膜下腔出血量并不少于普通动脉瘤[6]。Taylor等[7]发现相对于普通动脉瘤,直径<5 mm的小动脉瘤破裂所致蛛网膜下腔出血的Fisher分级重症患者比例更高,但小动脉瘤破裂后所致的脑血管痉挛程度和预后则与直径≥5 mm的动脉瘤差异无统计学意义。Salary等[8]则发现动脉瘤破裂出血量及预后与动脉瘤大小无关。
2008年Nguyen等[9]回顾性分析 1992-08~2007-01所完成的682例颅内动脉瘤介入栓塞治疗,瘤径>3 mm的非微小动脉瘤622例弹簧圈栓塞术中破裂14例(2.3%),而60例微小动脉瘤术中破裂11例(18.3%),微小动脉瘤介入栓塞术中破裂出血率是非微小动脉瘤的8倍。本研究术中出现动脉瘤破裂出血2例,发生率为10.5%,低于上述报道,可能与近年来介入器械的改进和介入栓塞技术的不断成熟有关。Brisman等[10]总结28篇颅内动脉瘤介入栓塞文献,发现前交通动脉和基底动脉尖部的微小动脉瘤介入栓塞术中破裂风险高于其他部位。本研究2例术中破裂动脉瘤之一即位于前交通动脉。Tsutsumi等[11]报道19例微小动脉瘤的介入栓塞效果,其中完全栓塞率 78.9%,瘤颈残留率21.1%,病死率5.6%,与本组结果相似。
弹簧圈栓塞颅内动脉瘤,因瘤颈残留将增加动脉瘤复发的风险,所以瘤颈的处理至关重要。我们的经验是 :(1)第一个弹簧圈大小的选择极为重要,直径应稍大于动脉瘤直径,并选用较长的弹簧圈,使微弹簧圈形成的篮筐能覆盖瘤颈;(2)在填塞最后1~2枚弹簧圈时,根据瘤颈的大小,选择规格适当的弹簧圈,先在篮筐内填塞若干圈,然后回撤微导管至瘤颈,在瘤颈处继续填塞,因弹簧圈的篮筐内部分已经与其他弹簧圈相互缠绕,因此,篮筐外部分不致逸出动脉瘤。
相对于普通动脉瘤,微小动脉瘤的宽颈比例较高[8]。单纯弹簧圈栓塞治疗宽颈微小动脉瘤容易出现弹簧圈脱出瘤腔,移位至载瘤动脉的情况,严重者可引起载瘤动脉闭塞,造成严重并发症;另外,由于瘤腔小,微导管稳定性较差。对于此类动脉瘤,我们通常采用球囊或支架辅助技术进行弹簧圈栓塞。球囊辅助技术的优势为:(1)在弹簧圈输送过程中稳定微导管;(2)促使弹簧圈在动脉瘤腔里形成三维形状而不会突入载瘤动脉;(3)增加弹簧圈填塞率,加快瘤腔内血栓形成。但该技术的不足是:(1)球囊充盈时如果微导管过于固定,反而会增加弹簧圈填塞时动脉瘤破裂的风险;(2)球囊充盈时增加载瘤动脉血栓栓塞性事件和远端缺血的风险;(3)球囊反复充盈会增加血管内皮损伤及形成夹层的风险;(4)对于瘤颈过于宽大的微小动脉瘤,球囊回撤后,动脉瘤腔内的弹簧圈可能被血流冲至载瘤动脉,从而引起载瘤动脉血栓栓塞。
因此,对于宽颈微小动脉瘤的血管内治疗,我们更多的选用支架辅助下弹簧圈栓塞术。其优势体现在:(1)支架可改变动脉瘤内的血流动力学,减少血流对瘤壁的冲击,从而减少动脉瘤破裂的风险;(2)支架作为一种“栅栏”,可以减少弹簧圈突入载瘤动脉的几率,并增加弹簧圈致密栓塞率;(3)促进动脉瘤颈的内皮化。支架辅助技术有二种操作方式:微导管通过支架网孔技术和支架贴压微导管技术,前者是先将支架释放,使其骑跨动脉瘤口,再通过支架网眼将微导管置入到动脉瘤腔内,最后经微导管填塞弹簧圈;后者是先将微导管置入动脉瘤腔,再释放支架,将微导管贴压于支架与血管管壁之间,最后填塞弹簧圈。国外有学者将后者称为支架监禁技术(stent jailing technique)。在支架辅助弹簧圈栓塞治疗宽颈微小动脉瘤时,我们推荐支架监禁技术,因前者支架释放后,可能出现支架网丝正好覆盖微小动脉瘤口的情况,从而大大增加微导管进入瘤腔的难度;而支架监禁技术则避免了这种情况的发生。该技术的另一优势是由于微导管被支架贴压于支架与动脉壁之间,因为微小动脉瘤腔小,如果弹簧圈填塞期间,出现瘤腔已致密填塞,而尚余部分弹簧圈不能继续填入瘤腔的情况,这时解脱弹簧圈,残余部分被支架覆盖,不致在载瘤动脉漂浮,从而减少血栓栓塞性事件的发生。本组所采用的支架辅助技术均采用支架监禁技术,动脉瘤栓塞效果理想,未发生弹簧圈脱入载瘤动脉情况。
总之,微小动脉瘤栓塞治疗安全、有效,但手术难度较大,常需结合血管内支架或球囊辅助技术。规范且熟练的操作、手术方式和介入材料的选择是治疗成败的关键。
[1] Molyneux AJ,Kerr RS,Yu LM,et al.International Subarachnoid Aneury sm Trial(ISAT)Collaborative Group.International subarachnoid aneurysm trial(ISA T)of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised comparison of effects on survival,dependency,seizures,rebleeding,subgroups,and aneurysm occlusion[J].Lancet,2005,366:809-817.
[2] Van Rooij WJ,Sluzewski M,Beute GN,et al.Procedural complications of coiling of ruptured intracranial aneury sms:in-cidence and risk factors in a consecutive series of 681 patients [J].AJN R Am J Neuroradiology,2006,27:1 498-1 501.
[3] Jean Raymond,Fran?ois Guilbert,Alain Weill,et al.Long-Term Angiographic Recurrences After Selective Endovascular Treatment of Aneurysms With Detachable Coils[J].Stroke, 2003;,34:1 398-1 403.
[4] Toshihiro Ishibashi,Yuichi Murayama,Mitsuyoshi Urashima, et al.Unruptured Intracranial Aneury sms Incidence of Rupture and Risk Factors[J].Stroke,2009,40:313-316.
[5] Wiebers DO,Whisnant JP,Huston J,et al.International Study of Unruptured Intracranial Aneurysms Investigators. Unruptured intracranial aneurysms:natural history,clinical outcome,and risks of surgical and endovascular treatment[J]. Lancet,2003,362:103-110.
[6] Roos EJ,Rinkel GJ,Velthuis BK,et al.The relation between aneurysm size and outcome in patients with subarachnoid hemorrhage[J].Neurology,2000,54:2 334-2 336.
[7] Taylor CL,Steele D,Kopitnik TA Jr,et al.Outcome after subarachnoid hemorrhage from a very small aneury sm:a casecontrol series[J].J Neurosurg,2004,100:623-625.
[8] Salary M,Quigley M R,Wilberger JE.Relation among aneurysm size,amount of subarachnoid blood,and clinical outcome [J].J Neurosurg,2007,107:13-17.
[9] Nguyen T N,Raymond J,Guibert F,et al.Association of endovascular therapy of very small ruptured aneurysms with higher rates of procedure-related rupture[J].J Neurosurgury, 2008,108:1 088-1 092.
[10] Brisman JL,Niimi Y,Song JK,et al.Aneurysmal rupture during coiling:low incidence and good outcomes at a single large volume center[J].Neurosurgery,2005,57:1 103-1 108.
[11] Schuette AJ,Hui FK,Spiotta AM,et al.Endovascular therapy of very small aneurysms of the anterior communicating artery:five-fold increased incidence of rupture[J].Neurosurgery,2011,68:731-737.

