温度和光照对孔石莼光合作用的影响
潘光华,高 山,王广策,解修俊
(1.天津科技大学,天津 300457;2.中国科学院 海洋研究所,山东 青岛 266071)
孔石莼(Ulva pertusa)为绿藻门石莼属的一种大型经济海藻[1],主要分布于包括中国沿海在内的北太平洋西部,生长于中、低潮区以及大潮干潮线附近的石砾和岩礁上,在水质肥沃的内湾中生长尤为繁盛[2]。孔石莼除了具有较高的食用和药用价值外,还是一类较为理想的环境修复生物,主要体现在其对富营养化海水养殖环境的修复和对赤潮微藻的抑制等方面[3-4]。除了对生态环境的有利方面,石莼科绿藻还能够在特殊环境下大量异常增殖、聚集形成绿潮,这一近年来频发的生态灾害已经引起国内外学者的广泛关注和新一轮的研究热潮[5-9]。石莼对环境的影响与其自身的生理状态密切相关,目前,关于石莼生理、生态学方面的研究已有不少,其中大多侧重于生态因子方面的研究,例如,富营养盐、重金属、紫外辐射、二氧化碳等胁迫因子对石莼的生理影响以及微藻与石莼的克生效应研究[10-14],而关于基础生态因子温度和光照对石莼光合生理影响的研究还相对较少,鉴于此,本实验采用新兴的叶绿素荧光分析技术从光合作用角度研究温度和光照两种生态因子对孔石莼的生理影响,实验结果可作为对孔石莼生理学研究的必要补充,从而为进一步相关的生理生态研究提供基础理论依据和借鉴。
1 材料与方法
1.1 材料来源及处理
野生孔石莼采自青岛太平角,挑选健康藻体,用消毒海水反复冲洗多次以除去附着物和原生动物。处理后的藻体于水族箱中暂养备用,培养条件模拟采集地点,温度为 15℃,光照强度 30 μmol/(m2·s),光周期为12L:12D,充气培养。
1.2 培养条件的设定
温度因子实验中共设定10、20、30℃三个梯度,光照强度为 50 μmol/(m2·s),光周期为 12L:12D。以上每种梯度处理下设3个平行。藻株于500 mL三角瓶内充气培养,培养液为过滤煮沸的消毒海水,盐度为30,每2 d更换一次。每隔3 d进行一次藻体光合作用的测定。
1.3 光合作用的测定
采用德国WALZ公司的双通道PAM-100荧光仪通过饱和脉冲法对藻体光系统Ⅱ(PSII)叶绿素荧光和光系统Ⅰ(PSⅠ)的P700吸收变化进行同步测定分析。按照 Maxwell等[15]介绍的原理和方法分别对藻体PS II的最大光合量子产量(Fv/Fm)、实际光合量子产量Y(II)以及调节性能量耗散量子产量Y(NPQ)进行测定;PSⅠ反应中心的光合活性采用Schreiber等[13]介绍的方法在远红光存在的条件下对藻体施以饱和脉冲进行测定,参数包括光化学量子产量Y(I)和非光化学量子产量Y(ND)、Y(NA),其中Y(ND)和Y(NA)分别对应供体侧和受体侧电子传递受限而产生的非光化学量子产量。
光照实验同样采用该叶绿素荧光仪对新鲜采集的健康藻体在不同光照强度下的光合活性进行测定,测定方法和参数同上。
2 结果
2.1 温度对孔石莼光合作用的影响
由图1可知孔石莼 PSII的实际光合量子产量Y(II)在 10℃和 20℃条件下较为接近(以 10℃条件下略高),并且在整个实验周期内相对稳定,始终处于0.6~0.65范围内,显示较强的光合活性。30℃条件下的Y(II)随时间的延长下降明显,至第15天仅为0.45左右。
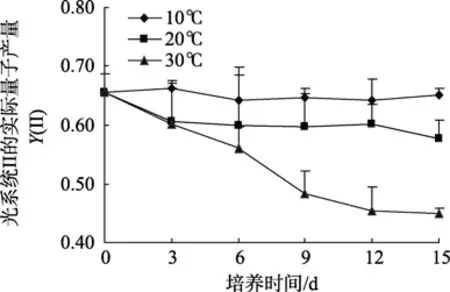
图1 不同温度下孔石莼光系统II的实际量子产量Y(II)Fig.1 Variation in effective PSII quantum yield (YII) of Ulva pertusa at different temperatures
光合作用过程中PS II调节性能量耗散Y(NPQ)在不同温度下随时间的变化趋势与实际量子产量Y(II)完全相反(图2)。30℃条件下Y(NPQ)持续升高,至第15天已达到0.21,而在10℃和20℃条件下保持相对恒定,基本处于0.07~0.1范围内,30℃条件下较高的光合作用热耗散量反映了藻体较强的光保护能力。
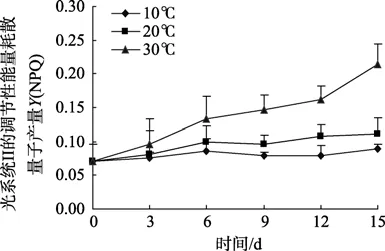
图2 不同温度下孔石莼光系统II的调节性能量耗散量子产量Y(NPQ)Fig.2 Variation in PSII quantum yield of regulated energy dissipation (Y NPQ) of Ulva pertusa at different temperatures
反映植物最大光和作用能力的最大光合量子产量Fv/Fm在三种温度条件下变化均不明显(表1)。15 d后,30℃下的Fv/Fm为 0.78,略低于其他两种温度,但该结果依然表明藻体处于较正常的生理状态。
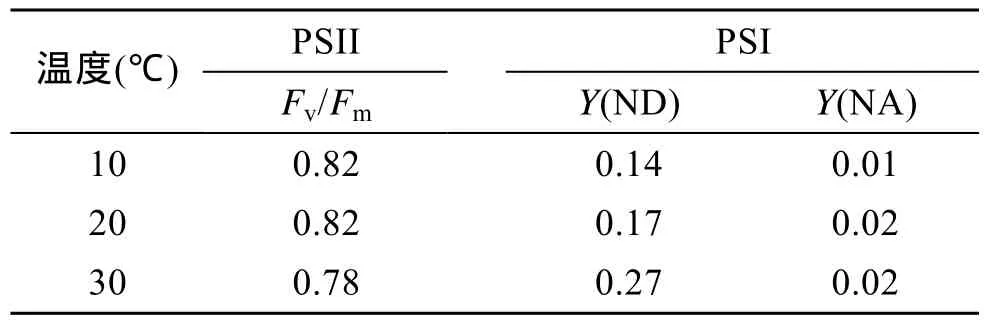
表1 经过 15 d的培养后,孔石莼在不同温度下的 PSII最大光合量子产量(Fv/Fm)以及 PSI两种非光化学量子产量Y(ND)和Y(NA)的比较Tab.1 Comparison of maximum PSII quantum yield(Fv/Fm) or nonphotochemical PSI quantum yield caused by donor side limitatiion (Y ND) and acceptor side limitation (Y NA) among individuals of Ulva pertusa at different temperatures after 15-day culture
PSⅠ的实际量子产量Y(I)在10℃和20℃条件下的变化趋势与Y(II)类似,即随着培养时间的延长,两种温度下的Y(I)值上升和下降的趋势均不明显,以 10℃条件下略高。30℃条件下的Y(I)在培养前期呈现完全下降趋势,并且明显低于其他两种温度,而在后期又呈现快速上升趋势,至第15天Y(I)值达到0.89,为三种温度下最高(图3)。
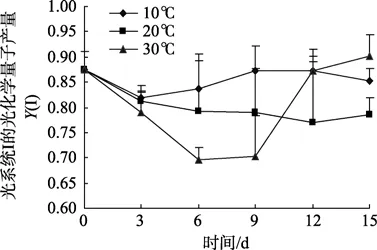
图3 不同温度下孔石莼光系统I的光化学量子产量Y(I)Fig.3 Variation in effective PSI quantum yield (YI) of Ulva pertusa at different temperatures
培养 15d后,光系统Ⅰ的两种非光化学能量耗散量子产量Y(ND)和Y(NA)的测定结果见表1。由表中可知,Y(ND)随着温度的上升而升高,在30℃条件下上升尤为明显,而Y(NA)随温度的变化趋势不明显,且量子产量始终处于较低水平。在三种温度条件下,Y(ND)始终大于Y(NA),由供体一侧电子流受限而产生的非光化学能量耗散量子产量占主导地位。
2.2 光照强度对孔石莼光合作用的影响
由图4可以看出两个光系统的实际量子产量Y(I)和Y(II)随着光照强度的增加体现出大体相同的变化趋势,当光照强度较低时,Y(II)随着光照强度的增加而上升,Y(I)基本维持恒定;当光照强度超过 60 μmol/(m2·s)时,Y(I)和Y(II)随着光照强度的继续增加而持续下降。当光照强度达到 1 000 μmol/(m2·s)时,Y(I)和Y(II)分别仅为0.15和0.10,显示微弱的光合作用,说明两个光系统的光合活性同时受到抑制。与此呈相反变化趋势的是Y(ND)和Y(NPQ),二者均随着光照强度的增加而持续上升,当光强达到 1300 μmol/(m2·s)时,Y(ND)接近 0.90,非光化学能量耗散的不断上升表明孔石莼在较高的光强下仍能够通过热耗散的形式有效地进行光保护。反映受体侧受限导致的非光化学能量耗散量子产量值Y(NA)始终处于极低水平,仅在 30~220 μmol/(m2·s)的光强范围内表现出先升高后降低的趋势,Y(NA)的变化表明藻体在对应的光强范围内存在不同程度的光损伤。
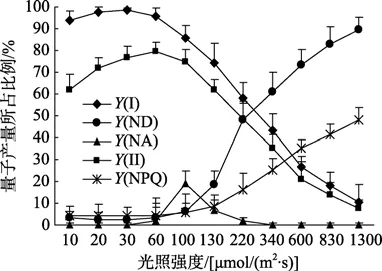
图4 孔石莼的PSII实际光合量子产量Y(II)、调节性能量耗散Y(NPQ)、PSI光化学量子产量Y(I)以及两种非光化学量子产量Y(ND)和Y(NA)的光照强度响应曲线Fig.4 Light response curve of effective PSII quantum yield(YII),Quantum yield of regulated energy dissipation(Y NPQ),Effective PSI quantum yield (YI),nonphotochemical PSI quantum yield (Y ND),and (Y NA) of Ulva pertusa
3 讨论
孔石莼作为一种温带性大型绿藻,广泛分布于北太平洋西部沿岸的潮间带水域,以往的研究表明该种对环境温度的变化具有较强的适应能力[16-17],本实验结果进一步印证了这一点,主要体现在孔石莼光系统II在三种温度下都具有较高的实际光合量子产量Y(II)且相互间差异较小。尽管如此,30℃下藻体的Y(II)值在后期呈现较为明显下降趋势,并伴随着光系统 II调节性能量耗散量子产量Y(NPQ)和光系统I量子产量Y(I)的上升。我们认为这一系列光合参数的变化趋势是藻体在高温逆境下进行的热耗散和状态转换两种保护性调节过程的反映。藻体热耗散过程的启动可以将过剩的光能以热量的形式释放,避免高温引起的光损伤,反映于30℃高温下Y(NPQ)的持续上升;与此同时启动的状态转换过程对两个光系统的激发能起到进一步平衡作用,以此避免光抑制并更加有效地利用光能[18-19]。本实验中藻体在高温下状态转换的结果导致光系统 I循环电子传递的增强和跨膜质子梯度的上升,反映于30℃下Y(I)的上升。状态转换机制已经在其他藻类、高等植物以及蓝细菌中陆续被发现,并被认为在适应胁迫环境方面起到重要作用[20-22]。我们通过本实验首次在孔石莼中发现类似的保护机制,结合野生孔石莼的生态特征,我们认为该机制极有可能在其渡夏过程中对高温环境的适应起到重要作用,以青岛海域四季生长的野生孔石莼为例,该种在夏季高达 28℃的海水温度环境下依然能够存活。值得注意的是,上述光保护机制往往是在牺牲部分实际光合效率的基础上进行的,并由此导致生物量的下降,这也是野生孔石莼的生物量在初夏时达到最高,而进入盛夏后大量减少的主要原因之一[17]。
孔石莼对光照的依赖性较低,当光照强度超过100 μmol/(m2·s)时即达到光饱和,这与邹定辉等[23]对10℃下石莼光饱和点的测定结果非常接近,其可能的原因是用于本次光合作用测定的野生孔石莼采集于秋季,海水温度同样为 10℃左右,相近的温度环境造成了二者对光照强度的近似响应。在远高于光饱和点的光强下,孔石莼同样表现很强的光保护能力,反映于在所设置的光照强度范围内,藻体的一类调节性热量耗散Y(NPQ)和Y(ND)随着光照的增强而上升,而反映光损伤的Y(NA)却始终保持在极低的水平。孔石莼对光照较低的依赖性和较强的光保护能力对于适应潮间带干出和浸没交替过程中光照强度的剧烈变化起到重要作用。
[1]刘朝阳,孙晓庆.石莼的综合开发与利用前景[J].饲料广角,2006,17:35-37.
[2]曾呈奎,张德瑞,张峻甫.中国经济海藻志[M].北京:北京:科学出版社,1962:43-50.
[3]Neori A,Cohen I,Gordin H.Ulva rigidabiofilters for marine fishpond effluents I.Growth,yield and C:N ratio[J].Botanica Marina,1991(34):483-489.
[4]南春容,张智海,董双林.孔石莼水溶性抽提液抑制 3种海洋赤潮微藻的生长[J].环境科学学报,2004,24(4):702-706.
[5]Blomster J,Bäck S,Fewer D P,et al.Novel morphology inEnteromorpha(Ulvophyceae) forming green tides[J].American Journal of Botany,2002,89(11):1756-1763.
[6]Gao S,Chen X Y,Yi Q Q,et al.A strategy for the proliferation ofUlva prolifera,main causative species of green tides,with formation of sporangia by fragmentation[J].Plos ONE,2010,5(1):e8571.
[7]牛建峰,范晓蕾,潘光华,等.青岛海域大面积聚集漂浮浒苔的显微观测[J].海洋科学,2008,32(8):30-33.
[8]王超,乔洪金,潘光华,等.青岛奥帆基地海域漂浮浒苔光合生理特点研究[J].海洋科学,2008,32(8):13-15.
[9]梁宗英,林祥志,马牧,等.浒苔漂流聚集绿潮现象的初步分析[J].中国海洋大学学报,2008,38(4):601-604.
[10]Msuya F E,Neori A.Effect of water aeration and nutrient load level on biomass yield,N uptake and protein content of the seaweedUlva lactucacultured in seawater tanks[J].Journal of Applied Phycology,2008(20):1021-1031.
[11]魏海峰,朱学惠,刘长发,等.Pb(Ⅱ)、Zn(Ⅱ)对孔石莼吸收总氨氮的影响[J].大连水产学院学报,2008,23(4):283-287.
[12]Rautenberger R,Bischof K.Impact of temperature on UV-susceptibility of twoUlva(Chlorophyta)species from Antarctic and Subantarctic regions[J].Polar Biology,2006(29):988-996.
[13]Gordillo F J L,Figueroa F L,Niell FX.Photon- and carbon-use efficiency inUlva rigidaat different CO2and N levels[J].Planta,2003(218):315-322.
[14]南春容,董双林.大型海藻孔石莼抑制浮游微藻生长的原因初探——种群密度及磷浓度的作用[J].中国海洋大学学报,2004,34(1):48-54.
[15]Maxwell K,Johnson G N.Chlorophyll fluorescence — a practical guide[J].Journal of Experimental Botany,2000,51(345):659-668.
[16]郭赣林,董双林,董云伟.温度及其波动对孔石莼生长及光合作用的影响[J].中国海洋大学学报,2006,36(11):941-945.
[17]Kim K Y,Choi T S,Kim J S, et al.Physiological ecology and seasonality ofUlva pertusaon temperate rockyshore[J].Phycologia,2004,43(4):483-492.
[18]Lunde C,Jensen P E,Haldrup A,et al.The PSI-H subunit of photosystem I is essential for state transitions in plant photosynthesis[J].Nature,2000(408):613-615.
[19]刘贤德,马为民,沈允钢.植物光合机构的状态转换[J].植物生理与分子生物学学报,2006,32(2):127-132.
[20]Ravenel J,Peltier G,Havaux M.The cyclic electron pathways around photosystem I inChlamydomonas reinhardtiias determined in vivo by photoacoustic measurements of energy storage[J].Planta,1994 (193):251-259.
[21]Ducruet J M,Roman M,Havaux M,et al.Cyclic electron flow around PSI monitored by afterglow luminescence in leaves of maize inbred lines(Zea maysL.):correlation with chilling tolerance[J].Planta,2005 (221):567-579.
[22]Jeanjean R,Matthijs H C P,Onana B,et al.Exposure of the cyanobacteriumSynechocystisPCC6803 to salt induces concerted changes in respiration and photosynthesis[J].Plant Cell Physiol,1993(34):1073-1079.
[23]邹定辉,高坤山.在水生与气生状态下石莼光合作用对光照和温度的响应[J].植物学通报,2003,20(6):713-722.

