中国对虾细胞色素P450基因CYP4原核表达条件优化
张 喆,李 健,王 芸,3,韩俊英,4
(1.中国水产科学研究院 黄海水产研究所,山东 青岛 266071;2.中国水产科学研究院 南海水产研究所,广东 广州 510300;3.上海海洋大学 水产与生命学院,上海 200090;4.大连海洋大学 生命科学与技术学院,辽宁 大连 116023)
细胞色素P450酶系(cytochrome P450 monooxygenases,简称 CYP)是广泛存在于几乎所有生物体中的一类代谢酶[1],是一簇结构、性质相似而又有差异,由基因超家族编码的含血红素和硫羟基的结合蛋白,可以代谢多种内源物质(保幼激素及其类似物、蜕皮甾酮、脂肪酸和信息素等)和外源物质(药物、环境毒物等),与生物的生长发育、环境适应密切相关,具有重要的生物学意义[2]。虽然海洋无脊椎动物体内细胞色素P450酶的含量较之哺乳动物要低很多[3],但其在海洋无脊椎动物中所起的作用却受到人们极大的关注。
CYP4家族是细胞色素P450酶系中最古老的家族之一,大约起源于12.5亿年以前[4],目前在人类、大鼠、鱼及多种节肢动物体内均有发现,其功能涉及脂肪酸的 ω-羟化反应及保幼激素的降解等多种内源性物质的代谢,同时也参与多种外源化合物的代谢。有关无脊椎动物编码 CYP4蛋白相关基因的研究在昆虫中取得了较好进展,中国学者先后由致倦库蚊溴氰菊酯抗性株及淡色库蚊抗溴氰菊酯品系内克隆得到的细胞色素P450,经比对均属于CYP4家族[5,6],说明CYP4家族可能与动物体内溴氰菊酯代谢有关。目前有关海洋无脊椎动物细胞色素P450的研究主要集中在基因克隆及功能分析方面。CYP4基因在许多海洋甲壳动物中都有发现,包括青蟹(Carcinus maenas)[7]、利莫斯螯虾(Orconectes limosus)[8]、湖虾(Penaeus setiferus)和美洲螯龙虾(Homarus americanus)等,并研究了CYP4基因对苯并芘、多氯联苯、多环芳烃等环境污染物的响应[9]。中国对虾(Fenneropenaeus chinensis)主要分布于中国黄渤海和朝鲜西部沿海,是中国主要的养殖虾类,而有关中国对虾细胞色素P450基因的相关研究还未见报道。
作者根据本室克隆得到的中国对虾CYP4基因cDNA序列设计引物,构建CYP4基因表达载体,实现该基因在大肠杆菌(Escherichia coli)中的原核表达,并对表达条件进行优化。为今后制备免疫抗体,建立免疫组化方法对中国对虾CYP4基因功能研究奠定了基础。
1 材料与方法
1.1 实验动物
实验用中国对虾购自山东省青岛市胶州宝荣水产公司,于实验条件下暂养10 d至RNA提取。
1.2 质粒与菌株
原核表达载体 pET28a由中国水产科学研究院黄海水产研究所海水养殖生物疾病控制与病原分子生物学实验室馈赠;克隆菌株 DH5α购自天根生化科技(北京)有限公司;表达菌株Rosetta(DE3)购自上海今迈生物科技有限公司。
1.3 试剂及工具酶
Ex-Taq DNA聚合酶、T4 DNA连接酶及质粒提取试剂盒购自 TaKaRa公司;限制性内切酶 NheI、XhoI和低分子量标准蛋白购自NEB公司;胶回收纯化试剂盒为天根生化科技(北京)有限公司产品;卡那霉素、IPTG、丙烯酰胺等均为国产或进口分析纯试剂。
1.4 中国对虾CYP4基因的RT-PCR扩增
1.4.1 引物合成与设计
根据本实验室得到的中国对虾CYP4基因cDNA序列(GenBank登陆号:GU218693.1)的开放阅读框设计,利用Primer Primer 5 软件设计1对特异性引物:上游引物 CYP4 - F:5’-GCGCTAGCTGGATTTACAAAAGACAGCAAAAGGTGTG-3’; 下 游 引 物CYP4-R:5’-GCCTCGAGTTATTTCCTGGGATGAAGCTTTAGGGGA-3’,由上海生工生物工程有限公司合成。预期扩增片段 1446bp,其中在上游和下游引物5’端各引入NheI和XhoI酶切位点(下划线标出)和保护碱基。
1.4.2 目的片段的扩增与回收
采集健康中国对虾肝胰腺提取总 RNA,反转录合成cDNA作为模板进行PCR扩增。PCR反应体系为:灭菌双蒸水 17.25 μL,10×buffer(含 Mg2+) 2.5 μ L,dNTP(10 mmol/L) 2 μL,CYP4-F (10 mmol/L) 1μL,CYP4-R (10 mmol/L) 1 μL,cDNA 模板 1 μL,DNA 聚合酶0.25 μL。PCR反应条件为:95 ℃预变性5 min;94 ℃变性1 min,65℃退火2 min,72 ℃延伸2 min,30个循环;72 ℃延伸10 min。PCR扩增产物以1.0%琼脂糖凝胶电泳检测分离,回收目的条带,方法参照琼脂糖凝胶回收试剂盒进行。
1.5 重组质粒p28a-CYP4的构建与鉴定
将回收的PCR产物与pET28a用Xho I 和Nhe I进行双酶切,在T4连接酶作用下将CYP4基因与线性 pET28a载体连接,构建表达载体 p28a-CYP4,转化 HD5α后利用 Kan抗性平板筛选阳性克隆进行PCR、双酶切及测序(上海生工生物工程有限公司)鉴定,以确定开放阅读框编码正确。DH5α的转化参照文献[10]进行。
1.6 CYP4基因在大肠杆菌中的表达
将重组质粒p28a-CYP4转化Rosetta (DE3)感受态细胞,构建重组菌株 Rosetta/p28a-CYP4,pET28a转化 Rosetta菌株构建重组菌株 Rosetta/pET28a,挑取转化平板上的单克隆接种于 LB液体培养基(含Kan 30 μg/mL 和 Cam 34 μg/mL)中 37℃培养至 OD600约为0.4~0.6时,加入IPTG至终浓度为1.0 mmol/L,继续培养6 h,取菌液1 mL离心收集菌体,重悬于SDS-PAGE上样缓冲液中,充分打散后沸水浴 10 min,离心去上清进行SDS-PAGE电泳检测蛋白表达情况,方法参照文献[10]。
1.7 重组菌株原核表达条件的优化
1.7.1 温度
将重组菌株 Rosetta/p28a-CYP4按照 1%接种量分别接种到1个含100 mL LB液体培养基(含Kan 30 mg/L和Cam 34 mg/L)三角瓶中,于37℃条件下培养至 OD600为 0.5时加入 IPTG使其终浓度为 1.0 mmol/L,后将菌液均分为5份,分别于25、28、31、34和37℃诱导6 h。
1.7.2 IPTG浓度
将重组菌株 Rosetta/p28a-CYP4按照 1%接种量分别接种到1个含140 mL LB液体培养基(含Kan 30 mg/L和Cam 34 mg/L)三角瓶中,于37℃条件下培养至OD600为0.5时均分为7份,加入IPTG使其终浓度分别为0、0.2、0.4、0.6、0.8、1.0和1.2 mmol/L,37℃继续培养6 h。
1.7.3 诱导时机
将重组菌株 Rosetta/p28a-CYP4按照 1%接种量分别接种到7个含20 mL LB液体培养基(含Kan 30 mg/L和Cam34 mg/L)的三角瓶中, 37℃条件下培养至 OD600分别为 0.27、0.35、0.43、0.51、0.59、0.67和0.75,加入IPTG使其终浓度为1.0 mmol/L,37℃继续培养6 h。
1.7.4 诱导时间
将重组菌株 Rosetta/p28a-CYP4按照 1%接种量分别接种到1个含20 mL LB液体培养基(含Kan 30 mg/L和Cam 34 mg/L)的三角瓶中,于37℃条件下培养至 OD600为 0.5,加入 IPTG使其终浓度为 1.0 mmol/L,37℃继续培养,分别于加入IPTG后的1、2、3、4、5、6、7、8 和 24 h 取样。
1.7.5 蛋白质含量测定
用紫外分光光度计和Gel-pro Analyzer 4.5软件分析蛋白样和电泳图谱,得到总蛋白含量和重组蛋白含量。
2 结果
2.1 p28a-CYP4表达载体PCR和酶切检测结果
由图1可以看出,重组质粒经双酶切后,得到大小约为1500bp和5200bp的两个片段,与预期结果一致;PCR结果得到与目的片段大小相符的产物;测序结果显示CYP4基因开放阅读框连接正确,成功构建重组质粒p28a-CYP4。

图1 重组质粒的酶切及PCR检测Fig.1 Identification of the recombinant plasmid by enzyme digestion and PCR
2.2 CYP4基因在Rosetta中的原核表达
由图2中可以看出,Rosetta/p28a-CYP4重组菌株诱导后在56.0 kDa处有1条显著表达条带,与软件预测大小相一致,表明中国对虾CYP4基因实现在E.Coli中的表达。
2.3 重组菌株原核表达条件优化
2.3.1 温度对CYP4基因表达的影响
由图3和图4可知,25 ℃诱导菌体总蛋白含量最高,为 46.41 g/L,而目的蛋白仅占总蛋白含量的14.72%;37 ℃诱导时目的蛋白含量达到7.93 g/L,占总蛋白的25.50%。

图2 重组菌株Rosetta/28a-CYP4诱导表达的SDS-PAGE分析Fig.2 Induced expression of Rosetta/28a-CYP4 analyzed by SDS-PAGE

图3 Rosetta/p28a-CYP4在不同温度诱导下表达的 SDSPAGE分析Fig.3 Expression of Rosetta/28a-CYP4 induced at different temperatures analyzed by SDS
2.3.2 IPTG浓度对CYP4基因表达的影响
由图5和图6可知,当IPTG浓度为0.8 mmol/L时菌体总蛋白最高,为 39.0 g/L,此时目的蛋白为9.95 g/L,占总蛋白的 25.51%;当 IPTG浓度为 1.2 mmol/L时,菌体目的蛋白达到14.32 g/L,占总蛋白的52.41%。
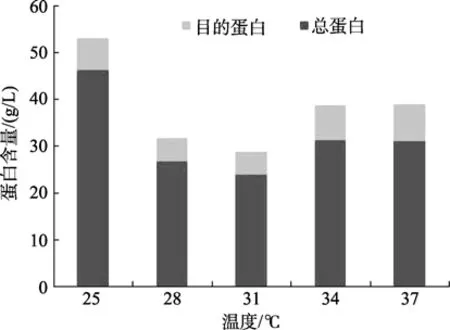
图4 不同温度诱导条件下Rosetta/p28a-CYP4蛋白含量变化Fig.4 Variation of protein contents of Rosetta/28a-CYP4 induced at different temperatures

图5 Rosetta/p28a-CYP4 在不同 IPTG浓度诱导下的SDS-PAGE分析Fig.5 Expression of Rosetta/28a-CYP4 induced with different concentrations of IPTG analyzed by SDS
2.3.3 诱导时机对CYP4基因表达的影响
图7、图8所示为菌液不同OD值诱导目的蛋白表达差异。由图中可知,当菌液OD600为0.75时诱导菌体总蛋白含量最高,为 46.74 g/L,此时目的蛋白占总蛋白的 20.88%;当 OD600为 0.59时,目的蛋白含量达到10.33 g/L,占总蛋白的25.51%。
2.3.4 不同诱导时间对CYP4基因表达的影响
由图9和图10可以看出,随着诱导时间的推移,菌体总蛋白含量呈现先增加后下降的趋势,在5 h达到37.73 g/L,此时目的蛋白占总蛋白的23.05%;诱导6 h时总蛋白为34.72 g/L,目的蛋白则为8.86 g/L,占总蛋白的25.51%,达到最大值。

图6 不同IPTG诱导条件下Rosetta/p28a-CYP4蛋白含量变化Fig.6 Variation of protein contents of Rosetta/28a-CYP4 inducted with different IPTG concentrations

图7 Rosetta/p28a-CYP4不同OD600诱导SDS-PAGE分析Fig.7 Expression of Rosetta/28a-CYP4 induced at different OD600
3 讨论
3.1 中国对虾CYP4基因的原核表达
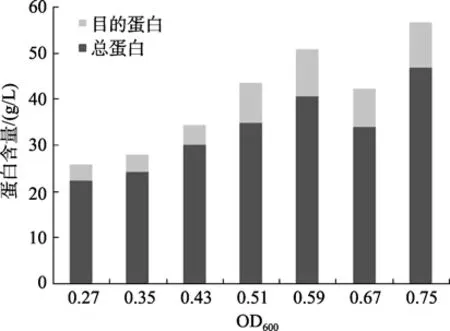
图8 不同时机诱导Rosetta/p28a-CYP4蛋白含量变化Fig.8 Variation of protein contents of Rosetta/28a-CYP4 induced at different OD600

图9 Rosetta/p28a-CYP4不同诱导时间SDS-PAGE分析Fig.9 Expression of Rosetta/28a-CYP4 inducted at different time
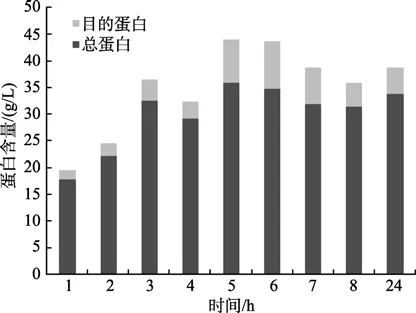
图10 不同诱导时间Rosetta/p28a-CYP4蛋白含量变化Fig.10 Variation of protein contents of Rosetta/28a-CYP4 induced at different times
细胞色素P450是机体对内、外源物质,尤其是药物进行生物转化的重要酶系,作为细胞色素 P450最古老的家族之一,CYP4基因在许多海洋无脊椎动物中都有发现[9],且在海洋软体动物Mytilus edulis微粒体中检测到了其在蛋白质水平的表达[11],而有关海洋甲壳动物CYP4基因功能的研究却十分有限。除了参与外源物质的代谢以外,CYP4基因在节肢动物荷尔蒙代谢中也起着重要作用[4]。Aragon等[12]发现CYP4C15基因在小龙虾(Orconectes limosus)Y-器官中显著表达,提示该基因可能参与了蜕皮激素的生物合成。研究P450基因的结构是了解其在生物体生长发育及内外源物质代谢所起功能的重要环节。
作者构建了中国对虾CYP4基因重组载体p28a-CYP4,并首次实现该基因在大肠杆菌的原核表达。张宝等[13]将CYP3A4基因同时接入 pET- 22b(+)、pET-28b(+)和 pET-32a(+)3种载体中,结果只有pET-32a(+)-CYP3A4可以表达目的蛋白,该蛋白大约占细菌总蛋白的40%。本研究表明pET28a载体可以实现中国对虾CYP4基因的表达,且目的蛋白占总蛋白的含量可以达到50%以上,说明pET28a是有效的CYP4基因表达载体。关桦楠等[14]克隆了青杨脊虎天牛(Xylotechus rusticus)CYP4G2基因片段并在E.Coli中实现原核表达,SDS-PAGE电泳检测到一条22.0 kDa大小的外源蛋白表达。李秀兰等[15]将淡色库蚊(Culex pipieus)CYP4E2r6基因构建重组载体,在BL21中实现原核表达,外源蛋白大小约为 42.0 kDa。中国对虾CYP4基因编码蛋白质全长512氨基酸,表达蛋白大小为 56.0 kDa左右,与淡色库蚊CYP4E2r6表达蛋白大小接近,大于青杨脊虎天牛CYP4G2表达蛋白,说明CYP4基因在不同物种之间差异较大。
3.2 Rosetta/p28a-CYP4原核表达条件的优化
重组菌体的蛋白表达量受到诱导剂浓度、接种量、诱导温度、诱导时间等诸多因素的影响。
董元凌等[16]在进行家蚕CYP337A1基因的原核表达研究时发现诱导 1~2 h随时间推移目的蛋白含量增加,而2 h后随着诱导时间的延长,目的蛋白表达量无明显差异;在诱导温度的比较上发现,温度为 25 ℃时,诱导表达蛋白量较低,温度为 32 ℃和37 ℃时,表达量较高但蛋白量差异不明显;IPTG浓度为 0.6 mmol/L时目的蛋白占总蛋白含量最高,而当IPTG浓度大于0.6 mmol/L时,其诱导表达量不受IPTG变化的影响,认为这是由于 IPTG对细菌生长有一定的抑制作用导致[17]。潘滨等[18]在进行烟草曲茎病毒复制相关蛋白基因的原核表达条件优化时发现,IPTG浓度 0.5 mmol/L时目的蛋白表达量最高,随着IPTG浓度增加目的蛋白表达量有下降趋势,诱导时间以4 h为宜,过长或过短都会影响蛋白的积累量。岳盈盈等[19]实现了风疹病毒包膜糖蛋白E1的原核表达并对其表达条件进行了优化,发现诱导温度、IPTG浓度及表达时间均对重组蛋白有较大的影响。
本研究发现诱导温度、IPTG浓度、诱导时机及时间均可影响重组蛋白及菌体总蛋白的表达量。37 ℃诱导时菌体目的蛋白含量最高,与上述研究结果一致。IPTG对目的蛋白占总蛋白含量的影响最为显著,IPTG为1.2 mmol/L时,目的蛋白占总蛋白含量最高,与之前的研究结果并不一致,可能是由于表达菌株、重组载体不同导致。诱导时间则对目的蛋白的含量影响最为明显,诱导5 h时目的蛋白含量最高,其后呈下降趋势,与有关文献报道一致[18]。
通过条件优化认为重组菌株 Rosetta/p28a-CYP4的最佳诱导温度为 37 ℃,最佳 IPTG浓度为 1.2 mmol/L,最佳诱导时机及诱导时间分别为 0.59和 6 h。中国对虾CYP4基因的原核表达对进一步在蛋白水平上研究该基因的功能具有一定意义。
[1]冷欣夫,邱星辉.细胞色素 P450酶系的结构功能与应用前景[M].北京:科学出版社,2001:1-55.
[2]Matthias D,Sabine E,Chimene A,et al.Cloning,expression and characterization of CYP102A7,a self-sufficient P450 monooxygenase fromBacillus licheniformis[J].Applied Microbiology Biotechnology,2008,79:931-940.
[3]Elmamlouk T H,Gessner T.Mixed function oxidases and nitroreductases in hepatopancreas ofHomarus americanus[J].Comparative Biochemical and Physiology,1976,53(2):57-62.
[4]Simpson A E C M.The cytochrome P450 4 (CYP4)family[J].General Pharmacology,1997,28:351-359.
[5]腾达,李秀兰,公茂庆,等.淡色库蚊抗溴氰菊酯品系CYP4家族新成员基因克隆机序列分析[J].中国寄生虫病防治杂志,2004,17(2):65-67.
[6]李秀兰,腾达,孙艳,等.淡色库蚊细胞色素 P450 CYP4E2r6基因的克隆、表达及鉴定[J].中国人兽共患病杂志,2005,21(7):552-557.
[7]Rewitz K,Styrishave B,Andersen O.CYP330A1 and CYP4C39 enzymes in the shore crab Carcinus maenas:sequence and expression regulation by ecdysteroids and xenobiotics[J].Biochemical and Biophysical Research Communications,2003,310:252-260.
[8]Chantal D V,Detlef B,Moshe T,et al.Cloning of a novel cytochrome P450(CYP4C15) differentially expressed in the steroidogenic glands of an arthropod[J].Biochemical and Biophysical Research Communications,1999,264:413-418.
[9]Snyder M J.Cytochrome P450 enzyme belonging to the CYP4 family from marine invertebrates[J].Biochemical and Biophysical Research Communications,1998,249(1):187-190.
[10]萨姆布鲁克 J,拉塞尔 D W,黄培堂.分子克隆实验指南[M].3 版.北京:科学出版社,2002:26-107.
[11]Peters L D,Nasic C,Livingstone D R.Immunochemical investigations of cytochrome P450 forms/epitopes(CYP1A,2B,2E,3A and 4A) in digestive gland ofMytilussp.[J].Comparative Biochemistry and Physiology,1998,121C:361-369.
[12]Aragon S,Claudinot S,Blais C,et al.Molting cycle-dependent expression of CYP4C15,a cytochrome P450 enzyme putatively involved in ecdysteroidgenesis in the crayfishOrconectes limosus[J].Insect Biochemistry and Molecular Biology,2002,32:153-159.
[13]张宝,霍霞,齐宗利,等.CYP3A4基因原核表达质粒构建与诱导表达[J].生命科学研究,2007,11(1):28-32.
[14]关桦楠,迟德富,宇佳,等.青杨脊虎天牛 CYP4G2基因片段的克隆、序列分析与表达[J].昆虫学报,2008,51(4):357-364.
[15]李秀兰,腾达,孙艳,等.淡色库蚊细胞色素 P450 CYP42r6基因的克隆、表达及鉴定[J].中国人兽共患病杂志,2005,21(7):552-557.
[16]董元凌,艾均文,柳照应,等.家蚕细胞色素 P450 CYP337A1的原核表达[J].中国蚕业,2008,2:20-22.
[17]陆海,吴薇,曾庆银,等.大肠杆菌BL21(DE3)中表达重组蛋白的研究[J].北京林业大学学报,2001,23(6):1-4.
[18]潘滨,吴建祥,李桂新,等.烟草曲茎病毒复制相关蛋白基因原核表达条件优化[J].浙江大学学报(农业与生命科学版),2007,33(1):24-28.
[19]岳盈盈,李鹏,李志会,等.风疹病毒包膜糖蛋白 E1的原核表达及条件优化[J].山东医药,2010,50(3):18-19.

