春季黄海微型浮游动物对不同粒径浮游植物的摄食速率研究
(热带海洋环境动力学重点实验室,中国科学院 南海海洋研究所,广东 广州510301)
微型浮游动物(Microzooplankton)是指体长小于200 μm 的浮游动物,包括原生动物、异养型鞭毛虫和后生浮游动物的幼虫等。浮游动物和浮游植物的摄食关系是海洋浮游生态系统中一个重要研究目标。微型浮动物不仅是 pico和 nano级浮游植物的主要摄食者,也在微微型浮游生物和中型浮游动物之间物质、能量传输过程中起着重要的连接作用。1982年,Landry[1]建立了利用稀释技术估算浮游动物的摄食速率的方法,此后国内外进行了许多微型浮游动物摄食作用对浮游植物生物量和初级生产力影响的研究[2-7]。现有的资料显示,海洋中大约10%~75%的初级生产力被浮游动物的摄食作用消耗掉[8],有些甚至超过100%[9]。
中国的海洋微型浮游动物摄食研究起步较晚,主要研究海区集中在黄渤海、东海及香港近岸海域[10-16]。
作为西太平洋重要的边缘海,黄海在全球碳循环和生态系统中起着重要的作用。黄海不仅受到黑潮、东亚季风以及 ENSO(El Nino Southern Oscillation)现象等多种自然气候条件的影响,而且黄海的陆源输入受到长江和黄河的控制,人类活动对长江和黄河的影响也必将给黄海的生态结构造成影响。因此,黄海是研究我国海洋生态系统结构和功能的重要场所。作者利用现场培养的方法对中国黄海海域进行了微型浮游动物摄食速率的研究,探讨了微型浮游动物摄食对不同粒级浮游植物的摄食速率及对海洋浮游植物生物量和初级生产力的影响,以期进一步了解黄海海域的生态系统结构及微食物环的生态过程及作用。
1 材料与方法
1.1 研究站位
分别于2005年3月20日至27日,利用“东方红 2号”科学考察船在黄海多个站位进行了物理水文、化学和生物的综合野外调查,于其中A1、A2 、G1、G10、G16、G22和G23站位进行了微型浮游动物摄食速率的研究(图1)。
1.2 叶绿素样品的测定
在船上用 Niskin采水器获得水样。叶绿素的样品分别使用20、2μm和GF/F的滤膜过滤250 mL,水样经200μm筛绢预过滤。载有浮游植物样品的滤膜用锡纸包好后置于-20℃冰箱中保存。带回实验室后,将滤膜放在15mL的带盖离心管里,加入10 mL 90%的丙酮,用锡纸把离心管包好,在冰水中超声破碎15min后放在4℃中黑暗萃取16 h。5 000 r/min转速离心5 min后,用Turner Designs 700型荧光光度计测定叶绿素的浓度[17]。
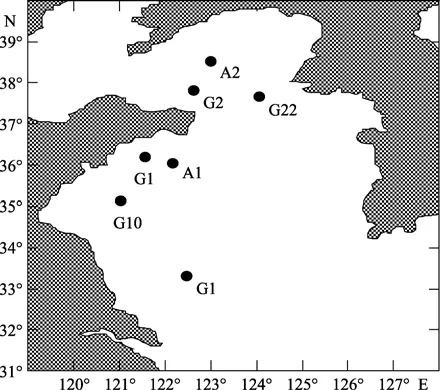
图1 黄海调查站位Fig.1 Locations of sampling stations in the Yellow Sea
1.3 微型浮游动物摄食速率的测定
1.3.1 稀释法的原理及计算方法
稀释法最早由 Landry 等 1982年提出,现已成为研究微型浮游动物摄食的标准方法。此方法基于3个基本假设:(1)浮游植物生长速率与其在培养水体中密度无关;(2)摄食速率只与水体中浮游动物的密度有关;(3)浮游植物的生长依指数生长方程Pt=P0×e(μ-g)t。
假设海水中浮游植物处于指数增长期,培养前浮游植物现存量为P0,培养后浮游植物现存量为Pt,那么:
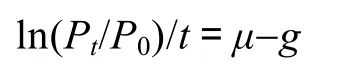
式中,μ为浮游植物生长系数,g为浮游植物被摄食的死亡系数,t为培养时间。
将稀释海水(稀释海水由0.7 μm的GF/F膜过滤得到)与现场海水按一定比例混合,稀释度为稀释海水体积与混合后总体积的比值。设稀释梯度为0,0.2,0.4,0.6,0.8,1.0。对每个培养梯度样品进行浮游植物表观生长率(RAG,apparent growth rate)计算,公式如下:RAG(d-1)=ln(Pt/P0)/t;计算每个培养处理的实际稀释因子(FAD,actual dilution factor)如下:
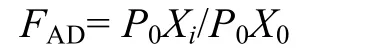
式中,P0Xi是初始培养处理中Xi组分的浮游植物现存量,P0X0是初试培养处理中未稀释组分的浮游植物现存量。FAD也可表示为比天然海水占总的混合海水的比例。
微型浮游动物的摄食速率g(grazing rate) 和浮游植物的内禀生长率μ(instantaneous growth rate)可以用RAG和FAD的线形回归方程求得,其中的截距为浮游植物的内禀生长率(μ,d-1),斜率为微型浮游动物的摄食率(g,d-1)。
浮游植物的净生长率(net growth rate of phytoplankton,RNG)的计算公式:

微型浮游动物对浮游植物现存量的摄食压力Pi的计算公式为 :
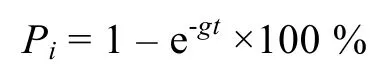
微型浮游动物对初级生产力的摄食压力Pp的计算公式为:

1.3.2 稀释培养及样品采集
将 200 μm 筛绢过滤后的表层海水,用孔径为0.7 μm的 GF/ F滤膜(Whatman)过滤,滤液作为稀释海水。将 200 μm 筛绢过滤过的海水与稀释海水按0,0.2,0.4,0.6,0.8,1.0的比例混合,每个比例设3个平行样。每个稀释比例取250 mL水样,分别使用20、2 μm和GF/ F滤膜过滤,滤膜用锡纸包好后,放入-20℃冰箱保存,带回实验室测定,作为初始培养的叶绿素 a 浓度。将各稀释比例水样样分装于 3L的玻璃培养瓶中,将培养瓶放在甲板上的培养箱中现场海水水浴控温培养。24 h后,每瓶采水 250 mL ,分别使用20、2 μm和GF/ F滤膜过滤,保存测定方法同上。
2 结果
2.1 研究站位的水环境
各站位水温变化范围为 2.81~8.55℃,总体呈现南高北低的趋势。盐度变化范围为 31.8~32.6,盐度高值出现在位于最南端的G22站位(表1)。黄海地处温带,属于富营养海区,其营养主要来自入海径流的输送。东岸主要有鸭绿江、大同江和汉江,西岸主要是沂河、灌河、沭河及苏北灌溉总渠等。Liu等[18]研究结果表明黄海 NO3-和 SiO32-主要来自中国的河流(长江和鸭绿江),NH4+和 PO43-主要来自韩国的河流(汉江)。长江口虽然位于东海之内,但长江径流对南黄海的营养盐状况影响也很大。黄海南部的营养盐主要来源于长江冲淡水横向输送[19]。黄海表层水体的叶绿素含量在0.83~3.08 μg/L之间,高值区出现在最南部近长江口的G1站位;次高值出现在北黄海中部的 G23站位;低值区出现在北黄海中部的 G22站位。以前的研究也表明,黄海的高生产力区位于长江口外海及黄海北部[20]。叶绿素分级结果显示调查期间各站位均为micro-级浮游植物占优势。
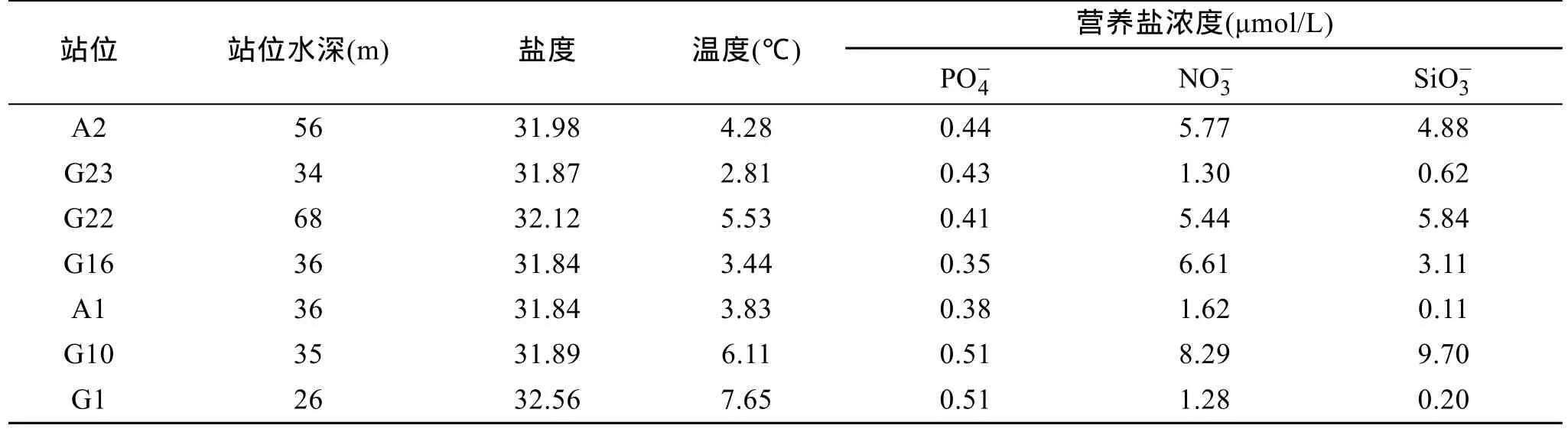
表1 研究站位的环境参数Tab.1 Environmental parameters at the studying stations
2.2 浮游植物生长速率与微型浮游动物的摄食速率
在船上的稀释培养实验中,从回归分析结果(图2)中可以看出,A2和G1站位拟合度(r2)很低,不能通过回归方程准确地计算出微型浮游动物的摄食速率和浮游植物的内禀生长率。原因可能是微型浮游动物的数量很少,较高的浮游植物生物量受到微型浮游动物摄食的影响较小,微型浮游动物的摄食速率接近 0,表观生长率没有随稀释过程产生相应的增加。也可能是培养操作过程中的失误对微型浮游动物了损伤导致的。稀释试验结果见表1。实验期间,微型浮游动物生长速率范围在0.34~0.95 d-1,浮游植物摄食速率范围在0.44~0.94 d-1。微型浮游动物对浮游植物的现存量和初级生产力的摄食压力分别为47.76%~63.80%和 61.50%~154.47%。微型浮游动物摄食速率和浮游植物生长速率的低值分别出现在A1和G23站位,高值均出现在青岛附近海域的G16站位(表2)。G23和G10站位微型浮游动物的摄食速率高于浮游植物生长速率,微型浮游动物对浮游植物的摄食压力较大,154.47%和 132.99%的初级生产力被摄食,浮游植物通过光合作用积累的有机物全部被微型浮游动物摄食,生物量处于下降期。这一区域的微型浮游动物自上而下的控制(top down)是限制浮游植物生物量主要因素。北黄海中部的站位 G22的测定结果表明,此区域的浮游植物生长速率较高,但微型浮游动物的摄食活动并不强烈。微型浮游动物对初级生产力的摄食压力在所有站位中最低,只有61.50%。虽然G22站位的叶绿素含量在所有站位中最低,只有0.83 μg/L,但由于较低的摄食压力,水体中的浮游植物在一定时期内处于上升期,浮游植物生物量会进一步增加。其他两个站位的浮游植物生长速率与微型浮游动物的摄食速率接近,处于平衡状态,短期内生物量变化不大。
2.3 微型浮游动物对不同粒级浮游植物的摄食
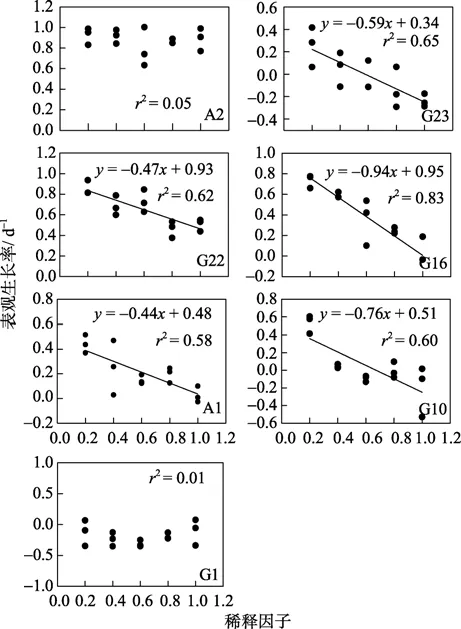
图2 稀释培养实验回归分析Fig.2 Regressions analyses of the dilution experiments
浮游植物分级叶绿素分析结果显示,2005年3月份黄海调查站位中除G22外其他所有站位表层分级叶绿素含量情况为:micro级浮游植物> nano级浮游植物>pico级浮游植物。G22站位为:micro级浮游植物>pico级浮游植物>nano级浮游植物。整个黄海海区都以大于20 μm的浮游植物占优势(图3)。黄海海域3月份调查期间,对micro级浮游植物的摄食速率最低,站位平均为0.69 d-1;其次为nano级浮游植物站位平均为0.76 d-1;最高为pico级浮游植物,站位平均为1.10 d-1;对于micro级浮游植物的摄食速率,只有山东近海的两个站位的结果,分别为 G16站位0.94 d-1,A1站位0.44 d-1。对于nano级浮游植物的摄食速率,最高值出现在 G10站位,最低值出现在G16站位。对于 pico级浮游植物的摄食速率,最高值出现在G23站位,最低值出现在G22站位(表3)。调查期间分级浮游植物的生长速率情况为:pico级>nano级>micro级,所有调查站位平均值分别为0.96、0.87 d-1和0.75 d-1,浮游动物的摄食速率随浮游植物的粒径减小而升高,这和微型浮游动物对分级浮游植物的摄食速率情况一致。Micro级浮游植物的生长速率,G16站位为1.08 d-1,A1站位为0.41d-1。nano级浮游植物的生长速率,最高值出现在 G22站位,最低值出现在 G16站位,pico级浮游植物的生长速率,最高值出现在G16站位,最低值出现在G10站位。调查结果表明,对于micro级的浮游生物,其生长速率和被摄食的速率非常接近(μ/g=1.00);对于nano级的浮游生物,其生长速率高于被摄食的速率(μ/g=1.12);对于 pico级的浮游生物,其生长速率低于被摄食的速率(μ/g=0.89)。对于整个海区来说,总浮游植物的生长速率和微型浮游动物的摄食速率非常接近(μ/g=1.07)。各粒径级别浮游植物的生长速率和微型浮游动物的摄食速率的关系见(图4)。从图中可以看出,G22站位微型浮游动物对nano级浮游植物和总浮游植物的摄食速率均明显低于浮游植物的生长速率(μ/g为2.02和2.00)。G10站位微型浮游动物对总浮游植物的摄食速率明显高于浮游植物的生长速率(μ/g=0.67)。其他站位各粒径浮游植物生长和微型浮游动物的摄食速率接近。说明黄海 3月份浮游植物的生物量主要受到微型浮游动物的调控,浮游植物的生长和微型浮游动物的摄食作用达到平衡,浮游植物生物量短期内维持现有水平。
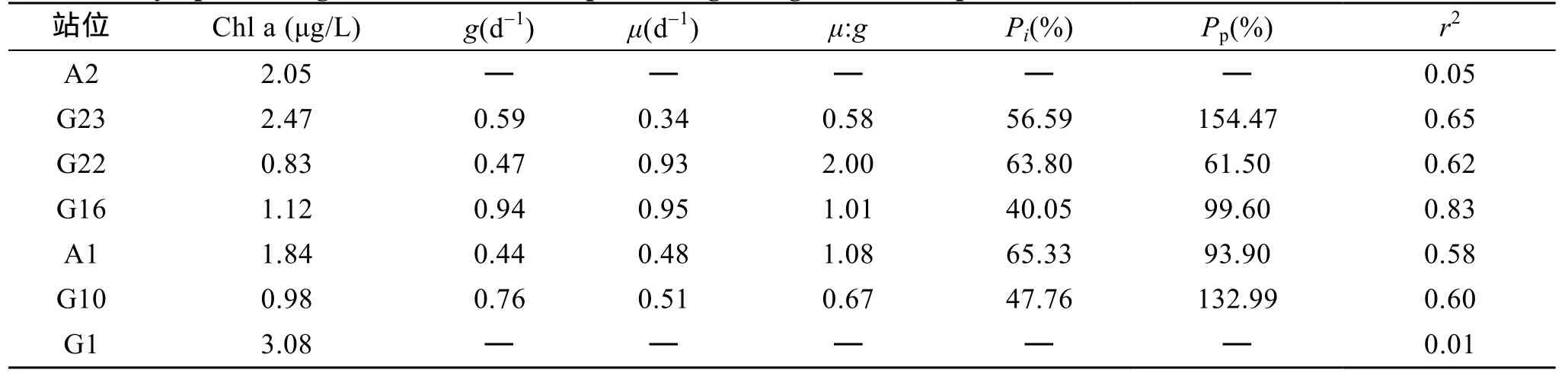
表2 黄海调查站位的浮游植物生长速率和浮游动物摄食速率Tab.2 Phytoplankton growth and microzooplankton grazing rates for experiments conducted in the Yellow Sea
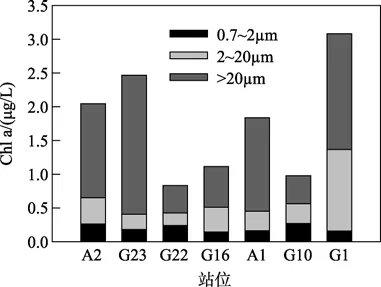
图3 调查站位分级浮游植物叶绿素Fig.3 Chl a concentration of size fractions of phytoplankton
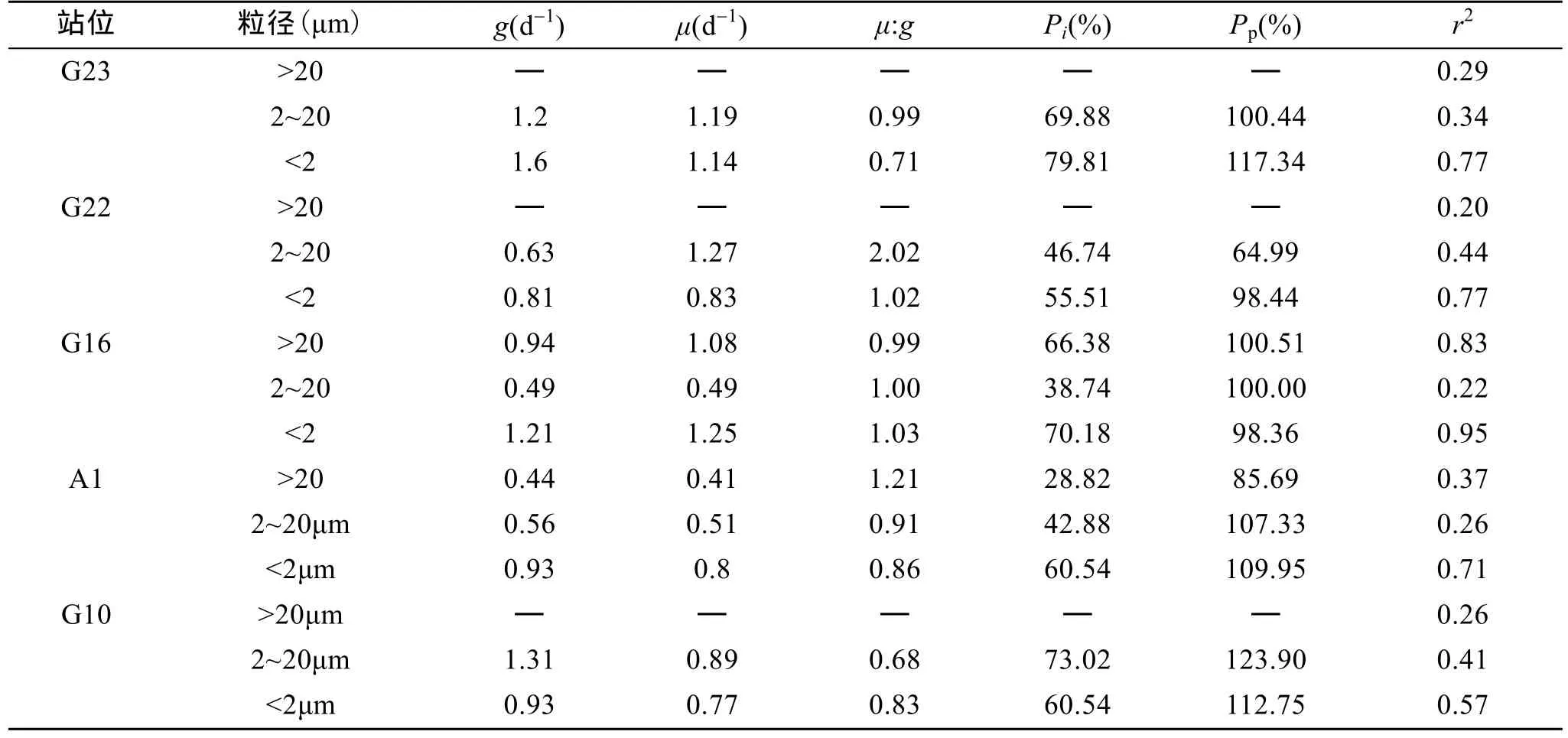
表3 黄海调查站位的分级浮游植物生长速率和浮游动物摄食速率Tab.3 Phytoplankton growth and microzooplankton grazing rates for size-fraction experiments conducted in the Yellow Sea
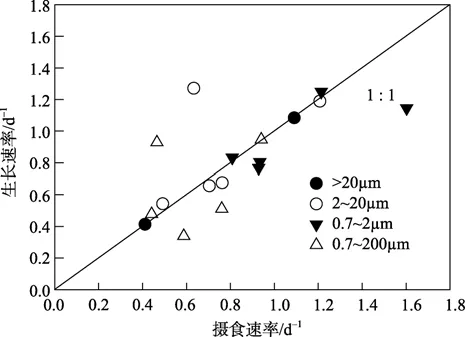
图4 浮游植物的生长速率和微型浮游动物的摄食速率的关系Fig.4 Relationship between microzooplankton grazing rates and phytoplankton growth rates of the dilution experiments conducted in the Yellow Sea
3 讨论
实验期间,浮游植物生长速率为 0.34~0.95 d-1,微型浮游动物摄食速率范围在0.44~0.94 d-1。可见黄海是高生产率,高周转率的海区,微型浮游动物的摄食保持了浮游植物的数量的稳定,成为控制水华发生的关键因素。国内应用稀释法对中国附近海域微型浮游动物摄食速率进行过一些研究。其中,渤海微型浮游动物摄食率范围在 0.43~0.69 d-1[10],香港水域为0.71~1.56 d-1[12],厦门养殖区的范围在0.20~1.32 d-1[21]。本实验结果表明,黄海调查区域的微型浮游动物摄食率处于中等水平。黄海的浮游植物春华期(spring bloom)多发生在 4月份,这已被许多调查研究所证实[22]。最近的结果表明,1996年4月在南黄海中央海域真光层(0~30m)中叶绿素a浓度最高达12.38 μg/L[23]。本次调查中在南黄海G1站位水体中叶绿素a浓度最高,达到3.08 μg/L,从数值上可以看出在本航次调查期间黄海并未发生明显的春华现象。从分级叶绿素的结果来看,黄海浮游植物是较大粒径占优势的,这与赤道太平洋等贫营养海域的浮游植物群落结构中以较小的 pico-级为主的群落结构明显不同[24]。但调查结果显示较小粒径的 Pico级细胞的生长速率高于 Micro级。粒径较小的浮游植物细胞分裂速度较快,具有较高的比表面积,从而相对于较大的细胞能能有效的吸收环境中的营养盐。无论是从单个种类还是整个浮游植物群落看来,Pico-级的浮游植物生长率都非常高,同时被快速生长的微型浮游动物摄食[25-27]。这与本实验中 pico级浮游植物的高生长速率和被摄食速率结果一致。较大粒径的细胞受到 meso-级的浮游动物的摄食影响较大,然而meso级的浮游动物的增长速度不足以控制较大粒径(如硅藻)细胞数量的增加,从而引起水华的产生。调查时期内黄海浮游植物以较大粒径的micro级为主,在营养盐丰富的条件下,浮游动物的摄食对 micro级浮游植物的调控能力不足将可能是黄海春季水华产生的重要原因之一。
浮游植物与浮游动物的摄食关系研究是海洋生态系统中的一个关键过程研究。与传统食物链(浮游植物-浮游动物-鱼类)相比,微食物网中的微型浮游动物在海洋生态系统物流和能流中也起着重要的作用,是连接微型食物网和较高营养级的中枢。但在不同的海区,微型食物网的作用大小也不同。浮游动物的摄食受各营养阶层组成粒级结构的影响。在大细胞浮游植物站优势的海区,浮游植物被中型浮游动物摄食的经典食物链较重要,而在以小细胞植物为主的生态系统中,则以微型浮游动物对浮游植物和细菌摄食的微食物环为主。从本研究的结果看,3月黄海初级生产力的 61.50%~154.47%,浮游植物现存量的 47.76%~63.80%被微型浮游动物所摄食。微型食物网在黄海生态系统中也发挥了巨大的作用。虽然微型浮游动物对 micro级浮游植物的摄食速率最低,但仍在控制其生物量方面产生了重要的贡献。因此,对于黄海micro级浮游植物的控制应该考虑微型浮游动物和meso级浮游动物的共同作用。
[1]Landry M R,Hassett R P.Estimating the grazing impact of marine microzooplankton [J].Marine Biology,1982,67:283-288.
[2]Mazumder A,McQuen D J,Taylor W D,et al.Microand mesozooplankton grazing on natural picoplankton and nanoplankton in contrastiong plankton communities produced by planktivore manipulation and fertilization [J].Archivesder Hydrobiologie,1990,118:257-282.
[3]Liu H B,Suzuki K,Nishioka J,et al.Phytoplankton growth and microzooplankton grazing in the Sea of Okhotsk during late summer of 2006[J].Deep-Sea Research Part I-Oceanographic Research Papers,2009,56(4):561-570.
[4]Huang B Q,Liu Y,Xiang WG, et al.Grazing impact of microzooplankton on phytoplankton in the Xiamen Bay using pigment-specific dilution technique[J].Acta Oceanologica Sinica,2008,27(5):147-162.
[5]Merrell J R,Stoecker D K.Differential grazing on protozoan microplankton by developmental stages of the calanoid copepod Eurytemora affinis Poppe[J].Journal of Plankton Research,1998,20(2):289-304.
[6]Pearce I.Seasonal changes in phytoplankton growth and microzooplankton grazing at an Antarctic coastal site[J].Aquatic Microbial Ecology,2008,50(2):157-167.
[7]Kim S,Park M G,Moon C,et al.Seasonal variations in phytoplankton growth and microzooplankton grazing in a temperate coastal embayment,Korea[J].Estuarine Coastal and Shelf Science,2007,71(1-2):159-169.
[8]Pierce R W,Turner J T.Ecology of planktonic ciliates in marine food webs [J].Review Aquatic Sciences,1992,6:139-181.
[9]Zhang Liyong,Sun Jun,Liu Dongyan,et al.Studies on growth rate and grazing mortality rate by microzooplanktonof size-fractionated phytoplankton in spring and summer in the Jiaozhou Bay,China [J].Acta Oceanologia Sinica,2005,24(2):85-101.
[10]Zhang W C,Wang R.Microzoopankton and their grazingpressureon phytoplankton in Bohai Sea[J].Oceanologia et Limnologia Sinica,2000,31(3):252-258.
[11]Li C L,Sun S,Ji P,et al.Herbivorous activity and nitrogen excretion of microzooplankton in the marginal ice zone of the PrydzBay Antarctic[J].Oceanologia et Limnologia Sinica,2000,31(6):657-663.
[12]孙军,宋秀贤,殷克东.香港水域夏季微型浮游动物摄食研究[J].生态学报,2003,23(4):712-724.
[13]孙军,刘东艳,王宗灵.春季赤潮频发期东海微型浮游动物摄食研究 [J].应用生态学报,2003,14(7):1073-1080
[14]孙军,刘东艳.夏季胶州湾微型浮游动物摄食初步研究[J].应用生态学报,2004,15(7):1245-1252.
[15]王学锋,李纯厚,贾晓平等.大亚湾冬春季微型浮游动物摄食研究[J].海洋环境科学,2006,25(S1):44-47.
[16]Chen B Z.Estuarine nutrient loading affects phytoplankton growth and microzooplankton grazing at two contrasting sites in Hong Kong coastal waters[J].Marine Ecology-Progress Series,2009,379:77-90.
[17]Parsons T R,Maita Y,Lalli C M.A Manual of Chemical and Biological Methodsfor Seawater Analysis[M].Oxford,Pergamon Press,1984.173.
[18]Liu S M,Zhang J,Chen S Zet al.Inventory of nutrient compounds in the YellowSea [J].Continental Shelf Research,2003,23:1161-1174
[19]王保栋,王桂云等.南黄海营养盐的平面分布及其横向输运规律[J].海洋学报,1999,2l(6):124-129.
[20]朱明远,毛兴华,吕瑞华.黄海海区的叶绿素 a和初级生产力[J].黄渤海海洋,1993,11(3):38-51.
[21]沈锦兰,林元尧,杨圣云.厦门杏林虾池夏冬季微型浮游动物对浮游植物的摄食压力[J].台湾海峡,2003,21(1):31-36.
[22]王保栋,王桂云.南海黄海春季海水化学要素的分布特征[J].海洋环境科学,1998,17(3):45-50.
[23]宋金明.中国近海生物地球化学[M].山东:山东科学技术出版社,2004:246.
[24]Chavez F P.Size distribution of phytoplankton in the central and eastern tropical Pacific[J].Global Biogeochem Cycles,1989,3:27-35.
[25]Barber R,Chavez T.Regulation of primary productivity rate in the equatorial Pacific Ocean[J].Limnology and Oceanography,1991,36:1803-1815.
[26]Cullen J,Cullen J.Hypothesis to explain high-nutrient conditions in the open sea[J].Limnology and Oceanography.1991,36:1578-1599.
[27]Latasa M,Landry M R,Schlüter L,et al.Pigment-specific growth and grazing rates in the equatorial Pacific asmeasured by the dilution technique[J].Limnology and Oceanography,1997,42:289-298.

