棘颊雀鲷人工繁殖与育苗的初步研究
鲍 鹰,张 鹏,祝承勇,刘 鸣,徐 莹,王沿淞
(1.中国科学院 海洋研究所,山东 青岛 266071;2.青岛绚海水族科技有限公司,山东 青岛 266071)
棘颊雀鲷(Premnas biaculeatus)俗称透红小丑鱼,分布于印度洋和太平洋珊瑚礁海域,属雀鲷科(Pomacentridae)、棘颊雀鲷属(Premna),是该属唯一的种,在观赏鱼市场上它与雀鲷科双锯鱼属的其他鱼统称小丑鱼。珊瑚礁中的成鱼体长10~15cm,但在人工蓄养的条件下,体长至6cm左右就能达到性成熟。椭圆形,全身紫黑色,各鳍紫红色,体侧在眼睛后、背鳍中间、尾柄处有三条银白色环带。透红小丑因其婀娜的游姿和美艳的色彩成为水族爱好者普遍饲养的水中宠物,也成为海水观赏鱼人工繁殖的热点之一。
目前已发现的小丑鱼约有28种。虽然在水族箱中饲养小丑鱼的历史已经有几十年,而且早在 1978年Ross[1]就报道了黑红小丑(Amphiprion melanopus)的繁殖习性,但是对小丑鱼进行人工繁殖的报道主要集中在近十年中。2001年Ignatius等[2]报道了一种双带小丑A.sebae的产卵和仔鱼培育技术,2002年Madhu 等[3]报道了黑边公子小丑(A.percula)的人工繁殖。2005年Ho[4]报道了银边小丑(A.perideraion)的繁殖习性和人工培养;滕力平等[5]报道了双带小丑的人工繁殖;Aratake[6-7]先后报道了双带小丑鱼(A.clarkii)卵径和数量的季节性变化以及卵径与能量之间的关系。2007年Yasir[8]报道了公子小丑(A.ocellaris)胚胎和仔鱼的发育。2009年鲍鹰等[9]报道了红小丑(A.frenatus)胚胎发育和人工育苗的研究。但是,关于透红小丑的人工繁殖技术尚未见报道。
在人工培育的条件下,影响海水鱼类生长繁殖的主要因子是光照、饵料、水温、盐度、pH、氨氮、亚硝酸盐和硝酸盐。在具备水处理能力的培育系统中,盐度和pH是相对稳定的,氨氮、亚硝酸盐和硝酸盐是得到控制的,而光照、饵料和水温在相对宽泛的范围内皆能满足成鱼的生存,但对繁殖和仔鱼的生长却有特别的范围。本研究注重于了解透红小丑鱼在繁殖和仔鱼培养中的光照、水温和饵料条件,为进一步的生产性人工繁殖提供理论依据。本实验于2008年7月~2010年2月在青岛绚海水族科技有限公司海水观赏鱼繁殖基地进行。
1 材料与方法
1.1 亲鱼
亲鱼于2008年7月购于广州市的鱼店,共49尾,体长为49~98 mm,空运回青岛。从打包到解包,整个运输途中的时间约10 h。运输中无死亡。其中28条在 20天后配成 14对,分别养在 14个 40cm×40cm×38cm的玻璃水箱中。饲养水箱具有封闭式循环过滤系统,每星期换水 20%。饲养期间水温(26±1)℃,pH8.0~8.1,盐度 30~32,氨氮质量浓度低于 0.1 mg/L,溶解氧高于 5.8 mg/L。在水箱上方30cm处用 2只 36 W 普通日光灯照明,每天光照14 h,黑暗10 h。每天按照表1中组3的配方投喂饲料,分别于 9:00时和 15:00时各投喂 1次。至 2009年5月4日,共有9对亲鱼开始产卵。
1.2 温度和光照对繁殖的影响
将产卵的9对亲鱼分成3组,每组3对,调整温度和光照强度,使第1组的水温为(26±1)℃、水面光照强度为2 000 lx;第2组的水温为(26±1)℃、水面光照强度为500 lx;第3组的水温为(24±1)℃、水面光照强度为2 000lx,3个组的光暗周期都是14L:10D。一个月后,即6月6日开始记录这3组亲鱼所产卵的受精率、孵化率、受精卵的孵化时间、初孵仔鱼的成活率以及两次产卵的间隔时间。组 1和组2各连续记录5个产卵批次,组3因为产卵间隔时间延长,只连续记录3个产卵批次。
1.3 饵料对亲鱼产卵的影响
从8月28日开始,将9对亲鱼的光照强度全部调整为2 000 lx,也分成3组,每组3对。分别饲喂不同的饵料(表1)。从8月28日至11月4日为实验预备期,期间每对亲鱼又各产卵 3次,但不做记录,以消除前次实验的分组给亲鱼带来的影响。11月17日实验开始,跟踪记录每对亲鱼所产卵的孵化率、初孵仔鱼体长和仔鱼的成活率,也是连续记录 5个产卵批次。
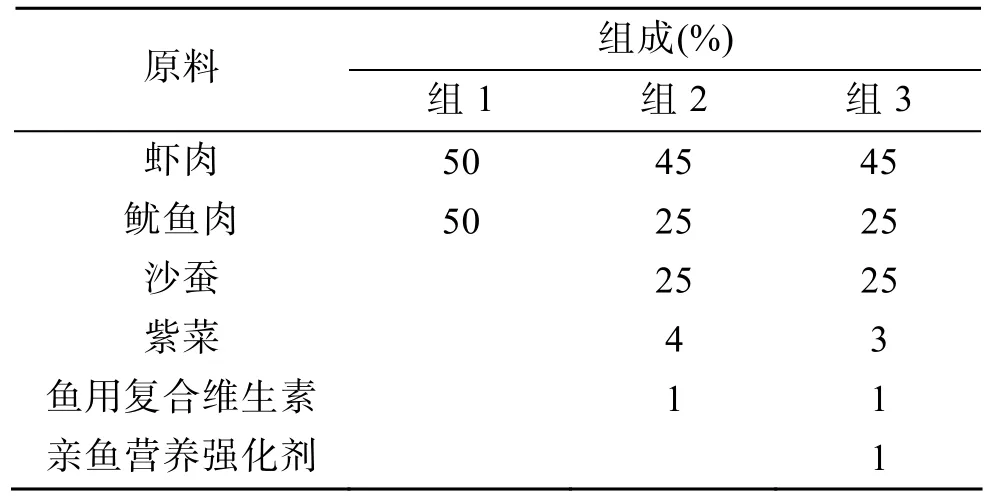
表1 透红小丑亲鱼的饵料组成Tab.1 Composition of experimental diets for the bloodstoch of Premnas biaculeatus
1.4 受精卵的计量和孵化
种鱼产卵后在原池中受精孵化,由亲鱼看护。水质条件与上述相同。刚产出的卵是淡橘红色,受精卵在第2天成淡紫红色,而没有受精的卵已被亲鱼清除。所以,在亲鱼产卵的当日和次日用 OLYMPUS 1030 SW 型水下数码相机拍下成片附着于缸壁上卵的照片,然后在电脑上对照片上的卵计数,以产卵当日的卵量为产卵量,产卵次日的受精卵量除以产卵量则为受精率。
1.5 仔鱼的收集与培育
在仔鱼孵出后的1 h左右,用虹吸管将仔鱼吸出,移到53cm×42cm×38cm的塑料箱中培养,此时塑料箱中的水质条件要与产卵缸中的完全一致。同时计出仔鱼的数量,并取5尾测量体长。仔鱼数量除以受精卵量为孵化率。由于卵质对仔鱼存活的影响主要在孵化后的2 d内显现出来,所以在孵化后第3天再计存活仔鱼的数量,用以分析卵的质量。
培养仔鱼的塑料箱放在120cm×120cm×80cm的水泥池中以水浴的形式保温。每天吸底并换水25%。日投喂 2次,分别在上午 9:00和下午 3:00。为了研究水温及饵料生物的营养强化对仔鱼的存活及生长的影响,取同批初孵仔鱼800尾以上的其中500尾仔鱼,在5个上述塑料箱中饲养,每个塑料箱中放100尾初孵仔鱼(孵化后12 h)。重复3次,其中培养条件相同的为一组。各组温度设置和饵料的营养强化见表2。各组的轮虫密度均保持在10个/mL左右;卤虫幼体的密度均控制在5个/mL左右。所有培养箱的pH为 8.0~8.2,盐度为30~32,氨氮质量浓度低于0.1 mg/L,溶解氧高于5.8 mg/L。最长培养时间为20 d。每天记录每个培养箱中存活仔鱼的数量。

表2 仔鱼培养中温度和饵料强化实验分组Tab.2 Experimental groups with different larve rearing temperature and diets
1.6 饵料生物的培养
饵料生物包括褶皱臂尾轮虫(Brachionus plicatilis)和卤虫(Artemia sp.)无节幼体。轮虫的平均体长是(239±36)μm,培育在 2个 100 L的玻璃钢圆桶中,每天投喂2次,一次投喂小球藻(Chlorellasp.,5×104个/mL),另一次投喂面包酵母(5×106个/mL)。轮虫在培养期间每天换水 30%。卤虫休眠卵购自潍坊安景水产技术公司,采自美国大盐湖。卤虫卵的孵化环境是温度28℃、盐度32,孵化18 h后收集。对于需要进行营养强化的轮虫和卤虫幼体,收集后再在同样的水质条件下饲养6 h,加入5%的鱼苗营养强化剂,强化剂的有效成分是高度不饱和脂肪酸(PUFA)。
2 结果与讨论
2.1 温度和光照对繁殖的影响
透红小丑鱼与其他雀鲷科鱼一样具有护卵的习性,不能将亲鱼和受精卵分开,亲鱼的培养条件也就是受精卵发育的条件。在水质条件优良的前提下,鱼类的繁殖节律主要受水温和光照周期的影响。从图1可以看出,在(26±1)℃和14L:10D的光暗周期下,组1(2 000 lx)和组2(500 lx)两种光照强度对亲鱼产卵周期(组 1:(13.0±0.8)d,n=15;组 2:(13.7±1.0)d,n=15)和受精率(组 1:(82.7±8.5)%,n=15;组 2:(85.8±6.1)%,n=15)并没有明显的影响,但是对受精卵的发育有明显的影响,具体表现在低光照条件下(组2)受精卵的孵化时间延长((13.4±0.6)d,n=15)、孵化率低((48.9±7.5)%,n=15)和初孵仔鱼的存活率极低((9.6±4.5)%,n=15),而2 000 lx的组1的孵化时间是(9.3±0.5)d(n=15)、孵化率是(79.7±7.6)%(n=15)、初孵仔鱼存活率达(71.6±12.5)%(n=15)。通过对各批受精卵不同发育时期取样的显微观察,前 7天的发育速度基本上是一致的,光照量对受精卵发育的影响主要发生在胚胎发育的后期。小丑鱼仔鱼的孵出总是发生在“日落”后的1 h之内,所以,明显的昼夜交替对仔鱼的孵出是至关重要的。在500 lx的低光下,昼夜交替不明显,可能是造成孵化时间延长的重要原因。仔鱼不能及时孵出,在膜内将卵黄物质消耗殆尽,在混合营养期没有及时得到外源性营养,则是造成初孵仔鱼大量死亡的直接原因。本实验的结果说明,能满足亲鱼产卵的光照条件不一定能满足受精卵的正常发育和孵化。其原因可能是后期胚胎的眼组织发育尚不完善,对光照的敏感度远远不如亲鱼。
关于产卵间隔时间,本实验中有一个现象值得关注:先后有 3对亲鱼在受精卵还没有孵出就又产卵。这3次“非正常”产卵都发生在低光照量、受精卵延迟孵出时,说明在正常的环境中,小丑鱼的产量间隔时间比受精卵的发育时间略长,在前一批受精卵孵化后数天再次产卵,这样的繁殖节律是最高效的。但是,亲鱼体内卵细胞的发育和排放,并不受前批卵是否孵出的影响,只是与亲鱼本身的生活环境有关。只要水温、光周期、饵料等条件适合,亲鱼就会按照固有的产卵节律产卵。上述三次产卵是正常的,只是产卵时前批卵尚未孵化,才出现两批卵重叠的非正常现象。
温度的变化则对亲鱼产卵和胚胎发育都有明显的影响。从图1可以看出,当温度下降到24℃左右时,亲鱼的产卵间隔时间明显延长((21.4±4.8)d,n=9),而且各对亲鱼的产卵间隔时间相差很大,表现出亲鱼处在适合产卵条件的边缘状态;孵化率是(42.1±5.3)%(n=9)、孵化时间延长到(13.8±0.4)d(n=9)、孵化后第3 天成活率下降到(16.0±7.3)%(n=9)。大部分珊瑚礁所处的赤道海域通常只有很小的水温波动,如太平洋赤道海域水温的季节性变化只有 4~6℃[10],因此,较小的温度变化就会对透红小丑的繁殖产生较大的影响。
3个组的受精卵依次是(82.7±8.5)%(n=15)、(85.8±6.1)%(n=15)、(74.4±7.1)%(n=9),差别不大。说明只要水温和光照条件满足亲鱼产卵,即使是处于适合条件的边缘,对受精率的影响并不大。
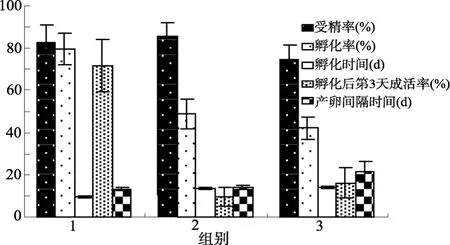
图1 水温和光照量对棘颊雀鲷繁殖的影响Fig.1 Effects of temperature and photoperiod on the reproductive performance of Premnas biaculeatus broodstock
2.2 饲料的营养成分对卵质的影响
亲鱼培养中的另一个重要因素是饵料。饵料是种鱼性腺发育的物质基础,饵料的成分决定了卵子的质量,从而影响到受精卵的孵化率、初孵仔鱼的体长和初孵仔鱼的成活率。近20年来,亲鱼的营养问题引起了各国学者的关注[11]。许多研究资料表明,亲鱼饲料的营养质量是影响生殖性能的主要因素之一,它影响产卵量、精卵质量和仔鱼的活力。亲鱼饲料中的脂类含量从 12%增加到 18%时,点斑蓝子鱼受精卵的孵化率明显提高,仔鱼的存活时间延长了14 d[12]。增加饲料的n-3 HUFA、特别是DHA含量,可显著提高鲈鱼仔鱼的重量及其抗渗透休克的能力[13]。牙鲆正常仔鱼率、孵化3 d后仔鱼存活率都与饲料中 n-3 HUFA 水平(0.4%~2.1%)呈正相关关系[14]。本实验的结果是相似的。从图2可以看出,第3组亲鱼所产卵的孵化率((85.6±6.5)%,n=15)和初孵仔鱼成活率((61.6±8.2)%,n=15))要比另外二组明显高;第3组初孵仔鱼的平均体长是(4.0±0.2)mm(n=15),而第1和第2组初孵仔鱼的平均体长是(3.4±0.1)mm(n=15)和(3.7±0.2)mm(n=15)。组3和组2、组 1饵料的主要区别是添加了亲鱼营养强化剂,其主要有效成分是高度不饱和脂肪酸(PUFA)。组 2的饲料中有沙蚕,其 HUFA的含量相对的要比虾肉和鱿鱼肉高,所以孵化率((40.8±5.4)mm,n=15)、初孵仔鱼存活率((17.5±4.4)%,n=15)和仔鱼体长都要略高于组 1(孵化率:((31.0±3.9)%,n=15);初孵仔鱼成活率:((12.5±4.6)%,n=15)。
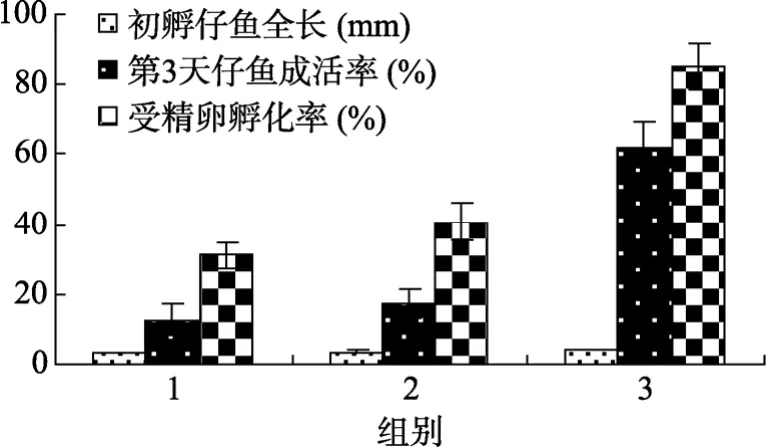
图2 亲鱼饵料的营养成分对受精卵孵化率和初孵仔鱼的影响Fig.2 The effect of broodstock diets on the hatch rates of fertilized eggs and the new-hatched larvae
2.3 仔、稚鱼的培养要点
初孵仔鱼具有极强的趋光性,能够快速游动寻找食物,而体内的卵黄基本上已被吸收。仔鱼孵化后9~11d进入稚鱼阶段,体长为(4.6~6.9)mm,平均为((5.8±1.1)mm,n=20);孵化后 16~18 d,鱼苗已转入幼鱼阶段,体长为(8.8~12.1)mm,平均为((10.6±1.8)mm,n=20),整个鱼体呈现深棕红色,眼睛后面出现第1条白色条纹,随着幼鱼的生长,前后背鳍之间和尾柄上的白色环纹将逐渐出现。
在人工培养条件下,最容易影响仔鱼存活和生长的因子是水温和饵料的营养。
从图3可以明显地看出,虽然组 1、组4、组 5都用了强化饵料,但是 24℃和 28℃皆不适合仔鱼的生长,到孵化后第4天已经死亡过半,到第10天几乎全部死亡,而在 26℃可以达到 63%的存活率。这也说明透红小丑的繁殖只能在非常狭窄的温度范围内进行。Olivotto 等[15]在对一种生活在珊瑚礁的小型神仙鱼Centropyge flavissimus的研究中也得到了相似的结果:仔鱼在 28℃能够存活,但是仅仅下降到 26℃就不能存活了。狭窄的适温范围应该和珊瑚礁鱼所适应的生活环境有关。
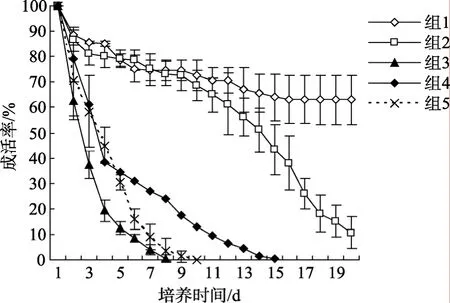
图3 营养强化对仔、稚鱼成活率的影响Fig.3 The effect of diets on the larvaes of Premnas biaculeatus
从图3还可以看出,透红小丑初孵仔鱼对不饱和脂肪酸的依赖非常高。组 3的轮虫没有用不饱和脂肪酸强化,仔鱼的死亡集中发生在孵出后的第3天到第7天,到第8天已经没有存活的仔鱼了。从组1和组2的比较可以看出卤虫幼体强化与否对仔稚鱼的影响还是比较明显的,组 2的仔鱼在摄食强化的轮虫后顺利发育到稚鱼,但是在摄食未经强化的卤虫幼体后就陆续死亡。因此人工繁殖时在稚鱼期对饵料进行强化是必需的。
一般来说,在鱼的人工繁殖中,开口饵料是十分重要的。开口饵料的适时适量供应成为仔鱼成活的关键因素。透红小丑的初孵仔鱼完全可以吞食 L型轮虫,这给人工育苗提供了很大的方便,因为轮虫的培养,特别是L型轮虫的培养非常容易。
[1]Ross R M.Reproductive behavior of the anemonefishAmphiprion melanopuson Guam [J].Copeia,1978,1:103-107.
[2]Ignatius B,Rathore G,Jagadis I,et al.Spawning and larval rearing technique for tropical clown fishAmphiprion sebaeunder captive condition [J].Journal of Aquaculture in the Tropics,2001,16(3):241-249.
[3]Madhu K,Madhu R.Successful breeding of common clownfishAmphiprion perculaunder captive conditions in Andaman and Nicobar Island [J].Fish Chimes,2002,22(9):16-17.
[4]Ho Y-S,Chen C-M,Chen W-Y.Breeding behavior of the pink clownfish (Amphiprion perideraion) and its larval rearing study [J].Jour Fish Soci Taiwan,2005,32(1):25-26.
[5]滕力平,杨担光,李晓光,等.二线小丑鱼的人工繁殖[J].水产科学,2005,24(2):26-27.
[6]Aratake H,Naknzono A.Relationship between egg size and its energy content in anemonefish,Amphiprion clarkiai[J].Sci Bull Fac Agric Kyushu Univ,2005,60(2):203-206.
[7]Aratake H,Nakazono A.Seasonal change of egg size and number in the anemonefishAmphiprion clarkiiat two different localities in the temperate Kyushu,Japan [J].Sci Bull Fac Agric Kyushu Univ,2006,61(1):83-91.
[8]Yasir I,Qin J.Embryology and early ontogeny of an anemonefishAmphiprion ocellaris[J].J Mar Biol Assoc U K,2007,87(4):1 025-1 033.
[9]鲍鹰,张鹏,祝承勇,等.红小丑人工繁殖和育苗的初步研究[J].海洋科学,2009,33(2):5-9.
[10]McGregor G R,Nieuwolt S.Tropical clinatology.An Introduction to the Climates of the Low Latitudes [M].NY:Wiley,1998:39.
[11]李远友,禹龙香.亲鱼脂类营养对鱼类生殖性能的影响[J].水产养殖,2006,27(1):1-5.
[12]Duray M,Kohno H,Pascual F.The effect of lipid enriched broodstock diets on spawning and on egg and larval quality of hatchery-bred rabbitfishSiganus guttatus[J].Philipp Sci,1994,31:42-57.
[13]Aby-ayad S M E A,Melard C,Kestemont P.Effects of fatty acide in Eurasian perch broodstock diet on egg fatty acid composition and larvae stress resistance [J].Aquacult Int,1997,5:161-168.
[14]Furuita H,Tanaka H,Yamamoto T,et al.Effects of n-3 HUFA levels in broodstock diet on the reproductive performance and egg and larval quality of the Japanese flounder,Paralichthys olivaceus[J].Aquaculture,2000,187:387-398.
[15]Olivotto I,Holt S A,Carnevali O,et al.Spawning,early development,and first feeding in the lemonpeel angelfishCentropyge flavissimus[J].Aquaculture,2006,253:270-278.

