盐度和体质量对半滑舌鳎标准代谢率的影响
王资生,郭锡杰,黄金田,齐志涛,彭 斌,王爱民
(1.江苏科技大学 生物与环境工程学院,江苏 镇江 212003;2.盐城工学院 江苏沿海池塘养殖生态重点实验室,江苏 盐城 224003)
在鱼类的能量收支中,代谢是很重要的一项能量支出,代谢耗能约占摄入食物能的 44%~69%[1]。鱼的总代谢包括标准代谢、特殊动力作用和活动代谢,其中标准代谢率的精确测定通常比较困难,一般认为鱼在饥饿状态下的代谢率近似其标准代谢率[2]。标准代谢率主要用来代表鱼类维持其基本生命活动的能量需求,国内外学者在这方面已作了较多研究工作,定量测定了多种鱼类的标准代谢率[3-7]。
半滑舌鳎(Cynoglossus semilaevis)为近海大中型名贵经济鱼类,栖息于泥沙质海底,中国沿海均产。该鱼具有活动范围小、洄游距离短、围捕率高、食谱广、生长迅速等特点。目前,半滑舌鳎的人工繁殖技术已取得突破性进展,这对开发新的渔业资源,发展渔业经济有着积极的意义。作者主要探讨半滑舌鳎的标准代谢率与盐度和体质量之间的关系,了解和揭示半滑舌鳎的基础代谢水平和特征,从而为半滑舌鳎苗种培育和人工养殖提供科学依据。
1 材料与方法
1.1 实验用鱼
实验用鱼采自盐城陈港周围自然海域,运回实验室后,放入鱼池内进行暂养,经鉴定为半滑舌鳎,鱼体健壮无伤痕,体质量 19.41~97.31 g,体长16.3~26.8cm。
1.2 实验用水
实验用水取自盐城陈港的天然海水,经过 12 h以上沉淀后,再用脱脂棉过滤。用经曝气24 h以上的自来水、粗海盐和自然海水调节,并用SYC2-2型海水盐度计测量盐度。
1.3 实验方法
实验是在参考有关文献[8,9]后制成的呼吸仪中进行。呼吸仪的体积为22 L,其周围用黑布遮盖,以排除光照对鱼生理活动的影响。实验时,水从贮水缸流出,经水位稳定器再多管分流从呼吸仪的下进水口进入呼吸仪,再从呼吸仪的上出水口流出。同时将各呼吸仪置于一只大水族箱内,以保证实验时各呼吸仪内的水温和进水口的溶氧量相同。整个实验过程中,呼吸仪内的水温控制为 22.0℃±0.5℃,进水口的溶氧量维持在 5.5 mg/L以上,出水口的流量为(167±3) mL/min。
实验前,根据设定的 6个实验盐度梯度(15~35),将体格健康的实验用鱼随机分为6组(每组20尾,体质量为24.25~92.13 g),在不同的盐度下训养4~8 d(盐度每天升降1~2),再禁食2 d且排尽粪便后放入呼吸仪,每个呼吸仪放1~2尾试验鱼,待其呼吸平衡(约3 h)后取样测定呼吸仪出水口的溶氧量,连续测定4次,每次间隔1 h。每次测定时均设1个空白对照组。水中的溶氧量采用经典的Winkler法进行测定,每次取3个平行样,取其平均值。试验结束后,立即用滤纸吸干鱼体表水分,并用电子天平称质量(精确至 0.01 g)。同时,为了排除耗氧率昼夜变化的影响,溶解氧的测定均于当天的 14:00~18:00 进行。
标准代谢率和相对标准代谢率(单位体质量标准代谢率)按下式计算:

其中:Rs表示标准代谢率(mg/(尾·h)),Rs′表示相对标准代谢率(mg/(kg·h)),D1表示空白呼吸仪出水口的溶氧量(mg/L),D2表示有鱼呼吸仪出水口的溶氧量,F表示流量(L/h),M表示鱼体质量(kg);N表示实验鱼尾数(尾)。
2 结果
2.1 半滑舌鳎的标准代谢率与体质量的关系
在各个实验盐度水平下,半滑舌鳎的Rs与体质量呈正相关,随着体质量的增加而升高;而Rs′与体质量呈负相关,随着体质量的增加而降低(图1)。分析表明,半滑舌鳎的标准代谢率与体质量之间的关系可用幂函数Rs=aMb表示,且所有拟合曲线的相关关系均达高度显著水平(P<0.01),不同盐度梯度下的a,b系数值见表1。协方差分析表明,不同盐度下半滑舌鳎标准代谢的组间均数差异高度显著(F(5,65)=9.23,P<0.01),体质量指数b(F(5,65)=3.65,P<0.05)和截距a(F(5,65)=4.38,P<0.01)之间的差异显著。

图1 半滑舌鳎在不同盐度下的相对标准代谢率和标准代谢率Fig.1 Specific standard metabolic rates and standard metabolic rates of Cynoglossus semilaevis at different salinities
2.2 盐度对半滑舌鳎标准代谢率的影响
将各盐度下的实验鱼按体质量规格划分为3组,采用每组的平均体质量()作为相对标准体质量,根据公式:计算各组标准体质量下的相对标准代谢率(Rs''),式中M和Rs'分别为实测体质量与相对标准代谢率。可以看出,在实验盐度范围内,各规格组在27.46盐度组下的相对标准代谢率最低,而在两侧,随着盐度的升高和降低,相对标准代谢率相应增加,各规格组的相对标准代谢率均在20.08盐度组达到最高,随着盐度进一步下降,半滑舌鳎的标准代谢率反而降低(图2)。
3 讨论
3.1 关于半滑舌鳎的标准代谢水平
影响鱼类标准代谢率的因素很多,因而不同鱼类的代谢水平相差也很大。研究认为鱼类的标准代谢存在着种间差异,而且同一种鱼在不同环境条件下的代谢水平变化也会很大,温度和体质量的影响尤为明显[6]。另外,不同的研究者采用的实验条件也往往不一致,因此,试图对文献中不同鱼类的标准代谢水平进行比较是十分困难的。Brett等[10]总结了34种鱼在 0.5~37℃时相对标准代谢率的变幅为 26~229 mg/(kg·h)。平均值为 89 mg/(kg·h)。线薇薇等[11]测得各温度下梭鱼的相对标准代谢率在 409.29~1 386.41mg/(kg·h),比文献所报道过的其他鱼类标准代谢数值要高得多,这可能与梭鱼本身代谢水平较高有关。当然,在实验过程中如果实验鱼未完全静止,所测结果也往往偏高。
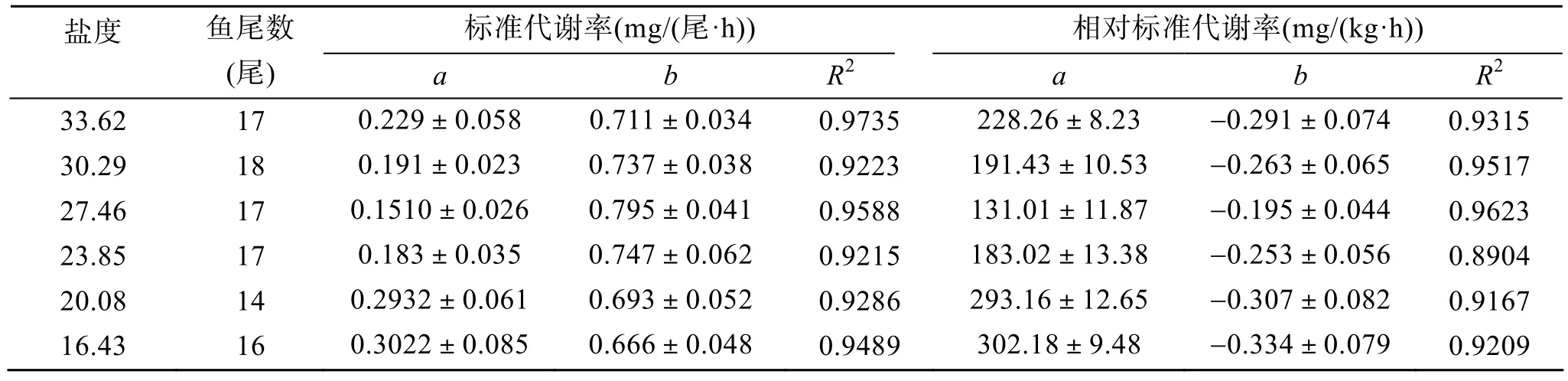
表1 不同盐度下半滑舌鳎的体质量与标准代谢率和相对标准代谢率的回归关系(Q=aMb)Tab.1 Regression coefficients of relationships between body mass and standard metabolism of Cynoglossus semilaevis at different salinities

图2 不同体质量规格的半滑舌鳎相对标准代谢率与盐度的关系Fig.2 Relationships between specific standard metabolic rates of Cynoglossus semilaevis and salinities in different body mass specifications
在本研究中,半滑舌鳎的相对标准代谢率为55.1~108.9 mg/(kg·h),平均为 72.33 mg/(kg·h),表明半滑舌鳎的标准代谢水平相对较低。这可能与半滑舌鳎的生理生态行为有关,半滑舌鳎为底栖性鱼类,喜栖息于泥沙质海底,性情较温和,耐缺氧的能力亦较强。
3.2 体质量对半滑舌鳎标准代谢率的影响
半滑舌鳎的标准代谢率随体质量的增加而增加,二者之间呈幂函数的关系,即Rs=aMb,这与其他鱼类的情况类似。b值被称为体质量指数,它的大小及变化规律反映了鱼类体质量对代谢影响的程度和方式。b值一般小于 1,这意味着单位体质量的代谢率随体质量的增加而减少,小鱼的代谢水平比大鱼要高。Cui等[12]在25℃时对3个目4个科中的6种淡水鱼类的标准代谢进行了研究,结果b值变化幅度为 0.72~1.00,平均为 0.855。Jobling[13]指出b值在 0.65~0.90。黑 在11~23.6℃之间的b值平均为 0.736[14]。褐牙鲆在13.5~27℃之间的b值为 0.6203~0.8219,平均为0.719[15]。台湾红罗非鱼在不同盐度下的b值为0.655~0.876,平均为 0.783±0.057[16]。以往的研究资料表明,只有极少数种鱼的b值>1,如草鱼 (Ctenopharyngodon idella)[17]。半滑舌鳎在22℃时不同盐度下的b值为0.725±0.045。已有的报道表明,b值与温度的关系,随着鱼类品种的不同而变化。但b值与盐度的关系,则鲜有报道。本研究表明,盐度为27.46时b值最高,但此时半滑舌鳎相对标准代谢率却最低,这可能与渗透压调节时耗能的变化有关。
3.3 盐度对半滑舌鳎标准代谢率的影响
鱼的标准代谢可分为两部分:一是组织的修复与更新所消耗的能量;二是维持内稳态所消耗的能量[18]。按照渗透调节原理,鱼类在等渗点时渗透压力最小,代谢率最低,生长率最高,因为此时维持内稳态的渗透压调节耗能最少,而远离等渗点时需要消耗更多的能量用于渗透压调节。半滑舌鳎属广盐性海水鱼类,但盐度的改变会导致其渗透压调节耗能的变化,这样标准代谢率也就发生变化。从能量代谢学的角度看,半滑舌鳎在盐度27.46附近时,有利于其生长与摄食。而在此两侧,随着盐度的变化,半滑舌鳎的标准代谢率相应增加,在20.08盐度组达到最高,说明此时半滑舌鳎用于维持内稳态所需的耗能最多,而盐度进一步降低时,标准代谢率反而下降,可能是在低盐度下,半滑舌鳎的标准代谢会受到抑制,不利于其摄食与生长。当盐度大于23.85时,大规格半滑舌鳎标准代谢率的变化幅度小于其他两组规格,小规格鱼对盐度的变化最为敏感,可见小规格鱼维持内稳态的耗能占标准代谢的比例较大规格鱼的大。随着体质量的不同,其渗透压调节耗能占标准代谢率的比例有差异,各规格组的标准代谢率随盐度变化的规律也不同。但盐度和体质量对半滑舌鳎标准代谢率的交互作用还有待进一步研究。另外,虽然人工培育的半滑舌鳎苗种目前已进入规模化的养殖,但在养殖过程中业已发现,野生苗种和人工繁育苗种在成活率、口感、抗病等方面都有区别,表明野生的半滑舌鳎和人工繁育品种在生长代谢方面有可能不同,尤其是温度、盐度以及海水 pH等环境因子对半滑舌鳎的标准代谢率的交互影响还需要进一步探讨。
致谢:上海水产大学纪成林教授、凌国建副教授为本试验鱼的鉴定给予指导与帮助,特此致谢。
[1]周洪琪,潘兆龙,李世钦,等.草鱼代谢能的研究[J].水产学报,1998,22(1):28-31.
[2]Mehner T,Wieser W.Energetics and metabolic,correlates of starvation in juvenile perch (Pweca fluvuatilis)[J].J Fish Biol,1994,45:325-333.
[3]王瑁,丘书院.花尾胡椒鲷幼鱼的标准代谢率及总代谢率[J].厦门大学学报(自然科学版),2000,39(4):530-536.
[4]王波,李继强,曹志海,等.大西洋牙鲆幼鱼标准代谢的研究[J].海洋科学进展,2004,22(1):62-68.
[5]Liu H J,Yasunori S,Hiroyuki M,et al.Effect of feeding time on oxygen consumption and ammonia excretion of Japanese flounderParalichthys olivaceus[J].Suisan Zoshoku,1997,45 (1):81-86.
[6]丘德依,秦克静.盐度对鲤鱼标准代谢的影响[J].大连水产学院学报,1993,7(4):35-42.
[7]杨振才,谢小军,孙儒泳.鲇鱼的静止代谢率及其与体重、温度和性别的关系[J].水生生物学报,1995,19(4):368-373.
[8]王艺磊,张子平,张殷鹏,等.真鲷耗氧率的初步研究[J].集美大学学报,2002,7(3):193-197.
[9]陈松波,陈伟兴,范兆廷.鱼类呼吸代谢研究进展[J].水产学杂志,2004,17(1):82-89.
[10]Brett J R,Groves T D D.Physiological energetics in fish physiology[M].New York:Academic Press,1979:279-305.
[11]线薇薇,朱鑫华.梭鱼标准代谢、内源氮排与体重和温度的关系[J].青岛海洋大学学报,2002,32(3):368-374.
[12]Cui Y,Liu J.Comparison of energy budget among six teleosts II.Metabolic rates[J].Comp Biochem Physiol,1990,91A:169-174.
[13]Jobling M.Fish Ecophysiology[C].Rankin C,Jensen F B.Bioenergetics:Feed Intake and Energy Partitioning.London:Chapman and Hall,1993:1-44.
[14]孙耀,张波,郭学武,等.黑 的标准代谢率及其与温度和体重的关系[J].海洋水产研究,1999,20(2):76-81.
[15]线薇薇,朱鑫华.体重和温度对褐牙鲆标准代谢的影响[J].应用生态学报,2002,13(3):340-342.
[16]雷思佳.盐度与体重对台湾红罗非鱼耗氧率的影响[J].应用生态学报,2002,13(6):739-742.
[17]Cater C G,Brafield A E.The relationship between specific dynamic action and growth in grass carpCtenopharyn godon idella[J]. J Fish Biol,1992,40:895-907.
[18]Jobling M.A study of some factors affecting rates of oxygen consumption of plaice,Pleuronectes platessa[J].J Fish Biol,1982,20:501-516.

