心内直视术后早期并发急性肾功能衰竭的危险因素
寇党培 边 卫 王 准 韩建阁
心内直视手术后可发生急性肾功能衰竭(ARF),ARF不仅使心脏手术患者住院日期延长,治疗费用增加,而且是患者病死率增加的独立危险因素[1-2]。笔者回顾分析了我院心脏直视术后并发ARF患者的临床资料,旨在了解心脏直视术后并发ARF的危险因素,为围术期进行肾功能保护提供参考。
1 资料与方法
1.1 一般资料 选择我院2005年10月—2010年1月行心内直视手术患者1 660例,美国麻醉医师协会(ASA)Ⅱ~Ⅳ级,瓣膜置换1 185例,瓣膜成形209例,先天性心脏病(先心病)266例。根据术后24 h是否发生ARF,分为ARF组与非ARF(NARF)组。ARF组78例(4.7%),其中男58例,女20例,年龄22~65岁,符合肾功能衰竭的诊断标准[3]。NARF组1 582例(95.3%),男968例,女614例,年龄21~64岁。术前血清肌酐(Cr)和尿素氮(BUN)未见异常,无肝肾综合征、糖尿病、高血压、肺部感染、肺不张、休克和原发泌尿系统疾病病史。
1.2 麻醉方法 麻醉前30 min肌内注射吗啡10 mg和东莨菪碱0.3 mg。入室后面罩吸氧,用Ohmeda监护仪常规建立体表心电图(ECG)、心率(HR)和脉搏血氧饱和度(SpO2)连续监测,同时常规连接脑电双频指数(BIS)监测仪。开放双上肢外周静脉通路,滴注复方乳酸钠林格氏液。行桡动脉穿刺置管连续监测动脉血压(ABP)。麻醉诱导:静脉注射咪达唑仑0.05 mg/kg、依托咪酯0.2 mg/kg、维库溴铵0.1 mg/kg和舒芬太尼1.0 μg/kg。麻醉诱导后气管插管,行机械通气,吸入氧体积分数为0.60,同时维持呼气末二氧化碳分压35~45 mm Hg(1 mm Hg=0.133 kPa),行右锁骨下静脉穿刺,放置三腔7 F中心静脉导管(深度13~15 cm),用于补液;右颈内静脉穿刺置入六腔漂浮导管,用于监测血液动力学指标。术中使用血管活性药物维持循环相对稳定;采用液体加温器维持体温。靶控输注(TCI)泵注异丙酚,同时吸入1%~2%七氟烷维持麻醉,间断静脉注射舒芬太尼镇痛、顺式阿曲库铵维持肌松。
1.3 观察指标 记录患者的性别、年龄、发病至入院时间、基础疾病、术前心功能、心脏射血分数、心胸比例、血清Cr、BUN、血β2-微球蛋白、术中体外循环时间、主动脉阻断时间、有否低氧血症、出现感染及是否用主动脉内球囊反搏、是否属二次手术。急性肾功能衰竭的诊断标准为:术后24 h时肾小球滤过功能呈进行性急剧下降,血肌酐每日升高44~88 μmol/L。低心排出量综合征:心指数<3 L/min而有周围血管收缩,组织灌注不足,末梢循环不良的现象。
1.4 统计学处理 所有数据均采用SPSS 13.0统计软件处理,计量资料以均数±标准差(±s)表示,计数资料以例(%)表示。计量资料比较用t检验,计数资料比较用χ2检验。多项指征行单因素分析,有统计学意义的临床指征则进行多因素Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 2组一般情况比较 2组年龄、病程、术前Cr、BUN、手术时间比较差异无统计学意义(均P>0.05),见表1。
表1 2组一般情况比较 (±s)

表1 2组一般情况比较 (±s)
均P>0.05
组别 n ARF组NARF组t或χ2 78 1 582年龄(岁)39.3±24.6 37.6±25.8 0.502病程(a)18.1±6.8 18.5±5.9 0.580术前Cr(mmol/d)8.2±1.3 7.9±1.6 1.966术前BUN(mmol/L)4.8±2.4 4.3±2.6 1.664手术时间(min)218.9±36.2 225.9±40.1 1.512
2.2 2组术前临床资料的比较 血β2-微球蛋白高于正常值、术前心功能Ⅲ级和心脏射血分数、术中体外循环时间、主动脉阻断时间、术后低心排出量综合征时间、低氧血症、使用主动脉内球囊反搏和属二次手术等指征2组比较差异有统计学意义(P<0.05或P<0.01),见表2。
2.3 多因素Logistic回归分析 对单因素分析有统计学意义的临床指征进行多因素Logistic回归分析,结果有术前血β2-微球蛋白高于正常值(Xl)、术中体外循环时间(X2)及术后低心排出量综合征时间(X3)3个临床指征进入多元回归方程,为心脏直视术后并发ARF的独立危险因素(均P<0.05)。其中Xl=0表示术前血β2-微球蛋白高于正常值(1.5 mg/L),Xl=1表示术前血β2-微球蛋白等于或低于正常值;X2=0表示体外循环时间大于或等于100 min,X2=1表示体外循环时间小于100 min;X3=0表示低心排出量综合征时间大于或等于10 h,X3=1表示低心排出量综合征时间小于10 h。Xl、X2和X3均为术后早期并发ARF的危险因素(P<0.05),见表3。
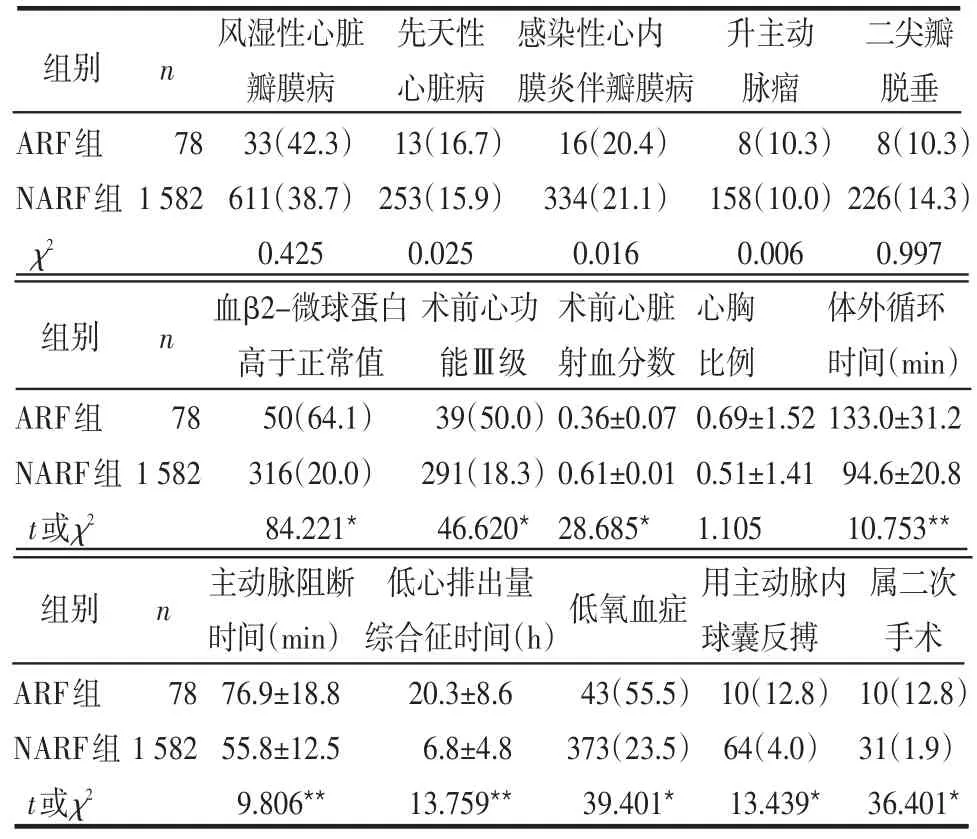
表2 2组临床资料的比较
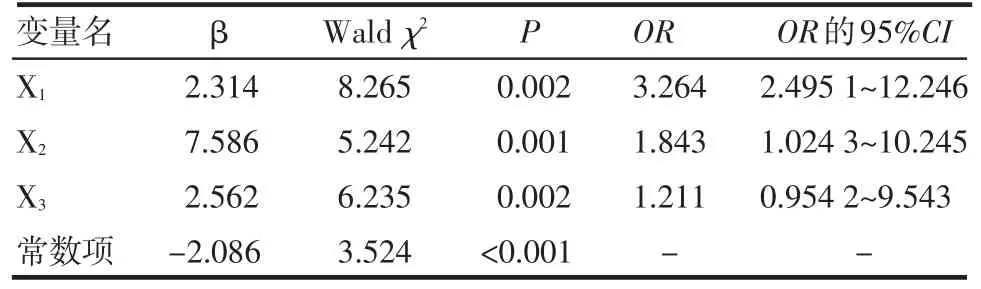
表3 Logistic回归分析结果
3 讨论
本研究心脏直视术后ARF的发生率为4.7%,与文献报道相近[4-5]。心脏直视术后发生ARF可能与以下因素有关。(1)慢性心功能不全患者由于体循环长期淤血,使肾内血流量重新分布,肾小球滤过率下降,造成肾功能不同程度的损害,使原有的慢性肾功能不全急性发作。(2)术前心功能较差患者,在术前可能已引起心源性肾功能不全,而术中心肺转流时间往往较长,易产生低心排出量综合征,使肾脏持续低灌注压,引起肾缺血,导致ARF。(3)体外循环期间肾脏的低灌注、高浓度血管收缩剂的应用,以及血红蛋白微小栓子沉积于肾小球、肾小管内等原因,可导致术后肾缺血、肾小球滤过率下降而发生ARF[6]。(4)术后低心排出量综合征,可使肾脏灌注压降低,机体反射性减少肾血流量和肾小球滤过面积,肾素-血管紧张素释放增加,加剧了肾脏的缺血、缺氧性损害,并继发难以纠正的重度代谢性酸中毒。主动脉阻断后至术后早期严重的血流动力学障碍是导致ARF的主要因素。
术中血液动力学变化是心内直视术后ARF的高危因素。心内直视手术损伤大、时间长,同时存在其他并发症和有效循环血容量不足,凝血功能紊乱而导致术中出血增加,机体难以代偿等,术中持续的血液动力学剧烈波动是不可避免的。肾脏是高血流灌注、高氧耗量的器官,对缺血缺氧非常敏感,术中低血压所引起的肾低血流灌注可引起肾脏的缺血性损伤,若不及时纠正可使肾小管细胞坏死、脱落,阻塞肾小管,使腔内压力增高,肾小球滤过率降低,并诱发肾素-血管紧张素系统激活,使肾小球血管收缩,进一步降低肾小球滤过率,最终转变成不可逆的损伤。
本研究结果表明,术前血β2-微球蛋白高于正常值、术中体外循环时间过长及术后长时间低心排出量综合征是术后早期并发ARF的危险因素。
[1]吴晓云,瞿晓红,臧旺福.心脏术后急性肾损伤早期监测的新生物学指标[J].国际检验医学杂志,2009,30(3):260-261.
[2]Davies RS,Dawlatly S,Clarkson JR,et al.Outcome in patients requir⁃ing renal replacement therapy after open surgical repair for ruptured abdominal aortic aneurysm[J].Vasc Endovascular Surg,2010,44(3):170-173.
[3]Hishida A.Causes and differential diagnosis of AKI/acute renal fail⁃ure[J].Nippon Jinzo Gakkai Shi,2010,52(5):529-533.
[4]Haase M,Shaw A.Acute kidney injury and cardiopulmonary bypass: special situation or same old problem[J]?Contrib Nephrol,2010,165(5):33-38.
[5]Iyem H,Tavli M,Akcicek F,et al.Importance of early dialysis for acute renal failure after an open-heart surgery[J].Hemodial Int, 2009,13(1):55-61.
[6]Abou El-Ella RS,Najm HK,Godman M,et al.Acute renal failure and outcome of children with solitary kidney undergoing cardiac surgery[J].Pediatr Cardiol,2008,29(3):614-618.

