大孔树脂分离纯化玉米苞叶总黄酮方法研究
孟 雪,吴 春
(哈尔滨商业大学食品工程学院,哈尔滨150076)
玉米苞叶为禾本科(Gramineae)玉米属(zea)玉米(zea mays L)的苞叶,一年生草本植物,原产于拉丁美洲,在我国主要分布于北方和西南山区.我国玉米资源丰富,但大量玉米苞叶被废弃而并没能得到有效利用.而玉米苞叶中含有丰富的具有抗衰老、抗菌、抗氧化、抗肿瘤、抗病毒、抗糖尿病、护肤美容等作用的黄酮类物质[1-2].大孔吸附树脂是近十几年发展起来的一类有机高分子聚合物吸附剂,近年来已广泛应用于各种植物和中草药黄酮类化合物的分离纯化过程,树脂本身的性质不同程度地影响着分离纯化效果[3-6].本实验选用5种大孔树脂对玉米苞叶黄酮粗提物进行静态吸附解吸,从中选出吸附容量大、易解吸的大孔树脂,并对其纯化的方法和条件做出了进一步的研究,为今后工业化研究和开发玉米苞叶黄酮类产品奠定基础.
1 仪器与材料
1.1 材料
玉米苞叶(均采于黑龙江省双城市同一地点,经洗净、干燥、粉碎机粉碎、过40目筛等处理呈粉末状);芦丁对照品(中国医药(集团)上海化学试剂公司);纤维素酶(10 000 u/g);S-8、AB-8,X-5,H-103,NKA-9大孔树脂(南开大学化工厂);其他化学试剂均为分析纯或化学纯.
1.2 主要仪器设备
DHG-9070A型电热恒温鼓风干燥箱(上海一恒科技有限公司);植物粉碎机FZ102型(天津泰斯特仪器有限公司);电子天平FA2004N(上海精密科学仪器有限公司);PC-1000数显式电热恒温水浴锅(上海跃进医疗器械厂);SHZ-A水浴振荡器(上海申胜生物技术有限公司);SHZ-D(Ⅲ)型循环水式真空泵(巩义市英峪予华仪器厂);R-205旋转蒸发仪(上海申胜生物技术有限公司);721E分光光度计(上海光谱仪器有限公司).
2 试验方法
2.1 玉米苞叶总黄酮的提取及质量浓度测定
2.1.1 标准曲线的制作
准确称取芦丁标准品0.010 g,用无水乙醇溶解,定容至100 mL,得质量浓度为0.1 mg/mL芦丁标准液.分别准确吸取芦丁标准液0、0.5、1.0、2.0、3.0、4.0、5.0 mL于10 mL刻度试管中,加入5%NaNO2溶液0.3 mL,摇匀,放置6 min后加入10%Al(NO3)3溶液0.3 mL,摇匀,放置6 min后加入1 mol/LNaOH溶液4 mL,再用无水乙醇定容至刻度,摇匀后放置15 min,于510 nm处测定吸光度A(以第一管为测定空白).得到芦丁质量浓度(X)与吸光度(A)的回归方程为A=8.7717X-0.0021 (R2=0.9998).
2.1.2 玉米苞叶总黄酮粗提物的制备及质量浓度测定
称取一定量的玉米苞叶粉末,在酶用量为1.5%,酶解温度55℃,pH值为5.5的酶解条件下酶解1.5 h,减压过滤,在滤渣中加入100 mL80%的乙醇,在70℃下水浴震荡中提取4 h,减压抽滤,将滤液旋转蒸发浓缩至无醇味,待测液的质量浓度测定同标准曲线.
2.2 玉米苞叶总黄酮粗提物的纯化
2.2.1 大孔树脂的预处理
将市售树脂用4倍体积的95%乙醇浸泡24 h,充分溶胀后,用乙醇清洗至流出液加适量蒸馏水无白色混浊现象.用蒸馏水洗至无醇,然后用5% HCl溶液浸泡12 h,用蒸馏水洗至中性;最后用5%NaOH溶液浸泡12 h,再用蒸馏水洗至中性,备用.
2.2.2 大孔树脂的筛选
准确称取预处理好的五种树脂(AB-8,S-8,X-5,H-103,NKA-9)1.0 g装入具塞磨口锥形瓶中,加入玉米苞叶类黄酮水溶液(初始质量浓度为0.310 mg/mL)17.5 mL,置恒温水浴振荡器上在25℃下振荡24 h.使其达到饱和吸附,过滤,测定滤液中剩余黄酮质量浓度,计算各树脂25℃下的吸附率(%).然后将经静态吸附类黄酮后吸附饱和的树脂滤出,吸干表面水分,加入95%的乙醇50 mL,置恒温水浴振荡器上25℃下振荡24 h,过滤,测定滤液中类黄酮质量浓度,计算各树脂25℃下的解吸率(%).
2.2.3 静态吸附与解吸动力学曲线
称取2 g树脂于250 mL的三角瓶中,加入总黄酮质量浓度为0.040 5 mg/mL的玉米苞叶总黄酮粗提液120 mL,室温置于摇床上连续震荡,每小时定时取样,确定合理的吸附时间.取吸附饱和的树脂,加入50%的乙醇100 mL,置于振荡器上,每30 min测定黄酮质量浓度,确定合理的解吸时间.
2.2.4 动态工艺参数的考察
将处理好的树脂湿法装入内径为2 cm,长为60 cm的树脂柱后,加入一定量的玉米苞叶总黄酮粗提液,调节流速,吸附一定时间后,先用蒸馏水冲洗去除多糖、蛋白质等杂质,再加一定质量浓度的乙醇作为洗脱剂进行洗脱,收集洗脱液,考察上样流速、pH值、洗脱速率、洗脱剂体积分数、洗脱流速等玉米苞叶总黄酮的参数的影响,优化工艺.
2.2.5 玉米苞叶总黄酮提取物纯度的测定
取5 g玉米苞叶粉末,用2.1.3的方法提取,浓缩,干燥成干膏,称重.用醇稀释溶解,测定黄酮含量,计算总黄酮纯度.取上述溶液10 mL,挥去乙醇,并用水稀释至20 mL,根据最佳工艺参数上柱、洗脱,收集乙醇洗脱液,浓缩,干燥称重,再用稀醇溶解并定容25 mL,依前法测定并计算黄酮纯度.
纯度=C×V/M×100%
其中:C为纯化后黄酮质量浓度(mg/mL),V为黄酮液体积(mL),M为黄酮物质干重(mg).
3 结果与讨论
3.1 大孔树脂的筛选
从表1可以看出,由于树脂的极性、孔径、比表面、孔容等不同,不同类型树脂对黄酮的吸附程度不同,综合吸附率和解吸率两个因素,S-8大孔树脂不仅有较高的吸附率还有较高的解吸率,是比较好的吸附树脂,更适合玉米苞叶总黄酮的研究,故选择S-8大孔树脂进行动态吸附试验.

表1 不同大孔树脂对玉米苞叶总黄酮的吸附性质测定结果
3.2 大孔树脂静态吸附与解吸动力学曲线
3.2.1 静态吸附曲线
图1显示了S-8树脂的吸附变化趋势,开始的一段时间内,S-8树脂的吸附率在逐渐增加,随着时间的延长,吸附量逐渐达到饱和.当吸附时间达到5 h后,样液质量浓度随时间变化趋于平缓,即树脂吸附已经基本达到平衡.
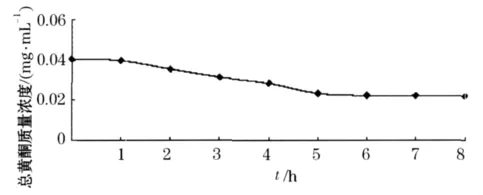
图1 大孔树脂静态吸附曲线
3.2.2 静态解吸曲线
从图2可以看出,开始一段时间内,黄酮的解吸逐渐增加;当解吸时间达到1.5 h时,解吸基本达到平衡.因此,S-8大孔树脂对玉米苞叶黄酮的解吸时间为1.5 h.

图2 表态解吸曲线
3.3 大孔树脂动态工艺参数
3.3.1 pH值对玉米苞叶总黄酮动态吸附量的影响
黄酮类化合物为多羟基酚类化合物,具有一定的极性和酸性,所以上柱液pH值对玉米苞叶黄酮类化合物的吸附效果会有一定影响.由图3可知,当上样液pH值偏大时,玉米苞叶总黄酮有离子化趋势而不易被吸附,样液pH值为4~5时大孔树脂吸附量最大,因此,选择pH值为4~5.
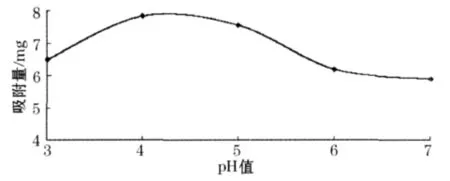
图3 不同pH值对大孔树脂吸附量的影响
3.3.2 上样流速对吸附量的影响
图4表明随着上柱液流速的增加,吸附量下降,原因是吸附是一个动态平衡的过程,在相同的吸附速度下流速加快必然使相对吸附的时间减少,流速过快黄酮类化合物来不及扩散到树脂的内表面而发生漏过,导致吸附率降低,故本实验选择1 mL/min的速度上样,从而提高其吸附率.
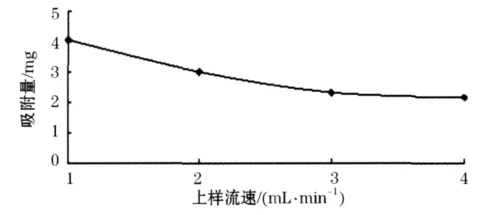
图4 上样流速对大孔树脂吸附量的影响
3.3.3 洗脱速率对解吸率的影响
由图5所示,解吸率随着洗脱速率的增加逐步降低,但乙醇洗脱速率在1.5 mL/min和3.0 mL/ min时解吸率相差不大,考虑生产周期的问题,可以把洗脱速率定为3.0 mL/min.
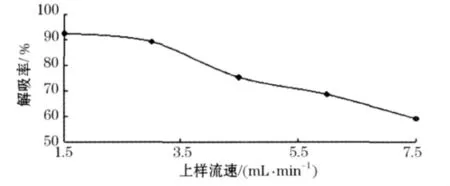
图5 洗脱速率对大孔树脂解吸率的影响
3.3.4 乙醇质量分数对洗脱率的影响
由图6所示,在乙醇质量分数为80%时解析率达到最高,然后开始下降,故选择质量分数为80%的乙醇作为洗脱剂.

图6 乙醇质量分数对大孔树脂解吸率的影响
3.4 玉米苞叶总黄酮纯度的测定
由表2可知,S-8树脂能提高玉米苞叶总黄酮的纯度,纯化后的黄酮纯度为66.3%,工艺稳定可行,纯度提高3.5倍.

表2 树脂纯化前后的总黄酮纯度
4 结论
1)通过对5种大孔树脂的静态吸附研究,发现S-8型大孔树脂是一种比较理想的树脂,适合玉米苞叶黄酮的纯化.
2)S-8大孔树脂对玉米苞叶黄酮的吸附平衡时间为5 h,解吸平衡时间为1.5 h,最佳上柱pH值为4~5,以1.0 mL/min的吸附流速上样,以3倍体积的蒸馏水冲洗再以质量分数为80%乙醇溶液进行洗脱,洗脱用量100 mL,流速3 mL/min.
3)经纯化后的玉米苞叶总黄酮纯度为66.3%.
[1] 詹 萍,田洪磊,李开雄.玉米苞叶中总黄酮提取及其体外抗氧化性能的研究[J].中国生态农业学报,2007,15(6):108-112.
[2] 耿敬章.超声波辅助提取玉米中黄酮类化合物[J].食品研究与开发,2008,29(8):42-45.
[3] 陈玉琼,李安琪,孟 燕.大孔树脂纯化藤茶黄酮及主要成分结构鉴定[J].食品科学,2009,30(9):51-55.
[4] 刘延吉,孙素梅,王学密,等.AB-8型大孔树脂分离纯化南果梨黄酮类化合物的研究[J].食品工业科技,2008(2): 68-70.
[5] 潘道东,林 璐.DA201-C大孔吸附树脂静态吸附ACE抑制肽的研究[J].食品科学,2009,30(5):20-23.
[6] 桑咏梅,丁振铎.D-101型大孔树脂对三萜类成分的吸附性能研究[J].哈尔滨商业大学学报:自然科学版,2011,27 (1):12-16.

