丙酮丁醇梭菌中丁醇脱氢酶的分离纯化及酶学性质研究
孙 超,谢达平
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
随着全球化石能源的日益枯竭和环境污染的恶化,生物丁醇作为一种生物能源和重要化工原料以其新型、洁净、可再生等特点开始受到人们的高度重视[1]。就传统的丙酮丁醇发酵而言,依然存在着菌种耐受有机溶剂能力低、丁醇产量、产率低等缺点[2]。针对传统丙酮丁醇发酵中存在以上问题,以发酵菌种的改良为主要目的,采用分子生物学手段、基因工程及代谢工程来提高丁醇的产量已成为研究的热点。
丙酮丁醇发酵的主要菌种是丙酮丁醇梭菌(Clostridium acetobutylicum),是一种革兰氏阳性、细胞呈梭状、能产生丙酮、丁醇和乙醇(3∶6∶1,w/w)溶剂的厌氧芽孢杆菌。丙酮丁醇梭菌细胞代谢过程中,通过解除代谢过程中各种可能的中间产物的抑制,调控强化各种关键酶,如丁醛脱氢酶(BAD)、乙酰乙酸脱羧酶(AADC)、乙酰乙酰-CoA:乙酸/丁酸∶CoA 转移酶(CoAT)、丁醇脱氢酶(BDH)等,对加强丁醇的合成代谢,提高丁醇的产量具有重要的意义[3-4]。其中丁醇脱氢酶BDH(EC 1.1.99.8)作为丁醇代谢途径中的关键酶之一,直接影响到最终产物丁醇产量的高低。丁醇脱氢酶是一种诱导酶,在产溶剂阶段酶活力达到最高[5],其分子量为82±2 kDa,由两个分子量都为42 kDa的同工酶(Ⅰ和Ⅱ)组成,其中BDHⅠ作用于丁醇合成初期,BDHⅡ作用于丁醇浓度较高的时期,根据对辅酶的依赖性可分为依赖NADH的BDH和依赖NADPH的BDH[6-9],该菌株中依赖NADH的BDH在国内未见报道,为此,本文研究了丙酮丁醇梭菌发酵过程中依赖NADH的BDH的分离纯化,旨在为丙酮丁醇梭菌代谢途径的调控提供一定的理论基础和实验依据。
1 材料与方法
1.1 材 料
1.1.1 菌 种 丙酮丁醇梭菌(Clostridium acetobutylicum),中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)保存,菌种编号1.0133。
1.1.2 试剂及仪器 供试试剂为NADH,L-半胱氨酸,正丁醛,硫酸铵等。仪器为超声波破碎仪,紫外分光光度计,冷冻离心机,恒温培养箱,冷冻干燥机等。
1.1.3 培养基 (1)活化培养基:玉米粉2%,蛋白胨0.05%,葡萄糖0.2%,L-半胱氨酸0.05%,硫代乙醇酸钠0.02%。过40目筛的玉米粉需煮沸60min,pH调至6.8,分装于厌氧管中,装液量5 mL,于121℃灭菌20min。(2)种子培养液:葡萄糖4%,牛肉膏0.2%,酵母膏0.2%,蛋白胨0.6%,乙酸铵0.3%,K2HPO40.05%,MgSO40.02%,FeSO40.001%,pH调至6.5,分装于带硅胶塞的厌氧瓶中,装液量60mL,于 121℃灭菌 20min。(3)发酵培养基:同种子培养液,分装于厌氧瓶中,装液量150 mL,于121℃灭菌20min。
1.2 方 法
1.2.1 菌种活化与发酵培养 从保存的丙酮丁醇梭菌斜面上挑取一环细菌接种于新鲜的活化培养基中,35℃培养48 h。从已经产生气体的活化培养基中吸取0.5 mL菌液接种于种子培养液,35℃静置培养24 h,再取种子培养液以5%的接种量接种于发酵培养基中,35℃静置培养48 h。
1.2.2 丁醇脱氢酶粗酶液的制备 细胞培养约48 h,检测是否有代谢产物的产生,若有则置于冰浴中停止培养,5 000 r/min,4℃,离心10min收集细胞。蒸馏水洗涤2次,测定细胞湿重,并以1:3的比例用 0.1 mol/L Tris-HCl(含 0.1mmol/L DTT)pH 7.5的缓冲液使细胞重悬。细胞重悬液置于冰浴中,超声波细胞破碎仪破碎细胞,功率20W,10 min,间歇10 s。细胞破碎液经 10 000 r/min,4℃,离心 10min,所得上清液即为粗酶液,4℃备用[10]。
1.2.3 丁醇脱氢酶酶活测定 对细胞粗酶液测定BDH酶活可通过(1)式进行反应换算:

通过测定NADH在340 nm下的降低量从而测定丁醇脱氢酶酶活。反应体系为:3mL 0.01mol/L Tris-HCl,pH 6.0缓冲液中含2 mmol/L丁醛,0.5 mmol/LNADH及50μL酶液[11]。加入丁醛之前,含有酶液的反应体系先于35℃水浴中平衡30min,然后补加适当的NADH,再加入底物丁醛,35℃反应10 min,迅速置于冰浴中5min,终止反应,在340 nm下比色,计算NADH在340 nm下读数的降低值,空白对照用等体积的去离子水替代底物丁醛[12]。酶活力单位定义:每1min NADH的OD值下降0.001为1个酶活力单位[13]。
1.2.4 蛋白质浓度的测定 用考马斯亮蓝结合法测定蛋白质的质量浓度[14]。
1.2.5 丁醇脱氢酶的分离纯化 将研细的(NH4)2SO4按照20%的饱和度加入到粗酶液中,4℃下静置1 h,再在10 000 r/min下离心30min,弃去沉淀(沉淀为初步分离的杂蛋白),取上清液加硫酸铵至60%饱和度,4℃下静置1 h后10 000 r/min下离心30 min,弃去上清液,沉淀用10 mmol/L pH 6.4的磷酸盐缓冲液溶解[15]。取上述酶液2mL,以0.5mL/min的流速进行Sephadex G-75凝胶层析,分部收集洗脱液,每管收集4 mL,在280 nm下测定各管OD值,并测定各部分活性[16]。
1.2.6 丁醇脱氢酶的SDS-PAGE分析 将经过硫酸铵沉淀及Sephadex G-75凝胶层析后具有酶活的酶液进行SDS-PAGE电泳检测[17-18]。
2 结果与分析
2.1 分离纯化结果及分析
丁醇脱氢酶纯化结果如表1所示。结果表明经过2次硫酸铵沉淀,硫酸铵饱和度为60%,可除去部分非蛋白质杂质,酶比活力由20.21 U/mg提高到33.14 U/mg,纯化倍数为1.64。再经过Sephadex G-75凝胶层析进一步纯化,通过分子筛作用酶比活力提高到256.7 U/mg,纯化倍数为12.7。
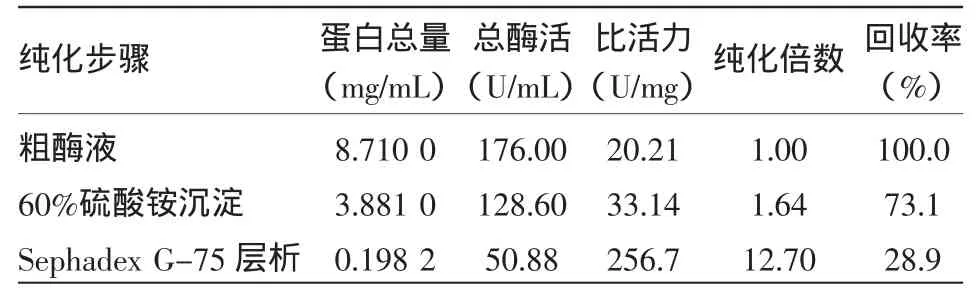
表1 丙酮丁醇梭菌中丁醇脱氢酶的纯化
2.2 Sephadex G-75柱色谱洗脱曲线
将收集到的洗脱液分别测定280 nm下的蛋白浓度和具有蛋白峰管数的酶活,其结果如图1。结果表明蛋白浓度在第12,16和23管分别出现三个峰,其中第16管峰值最大,而具有丁醇脱氢酶活性的出现在第18~20管,将其冷冻干燥保存备用,作为电泳鉴定分析。
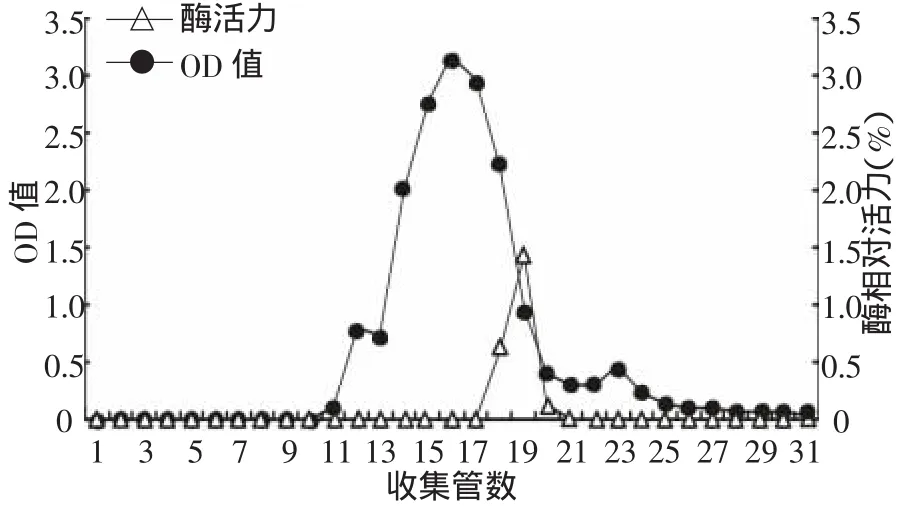
图1 Sephadex G-75凝胶层析曲线图
2.3 SDS-PAGE电泳鉴定分析
将每步纯化收集的具有酶活的组分进行SDSPAGE,结果见图2。在42.0 kDa附近出现了一条带,与报道的目的蛋白结果相符。

图2 SDS-PAGE电泳分析丁醇脱氢酶
2.4 丁醇脱氢酶酶学性质研究
2.4.1 粗酶液中丁醇脱氢酶的稳定性 按照1.2.3方法在有氧状态下每24 h测定粗酶液中丁醇脱氢酶的活力,观察保存于4℃下丁醇脱氢酶的稳定性,结果如图3。丁醇脱氢酶在10 d后其活力下降至初始活力的30%。
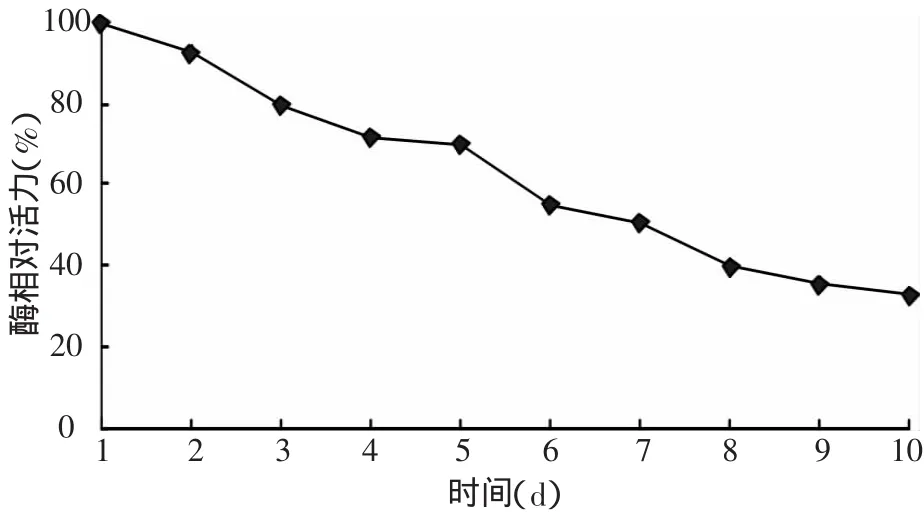
图3 丁醇脱氢酶的稳定性
2.4.2 丁醇脱氢酶的最适反应温度 按照1.2.3中的方法,分别取 20、25、30、35、40、45、50℃下测定其酶活,结果见图4。由图4可以看出在35℃下丁醇脱氢酶的活力达到最高值,其最适反应温度为35℃。

图4 温度对丁醇脱氢酶的影响
2.4.3 丁醇脱氢酶的最适反应pH值 按照1.2.3中的方法,在35℃下,将缓冲液的pH值分别调制4.0、5.0、6.0、7.0、8.0、9.0、10.0 并测定其酶活,结果见图5。由图5可以看出丁醇脱氢酶在pH为6.0的时候达到最高值,但是酶受pH的影响并不显著。

图5 pH值对丁醇脱氢酶的影响
3 结 论
本实验从丙酮丁醇梭菌中分离纯化了依赖NADH的丁醇脱氢酶,经过硫酸铵沉淀和Sephadex G-75凝胶层析,酶比活力达到256.7 U/mg,纯化倍数为12.7,回收率为28.9%,丁醇脱氢酶在有氧状态下保存10 d酶活力为初始酶活的30%,其最适反应温度是35℃,最适反应pH是6.0。由于细胞内有关丁醇代谢途径的关键酶含量不高,且易氧化失活,胞外反应体系构建中其它酶和天然底物与NADH存在耦联反应,给酶活测定造成一定的难度。本文将丁醇脱氢酶酶活测定方法进行适当改良从而避免其它酶和天然底物对实验结果所带来的影响。
[1] Joungmin L,Hongseok Y,Adam M,et al.Genome-scale reconstruction and in silico analysis of the Clostridium acetobutylicum ATCC 824metabolic network[J].Appl Microbiol Biotechnol,2008,(80):849-862.
[2] 刘 娅,刘宏娟,张建安,等.新型生物燃料-丁醇的研究进展[J].现代化工,2008,28,(6).
[3] 靳孝庆,王桂兰,何冰芳.丙酮丁醇发酵的研究进展及其高产策略[J].化工进展,2007,26(12):1727-1732.
[4] 王旭明,仇天雷,林有胜,等.酶水解液的丁醇发酵条件优化研究[J].安徽农业科学,2009,37(34):17277-17280.
[5] Andersch W,Bahl H,Gottschalk G.Level of enzymes involved in acetate,butyrate,acetone and butanol formation by Clostridium acetobutylicum[J].Eur.J.Appl,Microbiol,1983,18:327-332.
[6]Ramesh V N,George N B,Eleftherios T P.Molecular Characterization of an Aldehyde/Alcohol Dehydrogenase Gene from Clostridium acetobutylicum ATCC 824[J].Journal of Bacteriology,1994,173,(3):871-885.
[7] 何景昌,张正波,裘娟萍.生物丁醇合成途径中关键酶及其基因的研究进展[J].食品与发酵工业,2009,35,(2):116-120.
[8] Peter D,Anita K,Matthias G,et al.Enzymatic investigations on butanol dehydrogenase and butyraldehyde dehydrogenase in extracts of Clostridium acetobutylicum[J].Appl Microbiol Biotechnol,1987,(26):268-272.
[9] Welch R W,Rudolph F B,Papoutsakis E T.Purification and characterization of the NADH-dependent butanol dehydrogenase from Clostridium acetobutylicum(ATCC 824)[J].Arch Biochem Biophys,1989,273(2):309-318.
[10]Karl AW,George N B,Eleftherios T P.Molecular Characterization of Two Clostridium acetobutylicum ATCC 824 Butanol Dehydrogenase Isozyme Genes[J].Journal of Bacteriology,1992,174(22):7149-7158.
[11]Daniel JP,Richard W W,Frederick B R.Molecular cloning of an alcohol(butanol)dehydrogenase gene cluster from Clostridium acetobutylicum ATCC 824[J].Journal of Bacteriology,1991,173(5):1831-1834.
[12]黄志华,张延平,黄 星,等.在Klebsiella pneumoniae醛脱氢酶失活菌中构建NADH再生系统 [J].中国生物工程杂志,2006,26(12):75-80.
[13]蒋 宇,邵蔚蓝.嗜热厌氧产乙醇杆菌乙醇代谢途径的初步研究[J].南京师大学报(自然科学版),2005,28,(3):69-73.
[14]陈雅蕙,萧能赓,余瑞元,等.生物化学实验原理和方法(第二版)[M].北京:北京大学出版社,2005.
[15]赵永芳.生物化学技术原理及应用(第二版)[M].北京:科学出版社,2002:23-26.
[16]陈钧辉,李 俊,张太平,等.生物化学实验(第四版)[M].北京:科学出版社,2008.
[17]颜 真,张英起.蛋白质研究技术[M].西安:第四军医大学出版社,2007.
[18]许春梅,夏 宇.蛋白质组学技术的研究与应用[J].湖南农业科学,2009,(3):4-6.

