姜黄素对口腔舌癌细胞增殖与转移能力影响的实验研究
陈教文 汤亚玲 刘红 朱志宇 吕迪 耿宁 陈宇
(口腔疾病研究国家重点实验室,四川大学,成都 610041)
姜黄素对口腔舌癌细胞增殖与转移能力影响的实验研究
陈教文 汤亚玲 刘红 朱志宇 吕迪 耿宁 陈宇
(口腔疾病研究国家重点实验室,四川大学,成都 610041)
目的 探讨姜黄素对口腔舌癌细胞增殖与转移能力的作用及其作用机制。方法 分别以0、5、10、20、30、60、100μmol·L-1姜黄素处理人舌癌细胞SCC-4 24 h,采用MTT法、侵袭实验、流式细胞仪、免疫荧光显微镜分别检测姜黄素对口腔舌癌细胞增殖与转移能力的影响。然后,采用cDNA微陈列芯片技术筛选和实时定量RTPCR验证姜黄素所调控的相关基因。结果 MTT法检测显示:超过20μmol·L-1浓度时姜黄素明显地抑制细胞增殖。侵袭实验显示:姜黄素在20、30、60μmol·L-1时对SCC-4癌细胞的侵袭有明显抑制作用。流式细胞仪分析显示:姜黄素在20、30、60μmol·L-1的剂量下对细胞周期的分布有显著的作用,荧光显微镜观察,姜黄素(30μmol·L-1)会造成SCC-4癌细胞的细胞支架中的alpha-tubulin产生聚集的现象。cDNA微陈列芯片分析显示:87个基因可被姜黄素诱导增加;198个基因受姜黄素抑制。结论 姜黄素抑制口腔舌癌的增殖和转移,其机制可能是使cdc27、EGFR substrate 15、PPAR-alpha和H2A histone基因表达水平降低,从而使细胞停留在细胞周期的M期,达到抗舌癌细胞增殖的作用。
舌癌; 姜黄素; 增殖; 转移
舌癌(tongue cancer)是口腔常见的恶性肿瘤之 一[1],初期症状不明显,大部分患部在诊断时可能已经发生浸润或转移。因此,疾病的治疗和预后也大受影响。癌症的治疗效果主要取决于肿瘤细胞复发或转移的能力,而转移能力则是判断患者愈后的重要指标。虽然已研究出许多药物能够有效地控制癌细胞的生长,但至今仍无有效药物能够抑制癌细胞的转移[2]。
姜黄素(curcumin)是姜黄(curcuma longa)中最重要的有效主成分之一,传统上常用其作为食材的矫色以及矫味,近年来也常作为化妆品以及医药上的添加物。在传统医学上,姜黄味苦辛,入肝脾,功能理血中之气,下气破血,除风消肿,力烈于郁金;被认为有治气胀血积,产后败血攻心,通月经,疗补损及治风寒湿痹。现代医学研究发现,姜黄素具有抗氧化(清除自由基)、抗动脉粥样硬化、抗癌、抗炎及抗血管新生等功能[3-4],但就其理论及机制的研究还相当缺乏。本研究首先检测姜黄素是否具有抑制口腔舌癌上皮细胞增殖与转移的能力,然后,在姜黄素不会使正常细胞致死的剂量下,以cDNA微陈列芯片技术筛选出姜黄素调控的相关基因,以探讨姜黄素抗癌能力的机制。
1 材料和方法
1.1 主要的实验材料和仪器
姜黄素(Sigma公司,美国)采用高效液相色谱法从姜黄中提取,相对分子质量为368.38,分子式为[HOC6H3(OCH3)CH=CHCO]2CH2。用10mmol·L-1DMSO液配置成0、5、10、20、30、60、100μmol·L-1,备用。cDNA微陈列芯片以及人舌癌细胞SCC-4(中国台湾国立大学提供)。
1.2 姜黄素对人舌癌细胞增殖和侵袭作用的影响
1.2.1 细胞培养 将SCC-4置于DMEM培养液中培养,然后每3 d传代培养。分别用0、5、10、20、30、60、100μmol·L-1的姜黄素处理细胞24 h,以作下面的检测。
1.2.2 细胞存活率检测 采用MTT法检测细胞存活率。
1.2.3 侵袭实验 采用Matrigel侵袭实验检测经过不同剂量姜黄素处理过的SCC-4癌细胞侵袭能力的差异。
1.2.4 流式细胞仪分析细胞周期 细胞经药物处理后,70%乙醇固定,以碘化丙啶(propidium iodide,PI)染细胞核,上机检测细胞周期。以细胞在G0/G1、S和G2/M期的比例来测量细胞周期。
1.2.5 免疫荧光染色法 先将SCC-4细胞在载玻片上培养,经药物处理后,70%乙醇和甲醇将细胞固定,以triton-X 100及皂甙处理增加细胞膜通透性。然后以3%BSA阻断,30 min后将玻片和alphatubulin的一抗反应(浓度1∶100),再将玻片和带有FITC的二级抗体(浓度1∶500)反应。以不加一抗细胞作为阴性对照。最后用PI将细胞核染色,并观察细胞周期。
1.3 基因芯片微陈列分析筛选差异基因
从不同剂量姜黄素处理过的癌细胞中萃取出RNA并分离之,并将其反转录为cDNA。再对所反转录的cDNA与制备好的探针进行杂交,并以酵素呈色,测量芯片上各探针位置的表现量。最后经过扫描以撷取呈色影像。搭配GenePix 3.0软件将所得影像数据转成数值资料。再用SPSS 13.0统计软件做统计分析进行基因筛选。
1.4 验证基因芯片微陈列分析筛选出的差异基因
利用实时定量RT-PCR验证差异基因mRNA的表现量。以Primer express软件设计待测基因引物,再以SYBR Green PCR master mix标定cDNA而后以ABI 7700 Sequence Detection System进行反应。以验证在RNA层次上,微数组分析结果的正确与否。
2 结果
2.1 姜黄素具有抑制人舌癌细胞增殖与侵袭的能力
分别以0、5、10、20、30、60、100μmol·L-1姜黄素处理SCC-4癌细胞24 h,MTT法检测显示:超过20μmol·L-1浓度,姜黄素明显地抑制细胞增殖;其50%抑制有效浓度为30μmol·L-1,在此浓度下,不会对正常细胞造成明显的毒性作用(图1),但在100μmol·L-1的姜黄素处理下,则对正常细胞有明显的毒性作用。进一步以Matrigel侵袭实验观察癌细胞侵袭能力的改变。结果显示:姜黄素在20、30、60μmol·L-1时对SCC-4癌细胞的侵袭有明显抑制作用(图2)。

图1 在不同浓度姜黄素的作用下SCC-4细胞的增殖活性Fig 1 Cell proliferation of SCC-4 cells in different doses of curcumin
流式细胞仪分析SCC-4癌细胞的细胞周期结果显示:姜黄素在较低剂量(5、10μmol·L-1)对细胞周期的影响不显著;然而,在20、30、60μmol·L-1的剂量下姜黄素对细胞周期的分布有显著的作用。初步的研究发现姜黄素能让细胞周期停留在G2/M期(图3)。进一步用荧光显微镜观察细胞经姜黄素处理后是否有细胞周期停顿的现象。结果显示:姜黄素(30μmol·L-1)会造成SCC-4癌细胞的细胞支架中的alpha-tubulin产生聚集的现象,这会造成细胞分裂产生障碍,因而造成细胞周期停顿(图4)。因此,课题组以能够抑制SCC-4癌细胞增殖与侵袭的而且不会对正常细胞造成明显的毒性作用的有效浓度(30μmol·L-1和60μmol·L-1)来进行基因芯片微陈列分析。

图2 在不同浓度姜黄素的作用下SCC-4细胞的侵袭能力Fig 2 Cell invasion of SCC-4 cells in different doses of curcumin
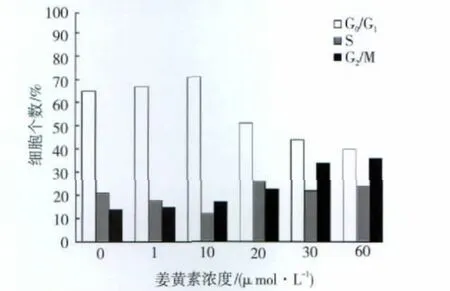
图3 在不同浓度姜黄素的作用下SCC-4细胞的周期Fig 3 Cell cycle of SCC-4 cells in different doses of curcumin
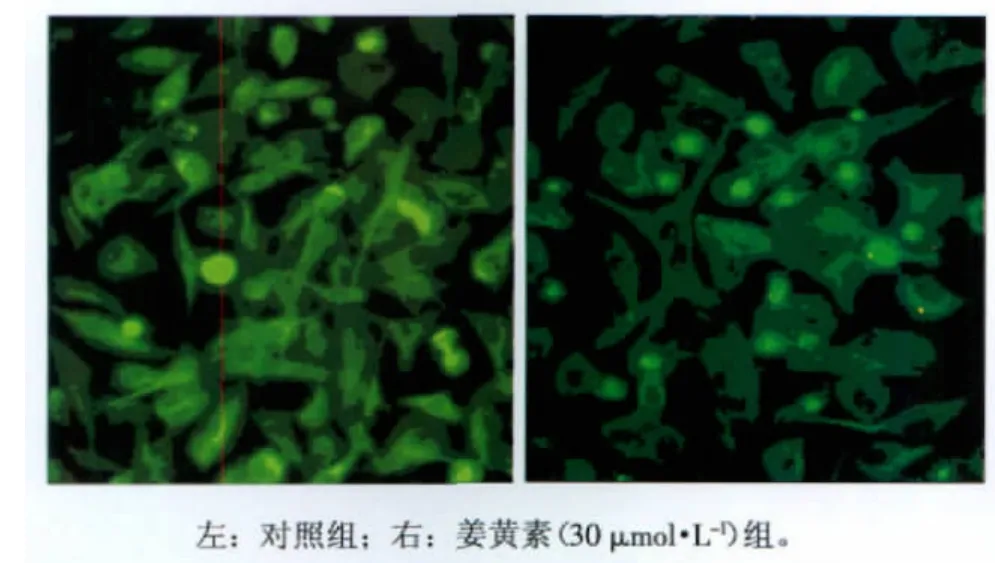
图4 姜黄素(30μmol·L-1)使SCC-4癌细胞的细胞支架中的alphatubulin产生聚集的现象 荧光显微镜 ×400Fig 4 The immunostaining indicated that alpha-tubulin was accumulated and might be aggregated in cell nuclus following curcumin treatment(30μmol·L-1) fluorescence microscope ×400
2.2 基因芯片微陈列分析差异基因频谱
从前期的实验中挑选2个浓度30μmol·L-1和 60μmol·L-1来做微陈列分析。结果显示:有87个基因可被姜黄素诱导增加;相比之下,有198个基因的表现受姜黄素抑制。这些受调控的基因,包括有调控细胞周期、细胞表面抗原、细胞附着性蛋白、DNA合成、修复,重组蛋白质、生长因子、细胞因子、激素受体,细胞内信息传导调节因子、离子通道,与代谢途径相关的蛋白、细胞凋亡相关基因、引发炎症反应的蛋白、胞外基质蛋白质及EST(expressed sequence tags)基因。
2.3 实时定量RT-PCR验证cDNA微陈列分析结果
从cDNA微陈列分析的数据中发现,一些受姜黄素调控的基因,可能与其抑制癌细胞生长或与转移相关。于是从中选取其中10个基因(包括:cdc27、crystalline beta1、crystalline gamma、EGFR substrate 15、H2A histone、neurnal pentaxin、PG-EP synthase 2、PPAR-alpha、stromelysin-3和trypsinase IA),进一步采用实时定量RT-PCR来验证其在RNA水平上的表达,测其基因表现是否符合cDNA微陈列分析的结果。结果显示,实时定量RT-PCR和微陈列分析的结果相符,这同时也说明这些与癌细胞生长转移相关的基因受到了姜黄素的调控。
3 讨论
舌癌是口腔常见恶性肿瘤之一,易复发或/和发生转移,而且舌癌的初期临床症状多不明显,大部分患者在诊断时都可能已经发生浸润或转移。本课题组前期研究[5-6]表明:姜黄素具有预防及治疗口腔癌的潜力。本研究发现:姜黄素能降低SCC-4舌癌细胞的生长与侵袭能力,且此作用具有药物剂量相关性。经过cDNA微陈列分析后也发现:姜黄素抗舌癌细胞的增殖与侵袭的可能机制,为今后研究更多的抗癌药物提供实验依据。
实验研究表明:姜黄素可以抑制老鼠巴豆酯诱导的皮肤肿瘤。在仓鼠的动物实验[7]中亦发现:二甲基苯并蒽所引起的口腔上皮细胞癌变被姜黄素抑制。过去研究已显示:姜黄素除了具有抗癌细胞增殖的效果,也具有抑制转移的能力[6]:浓度低于每千克体重200 nmol的姜黄素在人体内具有显著抑制癌细胞转移的能力,且证实其能减少80%肺肿瘤,提高患者的存活时间;在黑色素肿瘤细胞B16F-10中,以27.14μmol·L-1浓度姜黄素处理,具有显著抑制其侵袭Boyden小室基质的能力[4];在老鼠的实验中,发现其具有抑制血管新生的能力[4]。尽管癌转移研究报告相当多,但整个癌转移的机制相当复杂,目前的研究仍无法完全明了。因此分析癌细胞转移的相关基因,进而了解癌转移的机制仍然是目前癌症研究的重要课题。以往的研究[4-7]表明:姜黄素的作用机制主要是影响信号转录的因子达到上述的功能。姜黄素也具有抑制细胞周期的功能,并能通过调节c-myc、bcl-2来诱导细胞凋亡的产生。在肺癌细胞中的研究指出,姜黄素抗肺癌主要是使NCAM、TOPO-I、TOPO-II、AXL tyrosinase表达降低,并抑制NF-kappa B转录活性,从而抑制癌细胞的增殖与转移,以往在口腔癌的相关研究[3-4]中发现:姜黄素的抗癌机制可能受多因素的调控,其中包括抗细胞增殖、抑制血管新生、抗氧化作用等。其调控的机制除了通过使转录因子表达下降来达到抗癌效果,还可以抑制酪氨酸激酶受体的活性[4]。
本研究以基因微陈列芯片和定量RT-PCR的技术证明,姜黄素可能通过调控一些与细胞增殖和转移相关的基因(cdc27、crystalline beta1、crystalline gamma、EGFR substrate 15、H2A histone、neurnal pentaxin、PG-EP synthase 2、 PPAR-alpha、stromelysin-3和trypsinase IA)来达到抗癌效果。在这些受姜黄素调控的基因中,cdc27、EGFR substrate 15、PPAR-alpha和H2A histone与细胞生长息息相关,cdc27主要位于细胞中心体附近,具有增殖细胞核抗原依赖聚合酶活性,将细胞中的cdc27去除会造成细胞生长停止在细胞周期的分裂期,这与本研究观察到姜黄素会使SCC-4舌癌细胞停滞在G2/M期的结果是相符合的。近年来的研究[8]指出:H2A histone的磷酸化参与了细胞周期的M期,并与细胞分裂过程中染色体相关。其他研究[9]也显示:PPARalpha、crystalline、pentaxin与stromelysin-3等都参与了细胞在G2/M期中细胞周期,并发现这些因子与一些癌症有着密切的关系。本实验显示:这些基因受姜黄素的抑制,表明可能与姜黄素对口腔舌癌的抗癌作用有关。此外,一些参与细胞移动(包括细胞内骨架和细胞外蛋白水解酵素)相关的基因stromelysin-3、pentaxin和trypsinase IA也会被姜黄素所抑制。其中,stromelysin-3又称为基质金属蛋白酶-11(matrix metalloproteinase-11,MMP-11),其为癌细胞分泌的能降解癌细胞附近的基质蛋白,有助于癌细胞转移的重要分子;MMP-11与其他的MMP家族(至少包括MMP-2、-7、-9、-10)发现与癌症生成和预后相关;目前被视为治疗癌症和阻止癌细胞扩散转移的新药治疗目标[10]。
姜黄素抑制口腔舌癌的机制可能是使cdc27、EGFR substrate 15、PPAR-alpha和H2A histone表达水平降低,从而使细胞停留在细胞周期的M期,从而达到抗舌癌细胞增殖的作用;此外,姜黄素也会通过抑制MMP-11、pentaxin和trypsinase IA基因表达水平,从而抑制癌细胞的侵袭能力,达到抗转移的作用,但舌癌发生及转移的机制是相当复杂的,是多基因参与多步骤的过程,还需不断深入广泛地研究。希望此研究对研究开发抗口腔癌新药有一定的意义,以基因芯片进行药物作用机制研究,并建立药物筛选平台,可作为今后研究其他中草药抗癌作用的参考。
[1] Schleuning AJ 2nd,Summers GW.Carcinoma of the tongue:Review of 220 cases[J].Laryngoscope,1972,82(8):1446-1454.
[2] Bagan J,Sarrion G,Jimenez Y.Oral cancer:Clinical features[J]. Oral Oncol,2010,46(6):414-417.
[3] Aggarwal BB,Kumar A,Bharti AC.Anticancer potential of curcumin:Preclinical and clinical studies[J].Anticancer Res,2003, 23(1A):363-398.
[4] Bar-Sela G,Epelbaum R,Schaffer M.Curcumin as an anticancer agent:Review of the gap between basic and clinical applications [J].Curr Med Chem,2010,17(3):190-197.
[5] Li N,Chen X,Liao J,et al.Inhibition of 7,12-dimethylbenz[a] anthracene(DMBA)-induced oral carcinogenesis in hamsters by tea and curcumin[J].Carcinogenesis,2002,23(8):1307-1313.
[6] Lin YC,Chen HW,Kuo YC,et al.Therapeutic efficacy evaluation of curcumin on human oral squamous cell carcinoma xenograft using multimodalities of molecular imaging[J].Am J Chin Med,2010,38(2):343-358.
[7] Huang MT,Newmark HL,Frenkel K.Inhibitory effects of curcumin on tumorigenesis in mice[J].J Cell Biochem Suppl,1997,27:26-34.
[8] Ichijima Y,Sakasai R,Okita N,et al.Phosphorylation of histone H2AX at M phase in human cells without DNA damage response [J].Biochem Biophys Res Commun,2005,336(3):807-812.
[9] Schweitzer A,Knauer SK,Stauber RH.Nuclear receptors in head and neck cancer:Current knowledge and perspectives[J].Int J Cancer,2010,126(4):801-809.
[10]Kessenbrock K,Plaks V,Werb Z.Matrix metalloproteinases:Regulators of the tumor microenvironment[J].Cell,2010,141(1):52-67.
(本文编辑 胡兴戎)
Anti-proliferative and anti-metastatic effects of curcum in on oral cancer cells
CHEN Jiao-wen,TANG Yaling,LIU Hong,ZHU Zhi-yu,LÜDi,GENG Ning,CHEN Yu.(State Key Laboratory of Oral Diseases,Sichuan University,Chengdu610041,China)
ObjectiveThe purpose of this article is to examine the effect of curcumin on the proliferation and metastasis of human tongue squamous cell carcinoma and analyze its mechanism.MethodsSCC-4 were treated with curcumin of 0,5,10,20,30,60,100μmol·L-1in 24 h.MTT assay,Matrigel invasion assay,flow cytometry and fluorescence microscopy were used to examine the effect of curcumin on the growth and metastasis of SCC-4.cDNA microarray and RT-PCR were employed to analyze the expression of genes treated by curcumin.Results The results showed that curcumin could concentration-dependently inhibit SCC-4 cell proliferation at the concentration range from 20 to 100μmol·L-1.Furthermore,Matrigel invasion assay indicated that curcumin can reduce SCC-4 cell invasion under the dosage of 20,30,60μmol·L-1.Flow cytometry also showed that curcumin can influence the distribution of cell cycle of SCC-4 cell with the dosage of 20,30,60μmol·L-1.And the dosage of 30μmol·L-1curcumin could lead to the recruitment of alpha-tubulin.cDNA microarray showed that 87 genes were activated and 198 genes were inhibited with the effect of curcumin.These results were validated by the real time quantitative RT-PCR.ConclusionAccording to the results,it suggests that curcumin has the potential as the leading compound for anti-cancer proliferation and invasion in oral cancer treatment,and cdc27,EGFR substrate 15,PPAR-alpha and H2A histone may play an important role among this multiple anticancer-targeting ability.
tongue cancer; curcumin; proliferation; metastasis
R 739.86
A
10.3969/j.issn.1000-1182.2011.01.020
1000-1182(2011)01-0083-04
2010-09-10;
2010-11-20
高等学校博士点学科专项科研基金资助项目(20090181-110059)
陈教文(1969—),男,2007级台湾籍博士研究生
陈宇,Tel:028-85501465

