大肠埃希菌生物被膜体外模型的建立及其应用*
陈朝喜,朱恒乾,廖晓萍,刘雅红*
(1.华南农业大学兽医学院,广东广州510642;2.西南民族大学生命科学与技术学院,四川成都610041)
大肠埃希菌是一种重要的人兽共患病病原,研究发现大肠埃希菌能够形成生物被膜来抵抗外界环境条件的改变,从而造成致病力的增强[1-3]。此外,生物被膜作为大肠埃希菌的毒力因子之一,在抗生素压力下常常引起持续性感染的迁延不愈[4-6]。本研究通过优化大肠埃希菌生物被膜体外模型,为研究大肠埃希菌生物被膜的耐药机制提供基础性的理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 249株大肠埃希菌分离自广东省畜禽养殖场和宠物医院患病或死亡动物的粪便、肠道内容物和脏器。标准株ATCC25922由华南农业大学兽医药理学实验室保存。
1.1.2 培养基、仪器和化学试剂 麦康凯琼脂培养基、MH肉汤、LB肉汤、蛋白胨大豆肉汤(TSB)、葡萄糖,为广州环凯生物科技有限公司产品,结晶紫染色和快速银染法试剂为广州化学试剂厂产品,色氨酸定量试剂为Pharmacia公司产品,胎牛血清为Hyclone公司产品;扫描电子显微镜及样品处理试剂均由华南农业大学测试中心提供。
1.2 方法
1.2.1 ATCC25922生物被膜形成试验 参照文献[7-8]的方法进行。每株菌接种4孔,同时做3次重复,根据OD570/ODC比值确定其成膜能力表型。
1.2.2 快速银染法及扫描电镜鉴定大肠埃希菌生物被膜 参照李乃静和何平等[9-10]的方法对生物被膜进行快速银染鉴定。扫描电镜样品制备及图像处理参照Glowacki R等方法进行[11],同时用灭菌硅胶片作空白对照。
1.2.3 细菌接种量对生物被膜形成的影响 取过夜培养的ATCC25922标准菌株菌液用TSB肉汤将菌液10倍比稀释(10—1,10—2,10—3,10—4,10—5),分别取100 μ L稀释菌液接种于48孔细胞培养板中,每个稀释度的菌液接种4孔,然后每孔补加TSB肉汤至1 mL。37℃培养24 h后按照1.2.1进行分析统计。
1.2.4 培养条件对生物被膜形成的影响 分别将不同的组分按比例添加至TSB肉汤中,比较在TSB(弱碱性)(1组),TSB+50 mL/L胎牛血清(2组),TSB+10 g/L葡萄糖(3组),TSB(高渗透压)(4组),LB(5组),MH(6组),TSB(厌氧)(7组)以及TSB肉汤(8组)等培养条件下ATCC25922 OD570的变化。
1.2.5 色氨酸定量试验 参考文献[12-13]的方法,分析不同培养条件下大肠埃希菌生物被膜胞外多糖蛋白复合物的含量变化。
1.2.6 大肠埃希菌浮游菌和生物被膜菌生长曲线的绘制 挑取ATCC25922单菌落接种TSB肉汤,置37℃培养箱中培养,分别在0、2、4、8、12、16、24 h取样,采用平板计数法计算菌落总数,每个时间点3个重复,绘制浮游菌生长曲线。生物被膜菌生长曲线的绘制按照优化的体外模型条件进行,分别在第0、8、16、24、48、72、96、120、144、168 h时间点取3块硅胶片,生理盐水充分冲洗后放入加有1 mL MH肉汤的小试管内,150 W超声水浴震荡15 min~20 min,在4℃以6 000 r/min离心30 min,弃上清,用0.05 mol/L、pH 7.0的PBS调整菌液浓度,采用平板菌落计数法计数,每个时间点3个重复。
1.2.7 大肠埃希菌生物被膜菌体外模型的应用根据1.2.1~1.2.4中优化的模型条件对249株临床分离大肠埃希菌进行生物被膜鉴定,结合文献[14]的方法进行成膜能力表型分析,以验证大肠埃希菌生物被膜体外模型的适用性。
2 结果
2.1 大肠埃希菌的生物被膜快速银染及扫描电镜观察
大肠埃希菌生物被膜是一种完全不同于浮游菌、有组织的特殊生理结构(图1)。

图1 培养7 d的空白对照,银染照片(400×)和扫描电镜照片(6 400×)Fig.1 Negative control,silver staining picture(400×)and scanning electron microscope picture(6 400×)of E.coli on 7thday
2.2 细菌接种量对ATCC25922生物被膜形成的影响
从图2可以看出,细菌接种量对大肠埃希菌生物被膜生物量的变化影响不明显(P>0.05)。

图2 细菌接种量对ATCC25922生物被膜形成的影响Fig.2 Effect of different inoculum on ATCC25922 biofilm formation
2.3 培养条件对大肠埃希菌生物被膜形成和胞外多糖分泌量的影响
在不同培养条件下,各种条件均会对大肠埃希菌生物被膜的形成和胞外多糖的分泌量造成不同程度的影响(图3和图4),表明在生物被膜的形成过程中,受到各种培养条件的制约。
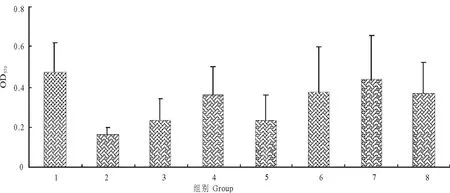
图3 不同培养条件对ATCC25922生物被膜形成的影响Fig.3 Effect of different culture conditions on ATCC25922 biofilm formation
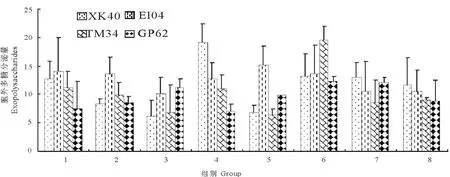
图4 培养条件对不同成膜能力大肠埃希菌胞外多糖分泌量的影响Fig.4 Effect of culture conditions on exopolysaccharide secretion in different biofilm phenotype E.coli
2.4 浮游菌和BBF生长曲线的绘制
大肠埃希菌浮游菌在大约4 h开始进入对数生长期,约延续至12 h,之后进入稳定期。而大肠埃希菌生物被膜菌有两个对数增长期,其中第1个对数生长期对应于生物被膜形成的黏附期,在此阶段浮游菌黏附到硅胶片表面;在72 h~120 h进入第2个对数生长期,在此阶段生物被膜中的活菌数又开始快速增长(图5),胞外基质的分泌量逐渐增多,直至第7天成熟的生物被膜形成,具有海绵状等多形态的特殊生理结构。
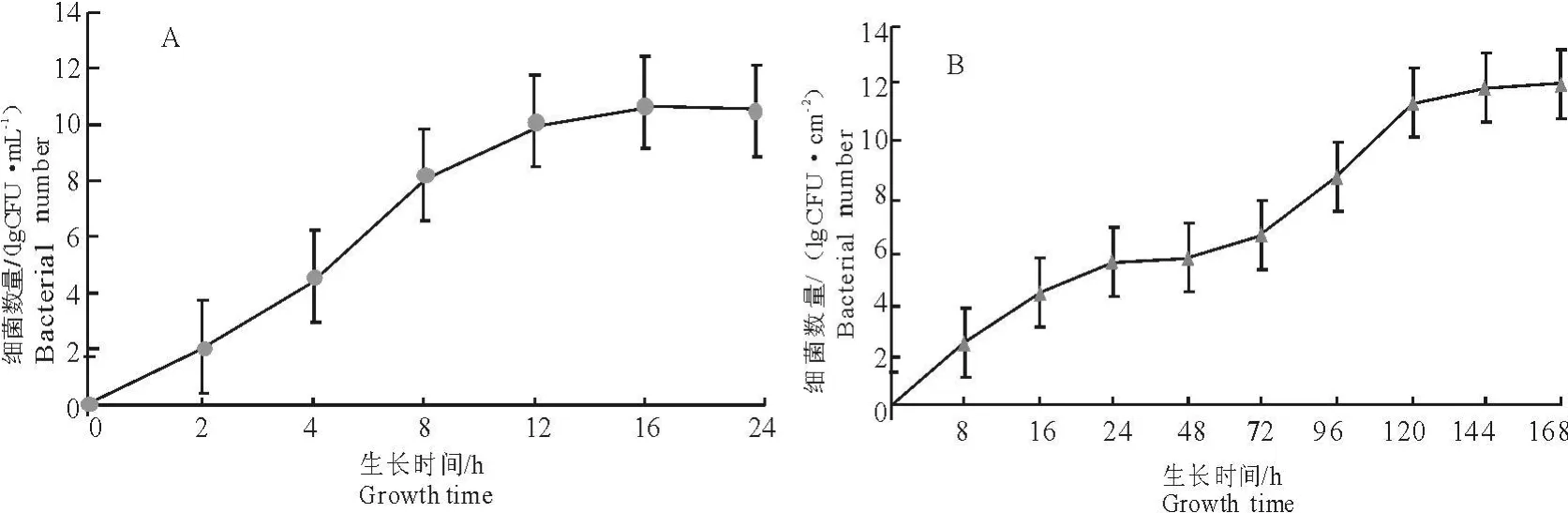
图5 ATCC25922浮游菌(A)和生物被膜菌(B)生长曲线Fig.5 Growth curves of A TCC25922 planktonic bacteria(A)and biofilm bacteria(B)
2.5 不同来源大肠埃希菌生物被膜表型能力的鉴定结果
从249株临床分离的大肠埃希菌生物被膜表型能力的散点图可以看出(图6),其成膜能力主要分布在中等和弱成膜能力两种表型(OD570/ODC集中在2.0~4.0之间),而强成膜能力(OD570>4ODC)和无成膜能力(OD570<ODC)表型的菌株所占比例较小,与国外对水环境中大肠埃希菌成膜能力的表型研究的报道一致[15]。

图6 249株临床分离的大肠埃希菌生物被膜表型能力的散点图Fig.6 Scatterplot of 249 clinical E.coli isolates in different biofilm phenoty pe
3 讨论
3.1 改良结晶紫染色方法对生物被膜表型能力的鉴定分析
试验结果表明,所采用的微量组织培养板法能够对试验菌株的生物被膜形成能力进行准确测定,消除在判定成膜能力过程中的主观性。Rodrigues L B等[16]研究结果表明,在微孔板定量方法中,采用的增加冰乙酸的脱色步骤能够有效的对黏附在孔底和孔壁的染料进行脱色,避免在孔的气液界面的干扰,实现对生物被膜形成能力进行较为全面和准确的定性和定量研究。根据优化的模型条件能够将249株临床分离菌分为没有黏附能力(—)、弱黏附能力(+)、中等黏附能力(++)和强黏附能力(+++)4种表型。
3.2 快速银染法鉴定细菌生物被膜
试验结果表明,在快速银染的过程中,生物被膜经氯化钙饱和溶液处理后,清洗时间对硝酸银着色影响较大。清洗的时间过短,不能够将硅胶片上过多黏附的氯化钙去除,这样在加入硝酸银后,会在硅胶片的表面形成较多的白色沉淀,对硫代硫酸钠透明处理过程中都会造成硅胶片上的生物被膜基质大量脱落。清洗时间延长会造成实际银染的胞外基质的量减小,不能较好的反映生物被膜中包外基质的相对量。
3.3 脱膜时间对生物被膜菌的影响
在不同生长阶段,生物被膜外层藻酸盐的厚度及紧密程度完全不同,其中的被膜菌对外界环境条件的抵抗能力也不一样,因此超声波脱膜时一定要考虑超声波强度和超声时间对生物被膜细菌的影响。本研究的脱膜条件能够有效的将生物被膜完全从硅胶片上脱离下来,并且将生物被膜中的细菌最大程度地释放出来,对保证生物被膜菌计数的准确性非常重要。
3.4 培养周期内不同生物被膜表型胞外基质分泌量的变化规律
同一株细菌在生长周期的不同阶段,其胞外基质的分泌量也表现出一定的规律性:第1天,根据大肠埃希菌胞外基质的分泌量不同将其初步分为不同的表型。随着培养时间的延长,不同表型的大肠埃希菌胞外基质的分泌量也逐步增加,但不同表型的大肠埃希菌的包外基质增加的幅度不同。在生物被膜达到成熟阶段后(7 d),各表型的大肠埃希菌的胞外基质分泌量也表现出相对稳定。
[1] Ito A,T aniuchi A,May T,et al.Increased antibiotic resistance of Escherichia coli in mature biofilms[J].Appl Environ Microbiol,2009,75(12):4093-4100.
[2] Suman E,Jose J,Varg hese S,et al.Study of biofilm production in Escherichia coli causing urinary tract infection[J].Indian J M ed Microbiol,2007,25(3):305-306.
[3] Lewis K.Multidrug tolerance of biofilms and persister cells[J].Curr T op Microbiol Immunol,2008,322:107-131.
[4] Rijavec M,Müller-Premru M,Zakotnik B,et al.Virulence factors and biofilm production among Escherichia coli strains causing bacteraemia of urinary tract origin[J].J Med Microbiol,2008,57(11):1329-1334.
[5] 成大荣,黄维嘉,张迎春,等.不同毒力基因型大肠杆菌的毒力测定[J].动物医学进展,2005,26(12):78-80.
[6] 刘 华,祁克宗,涂 健,等.鸡源致病性大肠埃希菌菌毛基因研究进展[J].动物医学进展,2006,27(5):16-19.
[7] Stepanovic S,Cirkovic I,Ranin L,et al.Biofilm formation by Salmonella spp.and Listeria monocytogenes on plastic surface[J].Let Appl Microbiol,2004,38:428-432.
[8] Peeters E,Nelis H J,Coenye T.Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates[J].J Microbiol Methods,2008,72(2):157-165.
[9] 李乃静,李胜岐,何 平,等.银染法鉴定细菌生物被膜[J].辽宁药物与临床,2003,6(1):37-38.
[10] Cai Y,Wang R,An M M,et al.Iron-depletion prevents biofilm formation in Pseudomonas aeruginosa through twitching motility and quorum sensing[J].Braz J Microbiol,2010,41(1):37-41.
[11] Glowacki R,Strek P,Zagórska-Swiezy K,et al.Biofilm from patients with chronic rhinosinusitis morphological studies[J].Otolaryngologia Polska,2008,62(3):305-310.
[12] 方向群,刘又宁,陈 迁,等.阿奇霉素对生物被膜的抑制及对氟罗沙星的增效作用[J].中华结核和呼吸杂志,1998,21(9):538-540.
[13] Dall L,Herndon B.Quantitative assay of glycocaly x produced by viridans group streptococci that cause endocarditis[J].J Clin Microbiol,1989,27(9):2039-2041.
[14] Yue Q,Andrew J D,Taghrid S I,et al.Antibiotic susceptibility of coagulase-negative staphylococci isolated from very low birth weight babies:comprehensive comparisons of bacteria at different stages of biofilm formation[J].Ann Clin Microbiol Antimicrob,2010,9:16.
[15] Park J C,Lee J C,Oh J Y,et al.Antibiotic selective pressure for the maintenance of antibiotic resistant genes in colifo rm bacteria isolated from the aquatic environment[J].Water Sci Technol,2003,47(3):249-253.
[16] Rodrigues L B,dos Santos1 L R,Tagliari1 V Z,et al.Quantification of biofilm production on polysty rene byListeria,Escherichia coli and Staphy lococcus aureusisolated from a poultry slaughterhouse[J].Braz J Microbiol,2010,41(4):1082-1085.