2005年—2010年我国部分地区PRRSV流行毒株的遗传变异分析*
范培虎,危艳武,郭龙军,吴洪丽,黄立平,刘长明
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/猪传染病研究室,黑龙江哈尔滨150001)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)也称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(PRRSV)引起的,以妊娠母猪死产、流产、弱仔、木乃伊胎等繁殖障碍以及各生长阶段猪的呼吸道症状和高死亡率为特征的传染病[1]。该病首次在1987年发生于美国。郭宝清等[2]在我国首次分离到PRRSV CH-1a株。2006年在我国南方地区暴发了由PRRSV突变株引起的高致病性高死亡率的PRRS[3-5],造成了严重的危害。PRRSV为尼多病毒目、动脉炎病毒科、动脉炎病毒属。PRRSV病毒颗粒是由脂质双分子层包裹的核衣壳的球形粒子[6],直径为45 nm~80 nm,基因组为单股、正链RNA,长15.4 kb左右,含有9个相互重叠的开放阅读框(ORFs),从5′端到3′端依次为ORF1a、ORF1b、ORF2a、ORF2b和ORF3-7,ORF1a和ORF1b编码PRRSV的RNA复制酶和聚合酶,其余的ORF2a、ORF2b、ORF3、ORF4、ORF5、ORF6、ORF7依次编码GP2、E、GP3、GP4、GP5、基质蛋白M和核衣壳蛋白N[7]。M和GP5以二硫键连接的异源二聚体形式存在,是病毒的主要结构蛋白,占病毒蛋白总量的50%以上[8],该二聚体能跟唾液酸粘附素的N端结合,在病毒进入细胞的过程中发挥着重要作用[9]。GP2和GP4与CD163分子SRCR的第5功能区共同参与病毒被内吞到细胞后基因组的释放过程[10-11]。2006年我国南方暴发猪“高热病”严重疫情,给我国养猪业造成了巨大经济损失[12-13]。经病原学研究证实由高致病性PRRSV变异株引起的,与经典的PRRSV毒株在NSP2基因有90个碱基的缺失。GP5为病毒的囊膜糖蛋白,是能够诱导机体产生保护性免疫的靶抗原,鉴于GP5在病毒感染与免疫过程中起到重要作用,在病毒分子遗传变异分析中也将ORF5序列作为基因分型依据。安同庆等[14]研究表明,近年国内PRRSV流行毒株变异较大,可分为2个亚群,亚群1的中和表位高度变异,亚群2的中和表位相对保守。本研究采用RT-PCR法对我国不同地区病料进行PRRSV检测,选择有代表性9份阳性样品进行ORF5~7基因扩增和测序,与GenBank下载的PRRSV序列进行遗传变异分析,为探讨我国PRRS发生规律提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品来源 来自我国13个省(市区)发病猪的腹股沟淋巴结、肝、脾、肾、肺、脑、流产胎儿等脏器组织共282份,采集样品的地区、时间和各自的数量为:黑龙江2005年—2010年间102份,吉林2005年—2009年55份,辽宁2005年28份,河北2005年—2007年13份,内蒙古2005年—2008年10份,山东2007年12份,北京2009年18份,湖南2006年—2009年22份,上海2006年12份,安徽2008年8份,浙江2005年1份,湖北2005年1份。
1.1.2 主要试剂 提取总RNA用TRIzol,BioFlux公司产品;One Step RT-PCR Kit,宝生物工程(大连)有限公司产品;Cycle-Pure Kit,OMEGA公司产品。
1.1.3 引物设计 根据GenBank上发表的PRRSV基因序列(AY032626;AY262352),用Oligo6.0软件设计引物,由宝生物工程(大连)有限公司合成(表1)。
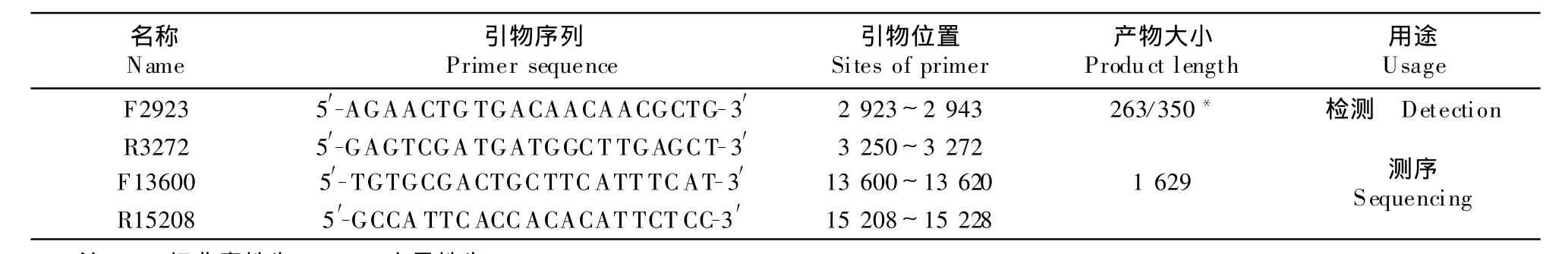
表1 引物序列Table 1 Primer sequences
1.1.4 GenBank下载的其他分离毒株的情况 从GenBank中提取了绝大部分来自我国的GP5基因序列27株,其地理分布和分离时间见表2。
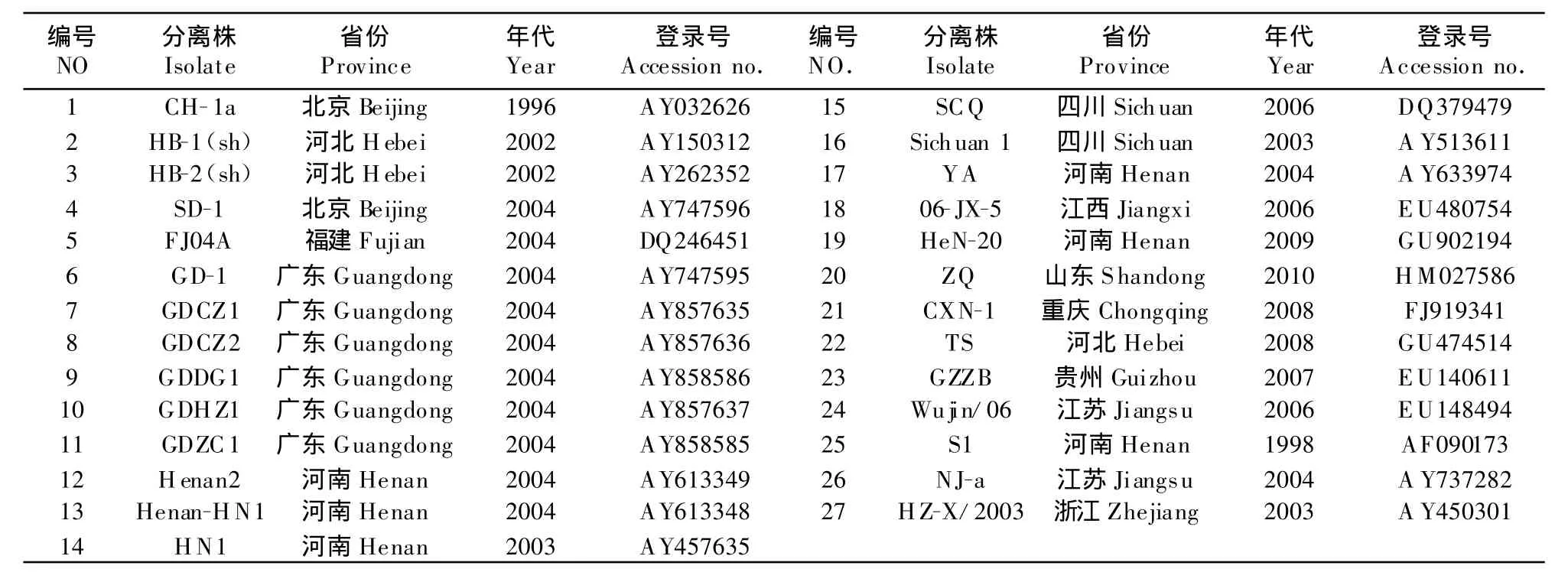
表2 我国其他PRRSV分离毒株序列Table 2 The sequences of other PRRSV isolates in China
1.2 方法
1.2.1 RNA提取和RT-PCR检测 用T RIzol法提取病料中的总RNA。One Step RT-PCR Kit对病料总RNA进行扩增。反应体系为(25 μ L):Rnase Free ddH2O 10.5 μ L,MgCl2(5 mol/L)5 μ L,dNTP Mixture:2.5 μ L,10×One Step RNA PCR buffer 2.5 μ L,引物(20 pmol/L)F2923 0.5 μ L,R3272 0.5 μ L,AMV Reverse T ranscriptase XL 0.5 μ L,AMV-Optimized Taq 0.5 μ L,Ranse Inhibitor 0.5 μ L,模板2 μ L。反应条件为:50℃30 min,94℃2 min。94℃30 s,58℃30 s,72℃45 s,共40个循环;72℃延长10 min。15 g/L凝胶电泳,150 V,25 min。
1.2.2 基因的扩增和序列的测定 以总RNA为模板,用RT-PCR扩增ORF5~7基因。反应体系为(25 μ L):RNase Free ddH2O 10.5 μ L,MgCl2(5 mol/L)5 μ L,dNTP Mixture:2.5 μ L,10×One Step RNA PCR buffer 2.5 μ L,引物(20 pmol/L)F13600 0.5 μ L,R15208 0.5 μ L,AMV Reverse transcriptase XL 0.5 μ L,AMV-Optimized Taq 0.5 μ L,RNase inhibitor 0.5 μ L,模板2 μ L。反应条件为:50℃30 min,94℃2 min。然后,94℃30 s,55℃30 s,72℃2 min,共30个循环;72℃延长10 min。15 g/L凝胶电泳,150 V,25 min。PCR产物纯化按试剂盒说明书进行,纯化的PCR产物送北京六合华大基因科技有限公司进行基因测序。
1.2.3 序列分析 用DNA Star中的MegAlign软件对测序结果进行分析,用Gene Runner软件对所得序列进行糖基化位点的预测,与参考毒株和国内在GenBank下载的27株PRRSV进行同源性比较,绘制系统发育树。
2 结果
2.1 临床样品检测
来自13省(市、区)送检病料的282份进行PRRSV检测,有53份为PRRSV核酸阳性,阳性检出率为18.8%。用RT-PCR法对部分病料检测结果见图1,扩增产物为263 bp为变异毒株,所有检测的阳性样品均为变异毒株,未检出产物350 bp的经典毒株。
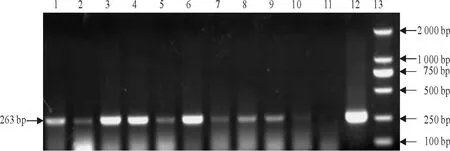
图1 RT-PCR法对我国部分地区送检病料PRRSV核酸检测Fig.1 Detection of PRRSV nucleic acid for samples from partial regions of China by RT-PCR
2.2 ORF5~7基因的扩增与鉴定
对9个PRRSV流行毒株的ORF5~7基因扩增结果见图2,扩增片段大小为1 629 bp,与预期结果一致。将这9个毒株分别命名为JLSY-08(吉林松源毒株2008年),HLJHRB-05(黑龙江哈尔滨毒株2005年),H LJMS-07(黑龙江佳木斯毒株2007年),LNCT-05(辽宁昌图毒株2005年),HN-06(湖南毒株2006年),BJCP-08(北京昌平毒株2008年),HBDZ-07(河北定州毒株2007年),HLJHRB-09(黑龙江哈尔滨毒株2009年),HLJMS-10(黑龙江佳木斯毒株2010年)。

图2 对9株PRRSV GP5~GP7基因RT-PCR扩增Fig.2 The amplification ORF5-7 gene of Nine PRRSV isolates by RT-PCR
2.3 ORF5序列比较
将9个流行毒株的ORF5基因序列及编码的氨基酸序列,9个毒株间的核苷酸序列同源性为95.0%~99.2%,氨基酸序列的同源性为92.0%~99.0%;这9个毒株与CH-1a、VR2332、HB-2和LV毒株的相应序列比较,核苷酸序列的同源性依次为93.4%~95.5%、87.6%~89.4%、91.2%~92.7%、63.0%~64.0%;氨基酸序列的同源性依次为91.0%~94.0%、85.6%~88.6%、89.6%~92.0%、54.7%~58.2%(表3)。

表3 对9株PRRSV ORF5核苷酸和氨基酸序列同源性比较Table 3 Alignment nucleotide and amino acid sequences of ORF5 gene of nine PRRSV isolates
2.4 ORF5遗传进化树的构建与分析
这9个流行毒株与下载的国内不同年代、地域的毒株比较,建立遗传进化树(图3),图中方框为本研究的9个毒株,黑圆点代表参考毒株,黑方块代表疫苗毒株。结果明显分为2个亚群(SG1和SG2),2个亚群之间的氨基酸同源性为89%,各亚群内毒株之间的氨基酸同源性达100%。有研究证实,SG1中毒株的中和表位变异程度较高[14]。本研究中的9个毒株均属于SG1,属于中和表位高变毒株。
2.5 GP5糖基化位点比较
对9个毒株GP5蛋白潜在糖基化位点与数目分析,5个糖基化位点有3株,4个糖基化位点有5株,3个糖基化位点有1株;糖基化位点分布在30位~55位点氨基酸之间,以44、55位点比较保守,其他3个位点变异幅度较大。有研究报道,GP5蛋白的糖基化与病毒毒力及中和抗体表位有关[8],表明我国流行的PRRSV毒株变异幅度较大,GP5糖基化位点不同可能与毒力存在一定的联系。糖基化位点分布统计结果见表4。
2.6 GP5蛋白抗原表位比较
用DNA Star中的MegAlign软件对PRRSV GP5抗原表位分析结果见图4,病毒中和表位37位~44位氨基酸中存在变异,9个流行毒株与CH-1a、VR2332、HB-2和LV株比较,中和表位39位的苯丙氨酸或亮氨酸变为异亮氨酸{(F/L)39→I39}。此外,有1株(LNCT-05)诱骗表位(27位~30位氨基酸)的28位的亮氨酸变为脯氨酸(L28→P28)。
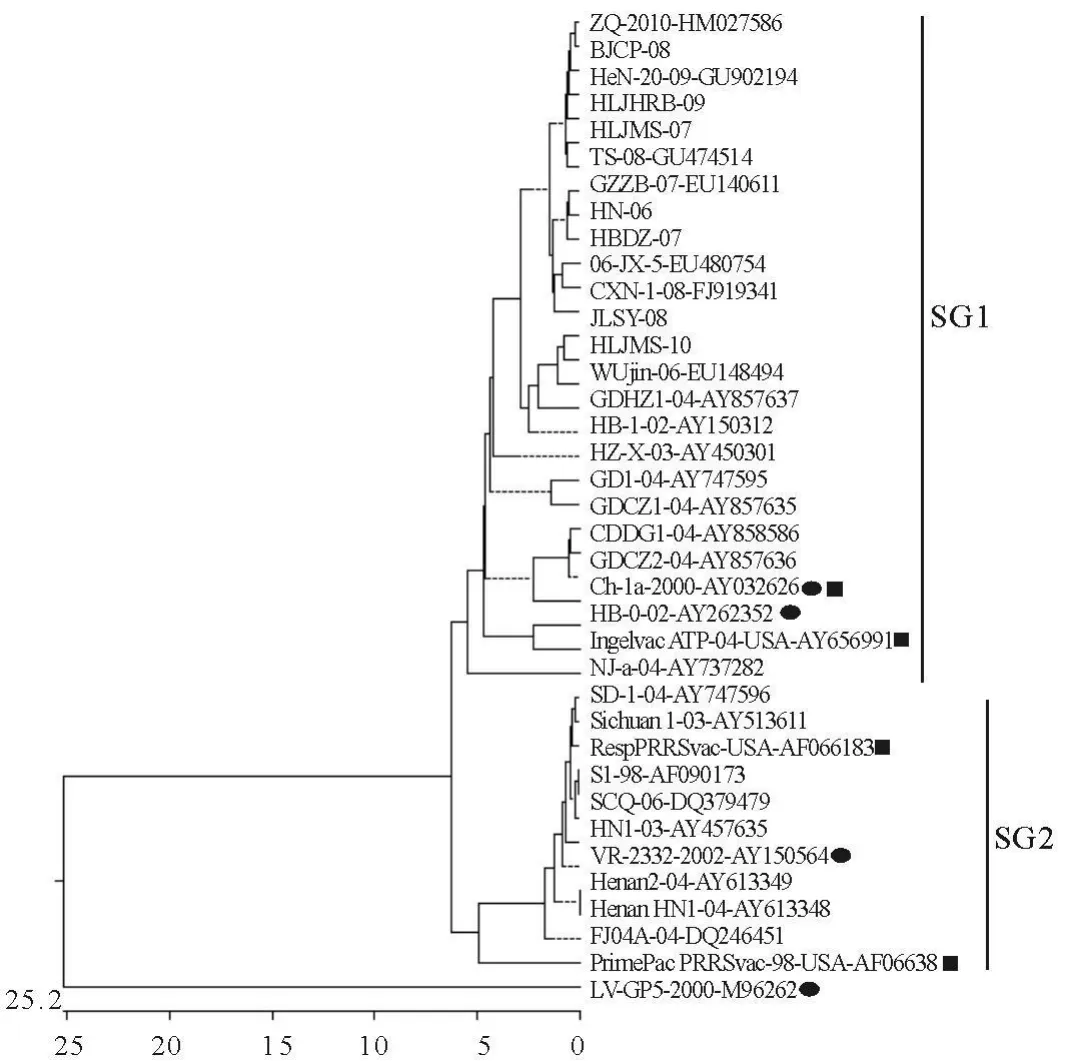
图3 9个PRRSV流行毒株与GenBank下载的其他毒株ORF5序列绘制的遗传进化树Fig.3 Phylogenetic tree of nine PRRSV isolates and other strains from GenBank based on ORF5 sequences

表4 9个PRRSV流行毒株GP5蛋白糖基化位点数目及分布Table 4 GP5 protein gly cosylation sites of nine P RSSV isolates
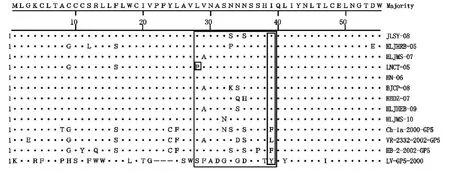
图4 9个PRRSV流行毒株与GenBank下载的参考毒株的GP5抗原表位预测分析Fig.4 Analysis and forecast of GP5 protein epitopes of nine PRRSV isolates and other strains from GenBank
3 讨论
自1996年郭宝清等首次在我国分离到PRRSV(Ch-1a)以来,几乎每年都有PRRS疫情出现,2006年我国南方江西、湖南、湖北等省暴发了高致病性猪蓝耳病,证明由PRRSV变异株引起的。有报道证实,暴发过PRRS的省份于2007年又发生了同样疫情,如湖南、北京、河北、广东、辽宁等[15],2010年吉林的部分猪场也有高致病性PRRSV的感染[16]。表明PRRSV具有高变异特性,能够逃避机体的免疫清除作用,使猪群长期带毒,呈持续性感染。
对2005年—2010年间9个PRRSV流行株ORF5基因进行了序列测定,与CH-1a、VR2332、HB-2、LV株的进行了同源性比较,这9个流行毒株ORF5变异明显,仍属于美洲型。9个流行毒株与CH-1a株同源更高,有可能为其演化而至。9个流行毒株的GP5蛋白糖基化位点以5、4、3模式,其中以5和4个位为主流。有研究证实,GP5蛋白的糖基化与病毒感染细胞的能力密切相关,将44位和51位天冬酰胺(N44和N51)突变后,病毒不再具有感染细胞的能力[17]。还有研究表明,N44糖链和其前一个N糖链之间正好是病毒的中和表位,由于存在空间位阻作用而影响中和抗体对中和表位的有效识别,从而降低了中和抗体的中和作用,使病毒逃避了机体的免疫保护[14]。相关研究指出,有些动物病毒的毒力随着其结构蛋白N糖基化位点的增多而增强,如马传染性贫血病毒、猴免疫缺陷病毒等[18-21]。9个流行毒株的GP5的潜在糖基化位点数目,与经典毒株有增加趋势,表明我国流行毒株的毒力较强。GP5糖基化位点集中在N44糖链的前面邻近区域,对中和抗体识别抗原表位增加了空间位阻,阻碍了中和抗体对病毒的中和作用,进而表现出病毒的毒力增强效应。
对9个流行毒株GP5蛋白氨基酸序列分析发现,这些毒株的病毒中和表位中,39位氨基酸均有变异[(F/L)39→I39],这一点与安同庆等[14]报道一致,说明病毒的中和表位存在着变异,有利于病毒逃避机体的免疫。在GP5蛋白中和表位37位~41位氨基酸序列[S37(F/L)QLIYN]上游存在一个诱骗表位[(A/V)27LVN],这个表位可诱导机体产生大量的非中和抗体,延迟中和抗体的产生,其延迟效应能达3周以上[22]。本研究中的LNCT-05流行毒株的诱骗表位28位氨基酸发生突变[L28→P28],这种变化使诱骗表位与中和表位之间增加了复杂性,可能更有利于病毒的逃逸,但仍需要试验证据。
这9个流行毒株的ORF5序列与我国其他分离毒株、以及2个国外参考毒株[VR2332、LV]和3个疫苗毒株的序列进行了比较,9个流行毒株都属于PRRSV美洲型基因I群。安同庆等[14]对1996年—2006年中国大陆的42个分离株的ORF5基因序列发现,各分离株基因变异较大,分别属于2个不同的亚群。9个流行毒株与国外的3个疫苗株关系较远,提示国外的疫苗免疫效果可能有限。
[1] Rossow K D.Porcine reproductive and respiratory syndrome[J].Vet Pathol,1998,35(1):1-20.
[2] 郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国预防兽医学报,1996(2):1-5.
[3] Li Y,Wang X,Bo K,et al.Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China[J].Vet J,2007,174(3):577-584.
[4] Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical P RRS in China and molecular dissection of the unique hallmark[J].PLoS One Jan 2007,2(6):e526.
[5] Zhou Y J,Hao X F,Tian Z J,et al.Highly virulent porcine reproductive and respiratory syndrome virus emerged in China[J].Transbound Emerg Dis,2008,55(3/4):152-164.
[6] Spilman M S,Welbon C,Nelson E,et al.Cryo-electron tomog raphy of porcine reproductive and respiratory syndrome virus:organization of the nucleocapsid[J].J Gen Virol,2009,90:527-535.
[7] Dea S,Gagnon C A,Mardassi H,et al.Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome(PRRS)virus:comparison of the North American and European isolates[J].Arch Virol,2000,145(4):659-688.
[8] Wissink E H J,Kroese M V,van Wijk H A R,et al.Envelope protein requirements for the assembly of infectious virions or porcine reproductive and respiratory syndrome virus[J].J Virol,2005,79:12495-12506.
[9] Van B W,Van G H,Zhang J Q,et al.The M/GP5 glycoprotein complex of porcine reproductive and respiratory syndrome virus binds the sialoadhesin receptor in a sialic acid-dependent manner[J].PLoS Pathog,2010,6(1):e1000730.
[10] Das P B,Dinh P X,Ansari I H,et al.The minor envelope gly coproteins GP2a and GP4 of porcine reproductive and respiratory syndrome virus interact with the receptor CD163[J].J Virol,2010,84:1731-1740.
[11] Van G H,Van B W,Van D J,et al.Identification of the CD163 protein domains involved in infection of the porcine reproductive and respiratory syndrome virus[J].J Virol,2010,84:3101-3105.
[12] 王仕荣,向 晖,吴健敏,等.广西“猪高热综合征”主要病原调查及PRRSV Nsp2基因变异分析[J].中国兽医学报,2009,29(3):249-253.
[13] 童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,9(5):323-326.
[14] An T Q,Zhou Y J,Liu G Q,et al.Genetic diversity and phylogenetic analysis of glycoprotein 5 of PRRSV isolates in mainland China from 1996 to 2006:Coexistence of two NA-subgenotypes with great diversity[J].Vet Microbiol,2007,123(1-3):43-52.
[15] 田克恭,侯丽丽,赵铁柱,等.高致病性猪繁殖与呼吸综合征病毒分子流行病学调查[J].中国兽医学报,2009,29(6):677-682.
[16] 闫东明,卢士英,任洪林,等.猪繁殖与呼吸综合征病毒流行株N sp2基因的克隆及序列分析[J].中国畜牧兽医,2010,37(9):48-51.
[17] Ansari I H,Kwon B J,Osorio F A,et al.Influence of N-linked gly cosylation of porcine reproductive and respiratory syndrome virus GP5 on virus infectivity,antigenicity,and ability to induce neutralizing antibodies[J].J Virol,2006,80:3994-4004.
[18] Payne S L,Qi X M,Shao H,et al.Disease induction by virus derived from molecular clones of equine infectious anemia virus[J].J Virol,1998,72:483-487.
[19] Ball J M,Swaggerty C L,Pei X,et al.Proteins from virulent and avirulent EIAV demonstrate distinct biological properties[J].Virology,2005,333(1):132-144.
[20] Marthas M L,Ramos R A,Lohman B L,et al.Viral determinants of simian immunodeficiency virus(SIV)virulence in rhesus macaques assessed by using attenuated and pathogenic molecular clones of SIVmac[J].J Virol,1993,67(10):6047-6055.
[21] Edmonson P,Murphey-Corb M,Martin L N,et al.Evolution of a simian immunodeficiency virus pathogen[J].J Virol,1998,72:405-415.
[22] Ostrowski M,Galeota J A,Jar A M,et al.Identification of neutralizing and nonneutralizing epitopes in the porcine reproductive and respiratory syndrome virus GP5 ectodomain[J].J Virol,2002,76(9):4241-4250.

