甲型H1N1流感病毒HA蛋白的截短表达、纯化及鉴定*
贾 园,沈 阳,邱亚峰,史子学,邵东华,王晓杜,邓绪芳,王皓婷,赵福广
(1.吉林农业大学,吉林长春130061;2.中国农业科学院上海兽医研究所,上海200241)
2009年春,墨西哥、美国等国家相继暴发甲型H1N1流感,并迅速蔓延至世界各地,形成流感大流行。甲型H1N1流感病毒是由猪、禽、人源流感病毒发生重配产生的新毒株,是一种新型流感病毒[1]。自1918年西班牙大流感暴发以来,H1N1亚型毒株引起的流感已有近百年的历史[2]。面对新型流感的大流行,目前主要的检测方法是分子生物学检测方法[3-5]。传统的RT-PCR其敏感性较差,很难无法区分季节性流感与甲型H1N1流感[6]。作为流行病学研究和疾病监测的重要手段,免疫学检测技术不可或缺。
甲型H1N1流感病毒属于正黏病毒科流感病毒属,是单股负链RNA病毒,基因组由8个RNA片段组成,共编码至少11种蛋白,其中血凝素(Hemagglutinin,HA)是最重要的表面抗原之一。HA的主要功能是与宿主细胞上的唾液酸受体结合,使病毒黏附于细胞,辅助病毒穿膜内吞[7]。人和禽源的流感病毒HA识别的唾液酸受体不同,这也是决定病毒跨种间传播的机制之一。HA还是流感病毒主要的毒力因子之一[8],是病毒的中和抗原。为了逃逸抗体的识别,HA经常发生变异,建立快速有效的检测流感病毒的方法是流感防控研究重点之一。
本研究通过pET表达系统在大肠埃希菌BL21(DE3)中表达甲型H 1N1流感病毒截短的HA蛋白,选择性地表达其胞外区,去掉其信号肽、跨膜区以及胞内区。重组蛋白经Ni-NTA His Bind resin纯化后,获得了较纯的His融合蛋白,为甲型H1N1流感诊断技术的建立奠定基础。
1 材料与方法
1.1 材料
根据GenBank发表的A/California/04/2009(H1N1)HA基因序列合成HA基因并克隆质粒中(pUC57-HA)。大肠埃希菌BL21(DE3)、pET-28(a)表达质粒由中国农业科学院上海兽医研究所兽医公共卫生实验室保存。DNA聚合酶、T4 DNA连接酶、限制性内切酶购自宝生物工程(大连)有限公司。质粒提取试剂盒购自天根生物,DNA胶回收试剂盒和少量DNA片段回收试剂盒购自博大泰克生物技术公司。Ni-NTA His Bind resin购自Novagen公司。Influenza A H1N1(Swine Flu 2009)Hemagglutinin Antibody购自北京义翘神州生物技术有限公司。His抗体购自上海中科英沐生物技术有限公司,辣根过氧化物酶(HRP)标记的羊抗鼠二抗购自Sigma公司。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank发表的A/California/04/2009(H1N1)HA基因序列,以去掉HA的信号肽、跨膜域和胞浆域的基因序列为模板,用Primer 5.0软件设计含有EcoRⅠ和XhoⅠ酶切位点的上、下游引物:
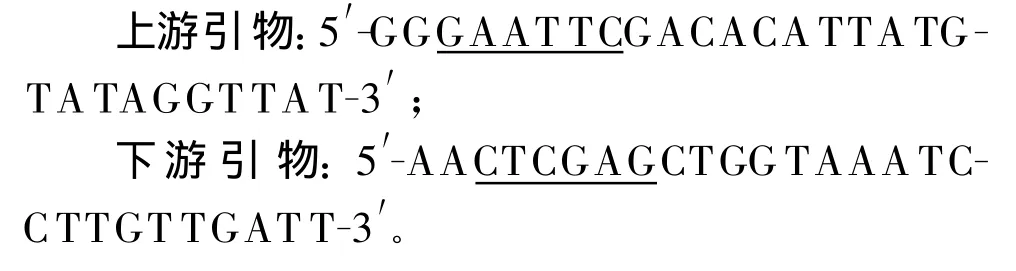
下划线序列为酶切位点。引物由上海invitrogen公司合成。
1.2.2 重组pET-28(a)-HA质粒的构建 以pUC57-HA为模板,PCR扩增,胶回收PCR产物和pET-28(a)质粒分别用EcoRⅠ和XhoⅠ双酶切消化,酶切产物用小片段DNA纯化回收试剂盒纯化。HA基因和pET-28(a)质粒在T4 DNA ligase的作用下,16℃连接过夜。将重组质粒转化感受态大肠埃希菌BL21,然后挑取单菌落克隆,进行酶切鉴定,并测序确认。
1.2.3 HA蛋白的诱导表达 取鉴定正确的阳性克隆按1∶100的比例转接,37℃摇菌3 h,加入终浓度为1 mmol/L的IPTG,分别于1、2、3、4、5、6 h取样,确定最佳诱导时间。在最佳诱导条件下大量诱导表达,收集菌体沉淀。10 mL细菌裂解缓冲液重悬,冰浴间歇超声破菌后离心,分别收集沉淀和上清液,取少量样品制样,经120 mL/L SDS-PAGE电泳及考马斯亮蓝染色,分析重组蛋白的表达形式。
1.2.4 重组蛋白的纯化 按照上述方法进行大量诱导表达重组蛋白,按照Ni-NTA His°Bind Resins产品使用说明纯化蛋白。SDS-PAGE观察纯化效果。纯化后的蛋白用碳酸盐缓冲液梯度透析复性。
1.2.5 Western blot检测重组蛋白的表达 重组蛋白经SDS-PAGE电泳后,在65 V电压下转膜2 h,封闭液室温封闭NC膜2 h,一抗(Influenza A/H1N1/2009病毒HA特异性抗体)孵育4℃过夜,TBST洗涤3次后,二抗孵育室温作用2 h,TBST洗涤3次后,加入显色底物显色,观察重组蛋白的免疫反应性。
2 结果
2.1 目的基因的克隆
HA基因全长1 701 bp,用特异性引物进行PCR扩增HA的部分片段52 bp~1 587 bp,除掉HA的信号肽、跨膜域和胞浆域)大小为1 536 bp,经1 0g/L琼脂糖凝胶电泳分析(图1),在约1 500 bp处可见特异性条带,大小与预期一致。
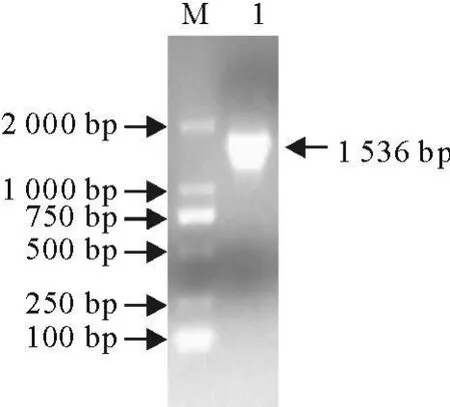
图1 HA基因的PCR扩增结果Fig.1 PCR products of HA gene
2.2 重组表达质粒的鉴定
提取pET-28(a)-HA质粒后,经EcoR和XhoⅠ酶切消化,结果发现(图2)HA基因被成功亚克隆到pET-28(a)上,同时送该阳性质粒到生物公司进行测序验证,结果表明和NCBI公布的序列100%一致。

图2 pET-28(a)-HA重组质粒双酶切鉴定Fig.2 Identification of recombinant plasmid pET28(a)-HA with enzy me digestion
2.3 表达产物的鉴定
选择不同诱导时间观察HA蛋白的表达情况。诱导1 h~6 h后,经120 mL/L SDS-PAGE电泳分析,HA蛋白获得大量表达。软件预测表明去掉信号肽、跨膜区和胞内区的HA蛋白大小为56 ku,如果加上标签蛋白,其大小约60 ku,我们的结果与理论值一致(图3)。
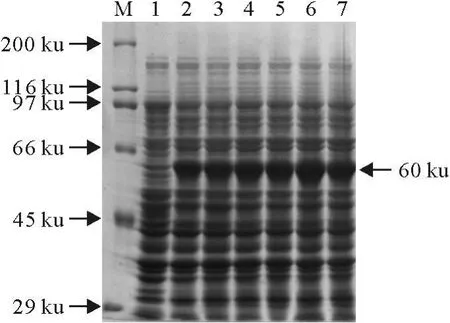
图3 HA重组蛋白的诱导表达Fig.3 Induced expression of HA recombinant protein by IPTG
2.4 HA蛋白的纯化
经超声破碎后取样,SDS-PAGE电泳分析表明,在上清与包涵体中均有表达,但包涵体中表达量更高,所以我们对包涵体通过Ni-NTA His Bind纯化,SDS-PAGE电泳分析表明(图4),我们获得了较高纯度的HA蛋白。
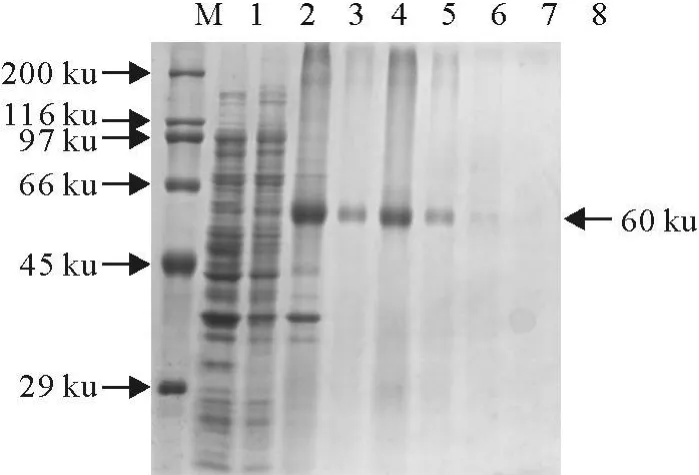
图4 HA重组蛋白的纯化Fig.4 The purification of HA protein
2.5 Western blot检测重组蛋白的表达
分别以Influenza A/H1N1/2009病毒HA特异性单抗和Anti-His的鼠单抗作为一抗,以H RP标记的山羊抗鼠IgG作为二抗,进行Western blot检测,结果如图5,两个单抗均能与约60 ku大小的条带反应,表明重组蛋白能被Influenza A/H1N1/2009病毒HA特异性单抗所识别,具有良好的抗原反应原性。

图5 Western blot分析重组蛋白HA的抗原反应原性Fig.5 Western blot analysis of the antigenic reactivity of recombinant HA
3 讨论
2009甲型H1N1流感大流行波及全世界几十个国家或地区,在全世界范围内引起了巨大的恐慌,世界卫生组织2010年8月宣布甲型流感大流行结束。2011年1月6日,据英国卫生防护局最新报道,英国自入冬以来已有50人死于流感,其中45人死于甲型H1N1(2009)流感病毒,5人死于乙型流感。建立甲型H1N1的血清学诊断技术,对于流感病毒的监测和检测起到非常重要的作用。
甲型流感病毒HA蛋白由RNA片段4编码,基因序列长度为1 742 bp~1 778 bp[9],编码562~566个氨基酸残基的蛋白,大小约为75 ku,它是一个被广泛修饰的糖蛋白。HA蛋白含有4个结构域:信号肽(前导序列)、胞外区、跨膜区和胞内区,本研究以A/California/04/2009(H1N1)的HA序列为模板,去掉HA的信号肽、跨膜区和胞内区,仅扩增只有1 536 bp大小的HA部分片段,编码512个氨基酸残基,预测蛋白大小约为57 ku。我们选择性地表达HA的胞外区蛋白,包括HA1和HA2两部分,二者以二硫键相连[10]。HA1是病毒主要的抗原决定区和受体结合位点,HA2与病毒囊膜与宿主细胞膜的融合有很大的关联,HA作为主要诱导中和抗体产生的抗原,在机体免疫反应中起重要的作用,所以我们选择该区段进行表达,为检测流感病毒抗体提供抗原。
本试验成功的构建了pET-28(a)-HA表达质粒,并通过大肠埃希菌BL21(DE3)成功表达了重组的HA蛋白,经Ni-NTA His Bind亲和层析纯化后,得到较高纯度的HA蛋白。Western blot结果显示,表达的重组蛋白与Influenza A/H1N1/2009病毒HA特异性单抗有良好的免疫反应性。因此,本研究制备的HA蛋白作为抗原,可以作为亚单位疫苗的候选,也为进行甲型H1N1诊断技术的开发奠定了基础。
[1] Center for Disease Control and Prevention.Update:infections with a swine-origin influenza A(H1N1)virus-United States and other countries,April 28,2009,MMWR Morb Mortal Wkly Rep,2009,58:431-3.
[2] World Health Organization,http://www.who.int/csr/don/2009_04_24/en/index.html
[3] Xiaocong Y,Tshidi T,Patricia A M,et al.Neutralizing antibodies derived from the B cells of 1918 influenza pandemic survivors[J].Nature,2008,455,532-536.
[4] 刘 明,赵海波,田永强.2009甲型H1N1流感病毒研究进展[J].生物技术通报,2010(7):41-43.
[5] 毕保良,李进涛.猪流感诊断技术研究进展[J].中国畜牧兽医,2009,36(10):179-183.
[6] 王方昆,王一成,袁秀芳.猪流感诊断方法研究进展[J].动物医学进展,2006,27(4):17-21
[7] Vasoo S,Stevens J,Singh K.Rapid antigen tests for diagnosis of pandemic(swine)influenza A/H1N1[J].Clin Infect Dis,2009,49:1090-1093.
[8] Hughson F.Structural characterization of viral fusion proteins[J].Curr Biol,1995,5(3):265-274.
[9] Deshpande K L,Fried V A,Ando M,et al.Glycosylation affects cleavage of an H5N2 influenza virus hemagglutinin and regulates virulence[J].Proc Natl Acad Sci U S A,1987,84(1):36-40.
[10] 骆建才,刘义志,尚辉琴.猪流感病毒H1N1广东分离株HA基因的克隆与进化分析[J].动物医学进展,2010,31(10):14-18.
[11] 余 华.猪流感病毒分子生物学研究进展[J].动物医学进展,2010,31(S):208-212.

