鸡源沙门菌的耐药性及脉冲场凝胶电泳分型研究
董剑辉,熊惠军,宋 立,陈 瑞
(1.华南农业大学兽医学院,广东广州510642;2.中国兽医药品监察所,北京100081)
沙门菌(Salmonella)是一群寄生于人和动物肠道内的无芽胞直杆菌,由其感染引发的沙门菌病是一种重要的人兽共患病[1],其中许多血清型菌能在人和动物之间交叉感染,对人类、畜禽饲养业造成巨大危害,因此,预防和治疗沙门菌感染显得尤为重要[2]。抗生素在防治畜禽疾病中起着重要作用,但随着抗菌药在畜牧业上的广泛使用,细菌的耐药性不断加剧和蔓延,因此带来的耐药问题、食品安全问题及公共卫生问题也越来越严重,已引起了全球的关注[3-4]。加强沙门菌耐药性的研究,对预防和控制沙门菌病的流行具有重要意义。目前,传统的血清分型方法已经不能满足要求,需要采用分型能力更强的分子分型方法进一步分析不同来源的沙门菌之间的联系。脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)分型方法为目前国际上分子分型的通用方法[5-6]。
本试验对中国兽医药品监察所检测技术研究室2009年在北京地区所采集的病料进行分离鉴定。并用临床实验室标准化协会(Clinical and Iaboratory Standards Institute,CLSI)推荐的微量肉汤稀释法进行药物敏感性测定,采用PFGE方法对分离菌株进行分子分型研究。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2009年4月从北京地区某养鸡场采集的泄殖腔拭子、肝脏、卵黄囊。质控菌株ATCC25922由中国兽医药品监察所检测技术研究室提供。PFGE相对分子质量标准采用沙门菌Braenderup血清型全球参考菌株H9812。
1.1.2 主要试剂及仪器 麦康凯培养基、营养琼脂、营养肉汤、MH肉汤均由中国兽医药品监察所基础保障室提供;抗菌药药敏板购自天津金章科技发展有限公司;限制性内切酶XbaⅠ购自Promega公司;PFGE专用琼脂糖Seakem Gold购自Rockland公司;蛋白酶K购自Merck公司;API ID 32E试纸条、ATB细菌鉴定仪均购自法国bioMerieux公司;Riboprinter全自动微生物基因指纹鉴定仪购自美国Du Pont公司;脉冲场凝胶电泳仪为Bio-Rad公司CHEF-DRⅢ型。
1.2 方法
1.2.1 细菌的分离 将所采集样品接种于3 mL~5 mL灭菌四硫磺酸盐增菌液中,42℃培养24 h;用接种环挑取新鲜培养的增菌液,沙门菌显色培养基上划线,37℃恒温培养16 h~18 h;挑取紫色单菌落,接种营养琼脂,37℃恒温培养16 h~18 h。
1.2.2 细菌的鉴定 按照API ID 32E试纸条操作步骤将分离到的细菌接种到试纸条上,37℃恒温培养24 h,用ATB细菌鉴定仪鉴定分离到细菌的种类。用Riboprinter全自动微生物基因指纹鉴定仪鉴定其血清型。
1.2.3 耐药性测定 用药敏板进行检测,试验方法和判断标准参考CLSI所推荐的微量肉汤稀释法。用ATCC25922作为质控菌株。
1.2.4 脉冲场凝胶电泳
1.2.4.1 细菌处理 将分离的沙门菌及标准株H9812复苏。用灭菌棉签取适量细菌,悬浮于1 mL CSB溶液中,用紫外分光光度计调节菌液的OD620nm值至1.5~1.6。
1.2.4.2 制备胶块 取200 μ L细菌悬浮液于2 mL离心管中,置于37℃水浴中孵育5 min。每管加入5 μ L浓度为20 mg/mL蛋白酶K。并加入200 μ L已融化并在56℃水浴平衡的10 g/L的Seakem Gold琼脂糖溶液(含10 mL/L SDS),用移液器加入胶块制备模具。
1.2.4.3 细菌裂解 在50 mL的离心管中加入5 mL的细胞悬浮缓冲液CLB,然后再加入25 μ L的浓度为20 mg/mL蛋白酶K,从模具中取出细菌包埋胶块放入到离心管中,54℃摇床中孵育6 h,摇床转速为180 r/min。
1.2.4.4 洗涤胶块 倒掉混合液,加入15 mL 50℃预热的去离子水。50℃摇床洗涤10 min,洗涤2次。用50℃预热的TE buffer同样条件洗涤4次。
1.2.4.5 XbaⅠ酶切 在2 mL离心管中加入200 μ L胶块平衡液,将洗涤过的胶块切成2 mm宽的胶条,放入胶块平衡液中,37℃孵育10 min,弃平衡液,加入200 μ L酶切溶液(175 μ L去离子水:20 μ L buffer:5 μ L XbaⅠ酶),37℃孵育12 h,弃酶切液。加入200 μ L 0.5×TBE电泳缓冲液平衡5 min。
1.2.4.6 加样 取出胶块,第1、7、15齿各加1个H9812菌胶块作为Marker,其余各齿依次加样品。将梳子放入胶槽,缓慢倒入100 mL熔化后并在60℃水浴平衡的10 g/L Seakem Gold琼脂糖溶液。
1.2.4.7 电泳 加2 200 mL 0.5×TBE电泳缓冲液,电泳时间19 h,电泳温度为14℃。
1.2.4.8 染色 电泳后将胶放入含0.5 μ g/mL EB的染液中染色30 min,然后用去离子水脱色1 h。1.2.4.9 成像及分析 用凝胶成像仪成像,并用Info Quest FP聚类分析软件进行分析。
2 结果
2.1 细菌分离鉴定结果
本次试验从所采集样品中共分离出16株沙门菌。其中,肠炎沙门菌15株,分别从泄殖腔拭子、肝脏、卵黄囊中各分离出3株、7株、5株;鼠伤寒沙门菌1株,分离于卵黄囊。
2.2 药敏试验结果
由以下23种被测药物的药敏试验结果和耐药谱(表1和表2)可以看出,16株鸡源沙门菌对兽医临床常用抗菌药物耐药率较高,利福平为100.00%,萘啶酸为100.00%,多黏菌素E为88.24%;对阿米卡星、大观霉素、氟苯尼考、安普霉素等均敏感。受试菌对被测药物的多重耐药现象较为严重。
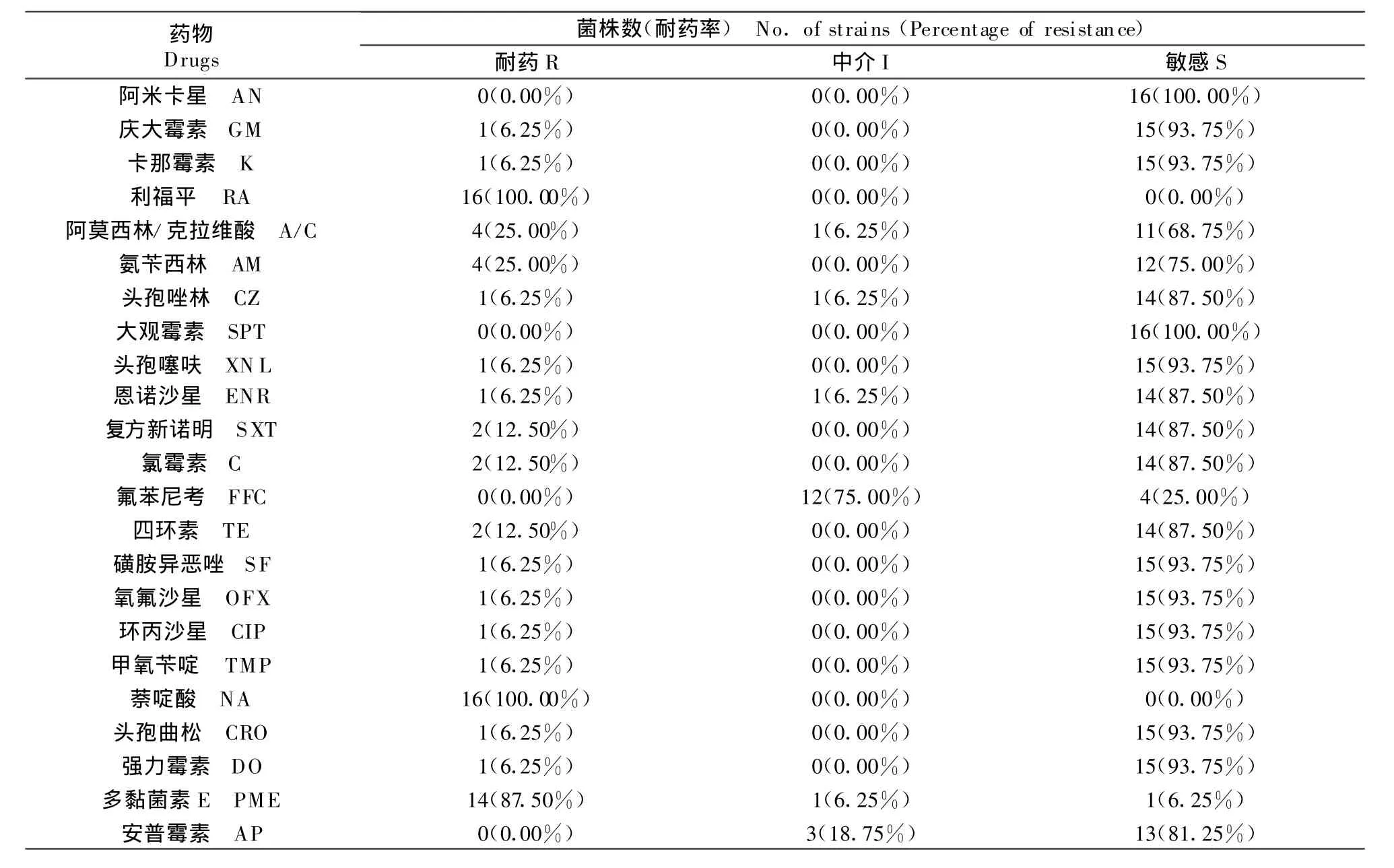
表1 药敏试验结果T able 1 The result of antimicrobial sensitivity test

表2 16株鸡源沙门菌的耐药谱T able 2 Drug-resistant spectrium of 16 Salmonella gallinarum strains
2.3 PFGE结果
16株沙门菌经XbaⅠ酶切,PFGE后,每个菌株产生10条~15条电泳条带,大小在20 kb~1 200 kb之间,部分菌株的PFGE结果(图1)。

图1 部分沙门菌PFGE图谱Fig.1 Representative PFGE patterns of 12Salmonellastrains
2.4 聚类分析结果
用Info Quest FP聚类分析软件分析15株肠炎沙门菌PFGE图谱(图2)显示,其相似度在87.6%~100%之间,共分为A型和B型两个带型,其中A型共有14株,B型仅有1株,A型为优势带型(占总数的93.33%)。
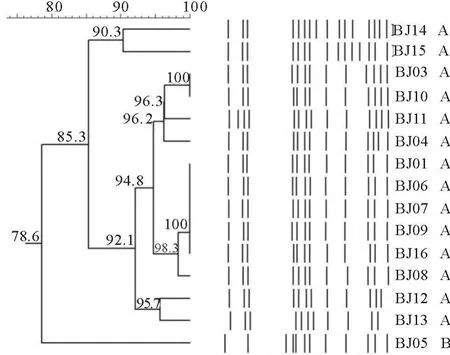
图2 15株肠炎沙门菌的聚类分析图Fig.2 The cluster analysis figure of 15 S.enteritidis strains
3 讨论
沙门菌是一种常见的人兽共患病病原菌,不仅能导致鸡白痢、禽伤寒和禽类副伤寒等疾病,而且也能引起人类伤寒、副伤寒、败血症、胃肠炎等疾病。进行沙门菌耐药性的监测不仅可指导临床用药、预防禽类重大沙门菌病的流行,而且在公共卫生方面也有重要的意义[7-8]。
本试验对分离出的16株沙门菌进行血清型鉴定,结果表明有肠炎沙门菌15株(93.75%),鼠伤寒沙门菌1株(6.25%),优势血清型为肠炎沙门菌,与国内文献报道一致[9-10]。在16株受试菌中,多重耐药菌株数为16株,占受试菌的100%,说明此次分离的肠炎沙门菌耐药现象比较严重。耐药率较高的药物为利福平、萘定酸、多黏菌素E,在88.24%~100%之间,可能与这3种药物问世早,临床应用时间较长有关。受试菌对阿米卡星、大观霉素、安普霉素非常敏感,在治疗北京地区的肠炎沙门菌感染时可作为首选药物。肠炎沙门菌对氧氟沙星、环丙沙星、恩诺沙星、头孢唑林、头孢噻呋及头孢曲松的耐药率均为6.25%,表明氟喹诺酮类药物和头孢类药物对肠炎沙门菌也具有较好的抗菌活性。从本试验结果来看,氟喹诺酮类药物和头孢类药物对肠炎沙门菌的抗菌效果相当,可用这两类药物作为治疗该地区肠炎沙门菌感染的首选药物,但由于头孢类抗生素价格昂贵,从经济角度考虑,在治疗肠炎沙门菌感染时,选用氟喹诺酮类药物更为合理。
沙门菌传统的分型方法只能从血清型、噬菌体、耐药谱分型上去区分,这些分型都是从细菌的表型上进行分型[11]。由于微生物易受环境的影响,很容易改变其表达性状,使得表型分类很不准确[12-13]。PFGE技术是基于DNA结构的分子分型方法,被认为是进行分子分型的可信方法,在国内外被广泛应用于菌种的分子流行病学研究[14-16]。本试验用PFGE技术将肠炎沙门菌分型,试验结果表明北京地区的肠炎沙门菌分为A、B两个型,其中A型为该地区的优势基因型,而且同源性较高。同一血清型之间的PFGE图谱也有一定的差异,说明PFGE分型比传统的血清型分型更加精细,能在分子水平上对其分型。虽然PFGE基因分型技术比传统的表型分型方法费时、费力,但是其在调查细菌亲缘关系方面比后者更有优势。PFGE技术在今后可能会更广泛地运用于分子分型和流行病学研究,并在追踪传染源和传播途径中发挥重要作用。
[1] 陈 瑞,熊惠军,王培园,等.沙门菌肠毒素基因克隆及序列分析[J].动物医学进展,2010,31(9):25-28.
[2] Francois X W,Francoise G.Multidrug resistance in Salmonella enterica serotype typhimurium from humans in France[J].J Clin Microbiol,2006,44(3):700-708.
[3] 耿光瑞,赵月平,李寸欣,等.抗菌药物的合理应用研究进展[J].动物医学进展,2009,30(8):97-100.
[4] Yang H,Chen S,White D G,et al.Characterization of multiple-antimicrobial-resistant Escherichia coli isolates from diseased chickens and swine in China[J].J Clin Microbiol,2004,42(8):3483-3489.
[5] Pang J C,Chiu T H,Helmuth R,et al.A pulsed field gel electropho resis(PFGE)study that suggests a major world-wide clone of Salmonella enterica serovar enteritidis[J].Int J Food Microbiol,2007,116(3):305-312.
[6] 聂小想,沈志强,崔言顺,等.脉冲场凝胶电泳技术在猪链菌分型中的应用[J].动物医学进展,2008,29(1):70-73.
[7] 谭海芳,谭翰清,丁丽娜,等.食物中毒沙门菌PFGE分子分型及耐药性研究[J].中国卫生检验杂志,2009,19(9):2039-2041.
[8] Kim S H,Kim S,Chun S G,et al.Phage types and pulsedfield gel electrophoresis patterns of Salmonella enterica serovar enteritidis isolated from humans and chickens[J].J Microbiol,2008,46(2):209-213.
[9] 石晓路,刘小立,黄 薇,等.脉冲场凝胶电泳在沙门菌食物中毒溯源中的应用研究[J].疾病控制杂志,2007,11(5):502.
[10] 马 越,陈鸿波,李景云,等.1998-2000年沙门菌属耐药性变迁[J].中国抗感染化疗杂志,2002,2(2):84-86.
[11] 陈 瑞,熊惠军,宋 立,等.鸡沙门菌脉冲场凝胶电泳分型研究[J].中国预防兽医学报,2009,31(11):846-849.
[12] 侯凤伶,刘维华,申志新,等.沙门菌脉冲凝胶电泳分型研究[J].中国卫生检验杂志,2008,18(5):780-782.
[13] Kubota K,Barrett T J,Ackers M L,et al.Analysis of Salmonella enterica serotype typhi pulsed-field gel electrophoresis patterns associated with international travel[J].J Clin Microbiol,2005,43(3):1205-1209.
[14] 丁水军,陈棋炯,孙永祥,等.食物中毒肠炎沙门菌的生物学特性及分子分型研究[J].中国卫生检验杂志,2010,20(6):1326-1328.
[15] 李孝权,庞杏林,邓志爱,等.脉冲场凝胶电泳在肠炎沙门菌食源性疾病溯源中的应用[J].中国人兽共患病学报,2009,25(3):245-248.
[16] 徐景野,许国章,金春光,等.伤寒和甲型副伤寒沙门菌PFGE分型方法研究与应用[J].中国卫生检验,2009,19(8):1738-1740.

