山奈酚对人小细胞肺癌H446的增殖抑制和诱导凋亡作用的影响
赵娟 廖峥嵘 吕品 张凤云 雷宇华
小细胞肺癌是支气管肺癌中较为特殊的一种类型,恶性程度在所有肺癌中最高,严重影响人类的生命健康。由于中药不良反应小,近年来在肿瘤临床防治工作中备受关注并取得了一定成果[1]。山奈酚是植物界中广泛存在的黄酮类化合物,主要来源于姜科植物山奈的根茎,具有抗癌[2]、抗炎[3]、抗氧化[4]等多种生物活性及药理作用,其中抗肿瘤作用是一个研究热点。但山奈酚对肺癌的抗肿瘤作用研究较少。本研究观察了山奈酚对人小细胞肺癌H446细胞增殖抑制和诱导凋亡的影响,报告如下。
1 材料与方法
1.1 试剂及设备 试剂山奈酚购自Sigma公司(批号:54608195,纯度>96%),用 DMSO溶解配制成 100 mmol/L的
项目来源:河北省科技支撑计划(编号:08206117D),河北省医学科学研究重点课题计划指导项目(编号:08259)储存液,分装,避光于-20℃保存;人小细胞肺癌H446购自北京协和细胞库;小牛血清购自杭州四季青生物工程材料有限公司,RPMI1640培养基购自美国Gibco公司;Bax抗体、bcl-2抗体购自美国Santa cruz公司;流式细胞仪FACSTAR Calibur,美国Becton Dickinson公司。
1.2 细胞培养 H446细胞采用RPMI 1 640培养基(含有10%小牛血清、青霉素、链霉素各100 U/ml)。置于37℃,5%CO2、饱和湿度环境下培养,待长满瓶底80% ~90%后进行传代实验。
1.3 MTT法测细胞生长的抑制率 取对数生长期的细胞,以5×104个/ml细胞浓度接种于96孔培养板中,每孔加入100μl,于37℃,5%CO2、饱和湿度环境下培养24 h后,加入终浓度为0、10、20、40、80 μmol/L 山奈酚,每种药物浓度均做8 个复孔。在培养24 h后,每孔加MTT 20μl,继续培养4 h,离心10 min,弃去上清,每孔加二甲基亚枫150μl,震荡10 min,用酶标仪测570 nm的A值。根据下列公式计算抑制率:抑制率=[(对照组A-实验组A)/对照组A]×100%。
1.4 流式细胞仪分析凋亡率 细胞培养24 h后,加不同浓度山奈酚处理,设 0、10、20、40、80 μmol/L 共 4 个浓度组,作用24 h后,分别收集各组的细胞,每组3孔,碘化丙啶(PI)单染后上机检测分析。
1.5 Western Blotting检测bax、bcl-2蛋白的表达 终浓度为0、10、20、40、80 μmol/L 的山奈酚处理人小细胞肺癌 H446 细胞24 h后,提取细胞总蛋白。蛋白定量后采用SDS-PAGE电泳,将凝胶蛋白转至NC膜,TBS洗膜3次,加入5%奶粉封闭2 h。于1∶1 000的一抗4℃孵育过夜。TBS洗膜3次,1∶5 000稀释的HRP标记的二抗室温孵育1 h。TBS洗膜3次后加入ECL发光液显色拍照。以β-actin为内参,用BIO-RAD图像分析软件对条带灰度值进行定量分析。
1.6统计学分析应用SAS 6.12统计软件,计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 山奈酚抑制H446细胞的增殖活性 山奈酚作用H446细胞24 h后,在20μmol/L及以上浓度组与对照组比较有显著抑制作用,抑制率随山奈酚浓度的升高而增大(P﹤0.01)。见表1。
表1 山奈酚对人小细胞肺癌H446细胞的抑制作用n=8,±s
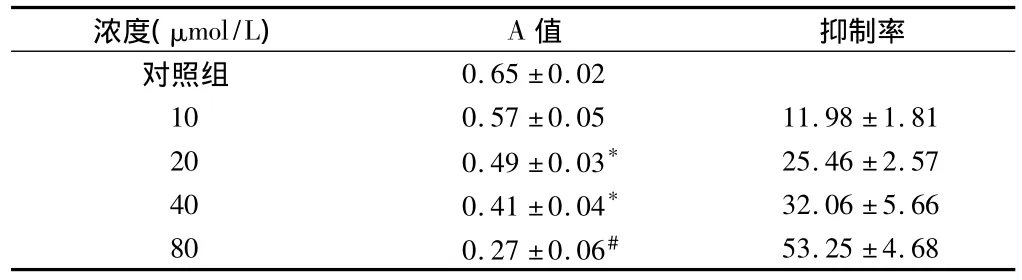
表1 山奈酚对人小细胞肺癌H446细胞的抑制作用n=8,±s
注:与对照组比较,*P <0.05,#P <0.01
浓度(μmol/L) A值 抑制率对照组0.65±0.02 10 0.57±0.05 11.98±1.81 20 0.49±0.03* 25.46±2.57 40 0.41±0.04* 32.06±5.66 80 0.27±0.06#53.25±4.68
2.2 细胞凋亡率的检测 药物处理24 h后,在DNA直方图上可见低于G1期DNA含量的凋亡峰,是凋亡细胞形成的亚二倍体峰,随着山奈酚浓度增加,凋亡峰越来越明显。对照组及10、20、40、80 μmol/L 处理组凋亡率分别为 5.06%、6.69%、11.23%、17.88%、21.95%,其中40、80μmol/L药物处理组与对照组比较细胞凋亡率差异有统计学意义(P<0.01)。
2.3 Western Blotting检测Bax、bcl-2蛋白的表达 随山奈酚处理浓度增大bax蛋白表达上调,bcl-2蛋白则相反,即随山奈酚处理浓度增大蛋白表达量下降。见表2、图1。
3 讨论
资料显示山奈酚是植物界中广泛存在的黄酮醇类化合物,具有抗炎、抗癌、抗氧化等多种生物活性,具有开发成为抗癌新药的潜能。大量研究表明,山奈酚抗肿瘤与细胞凋亡密切相关[5]。

图1 山奈酚对H446细胞bax蛋白(A)和bcl-2蛋白的影响(B)

表2 山奈酚对H446细胞bax蛋白和bcl-2蛋白的影响
研究表明,肿瘤的发生与细胞增殖分化以及异常凋亡有关,抑制细胞增殖、诱导细胞凋亡是化疗药物的重要作用机制之一[6]。本实验MTT结果表明山奈酚对人小细胞肺癌H446细胞增殖具有明显的抑制作用,抑制率随药物浓度增加而增大。流式细胞仪检测细胞死亡率表明,山奈酚有较强诱导人小细胞肺癌H446细胞凋亡的作用。参与细胞凋亡的基因众多,其中bcl-2基因家族既能抑制又能促进细胞凋亡。Bax基因促进细胞凋亡,而bcl-2基因为长寿基因,沉默该基因可以抑制多种肿瘤细胞的生长增殖,是抑制细胞凋亡的主要基因[7]。研究表明大多肿瘤中均有bcl-2的高表达,如肝癌、肺癌、前列腺癌等,bcl-2基因若高表达则抑制肿瘤细胞凋亡,而沉默该基因则抑制肿瘤细胞生长。Bax基因不但拮抗bcl-2的抑制凋亡作用,而且有直接促进细胞凋亡的功能[8,9]。本实验结果显示,山奈酚处理后,Bax蛋白表达上调,bcl-2蛋白表达下调。因此,我们推测Bax蛋白和bcl-2蛋白表达变化,参与了山奈酚诱导的人小细胞肺癌H446细胞凋亡过程。
1 邹亚峰,王国臣.化疗对非小细胞肺癌患者血清抗Survivin抗体水平的临床研究.河北医药,2010,32:11-13.
2 Garcia R,Gonzalez CA,Agudo A,et al.High intake of specific carotenoids and flavonoids does not reduce the risk of bladder cancer.Nutr Cancer,1999,35:212-214.
3 Jovanovic SV,Simic MG.Antioxidants in nutrition.Ann N Y Acad Sci,2000,899:326-334.
4 Lee EJ,Ji GE,Sung MK.Quercetin and kaempferol suppress immunoglobulin E-mediated allergic inflammation in RBL-2H3 and Caco-2 cells.Inflamm Res,2010,59:847-854.
5 Huang WW,Chiu YJ,Fan MJ,et al.Kaempferol induced apoptosis via endoplasmic reticulum stress and mitochondria-dependent pathway in human osteosarcoma U-2 OS cells.Mol Nutr Food Res,2010,54:1585-1595.
6 张永亮.化疗药物诱导的肿瘤细胞凋亡和相关因子的调控.国外医学遗传学分册,2002,25:121-126.
7 Lessene G,Peter E,Czabotar M,et al.BCL-2 family antagonists for cancer therapy.Nature Reviews Drug Discovery,2008,7:989-1000.
8 Karnak D,Xu L.Chemosensitization of prostate cancer by modulating Bcl-2 family proteins.Curr Drug Targets,2010,11:699-707.
9 Mullauer FB,Kessler JH,Medema JP.Betulinic acid,a natural compound with potent anticancer effects.Anticancer Drugs,2010,21:215-227.

