“双C”疗法治疗儿童l型糖尿病疗效观察
张瑜 梁瑞景
儿童糖尿病多为1型糖尿病,其发病机制尚未完全明了,目前易被接受的基本观点认为1型糖尿病是在遗传易感基因的基础上,受环境因素的激发,引起机体本身免疫功能紊乱,导致胰岛B细胞的损伤和破坏,最终使胰岛素分泌绝对不足而发病,患儿血糖极易波动,而发病年龄的提前使儿童在青壮年时就出现并发症,发生心脑血管病的危险增加[1]。国内外多项研究显示,对于伴有显著高血糖的1型糖尿病儿童而言,胰岛素泵持续皮下输注胰岛素(continuous subcutaneous insulin injection,CSII)与动态血糖监测(continuous glucose monitoring system,CGMS)联合(双C方案)是较为有效的治疗和血糖监测模式[2]。本文就我院应用动态血糖监测系统联合胰岛素泵治疗儿童1型糖尿病,取得的良好的效果进行分析。
1 资料与方法
1.1 一般资料 病例来自2009年1月至2010年12月于河北省老年病医院儿科门诊和住院部。60例诊断为1型糖尿病的青少年儿童患者,平均年龄(15±6)岁,糖尿病诊断标准符合1999年WHO制定的1型糖尿病(T1DM)诊断标准。排除标准:(1)2型糖尿病患者;(2)合并糖尿病急性并发症、甲状腺疾病、风湿性疾病及严重肝肾疾病患者;(3)排除活动性肝病,黄疸,天冬氨酸氨基转移酶(ALT)、丙氨酸氨基转移酶(AST)超过正常值上限。(4)过敏体质,有药物过敏倾向者。患儿随机分为2组:CGMS+CSII组(C-C组,n=30)和除CSII之外其他胰岛素治疗方案(N组,n=30),受试者不适用或要求退出试验为研究终点。研究对所有患者随访期限3个月,检测患者血糖、血压、血脂、肾功、肝功、CGMS监测72 h,比较患儿治疗后糖化血红蛋白(HbAlc)、24 h平均血糖浓度、白天和夜晚血糖波动幅度、低血糖事件和高血糖事件发生的例数,如果必要可增加检查次数。发生终点事件或是停止临床随访,记录此时的实验室结果。
1.2 方法
1.2.1 治疗方法:①C-C组:采用速效胰岛素类似物-诺和锐置于胰岛素泵(美国MiniMed-712型),通过连接导管的皮下埋置针头,将胰岛素24 h持续缓慢注入体内。胰岛素用量为0.5~1.0 U·kg-1·d-1,将全日的总量分为基础量和餐前追加量两部分,两者用量按1∶1比例分配,根据患儿餐后2 h血糖、空腹血糖结果调整药物剂量,使血糖尽可能波动在6~8 mmol/L。②N组:采用任何一种国家食品药品监督管理局(SFDA)批准上市的胰岛素或胰岛素类似物,分别于三餐前和(或)睡前皮下注射。根据患儿餐后2 h血糖、空腹血糖结果调整药物剂量,使血糖尽可能波动在6~8 mmol/L。
1.2.2 血糖监测:①剂量调整期:美国-MiniMed CGMS监测血糖72 h监测过程中测末梢血糖4次/d,输入CGMS中校正监测结果),采用德国ACCU-Chek便携式血糖监测仪测末梢血糖。记录24 h平均血糖浓度、白天和夜晚血糖波动幅度、低血糖事件和高血糖事件发生的例数。②剂量维持期:采用德国ACCUChek便携式血糖监测仪7次/d测末梢血糖。
1.2.3 其他测量指标:空腹血浆葡萄糖(FPG)、餐后2 h血浆葡萄糖(2 hPG)、HbA1c,以上指标均在河北省老年病医院检验科及核医学科进行检测,血浆血糖用血浆葡萄糖氧化酶法测定,HbA1c用酶法测定(执行标准均以西南医院为参考);血肌酐(s-Cr)、血尿素氮(BUN)、血胱抑素C(Cystatin-C)、AST、ALT、谷氨酰转肽酶(GGT)、采用日本AU640Olympus全自动生化分析仪测定(执行标准均以河北省老年病医院为参考)。
1.3 统计学分析 应用SPSS 10.0统计软件,计量资料以¯x±s表示,采用配对t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组患儿一般情况比较 本试验患者依从情况较好,无失访和退出病例;研究过程中,患儿肝功能ALT、AST治疗前后差异无统计学意义(P>0.05),也无因过敏或不适而换用其他治疗方案者。另外,2组人口统计学、生化基线特征相似。
2.2 2组患儿治疗前后HbA1c、FPG、2HPG、ALT、AST指标变化 2组治疗均可使血糖逐步稳定,C-C组和 N组治疗后HbAlc、FPG、2 hPG较治疗前均明显下降(P<0.05);和N组相比C-C组合能更好的控制患儿HbAlc、FPG、2hPG(P<0.05)。见表1。
表1 2组患儿治疗前后HbA1c、FPG、2HPG、ALT、AST指标变化n=30,±s
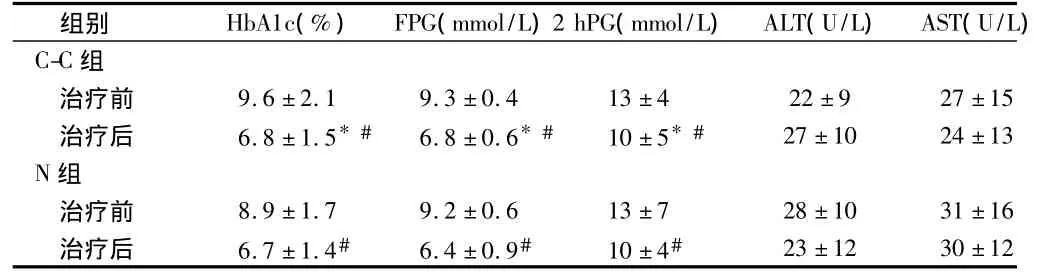
表1 2组患儿治疗前后HbA1c、FPG、2HPG、ALT、AST指标变化n=30,±s
注:与N组比较,*P<0.05;与治疗前比较,#P<0.05
组别 HbA1c(%) FPG(mmol/L)2 hPG(mmol/L) ALT(U/L) AST(U/L) C-C 组治疗前 9.6±2.1 9.3±0.4 13±4 22±9 27±15治疗后 6.8±1.5*# 6.8±0.6*# 10±5*# 27±10 24±13 N组治疗前 8.9±1.7 9.2±0.6 13±7 28±10 31±16治疗后 6.7±1.4# 6.4±0.9# 10±4#23±12 30±12
2.3 CGMS结果分析 C-C组24 h平均血糖浓度较N组明显降低(P<0.05);C-C组白天及夜间血糖波动幅度、低血糖及高血糖发生次数均明显少于N组(P均<0.05)。见表2。
表2 2组治疗前后CGMS结果分析n=30,±s

表2 2组治疗前后CGMS结果分析n=30,±s
注:与N组比较,*P<0.05;与治疗前比较,#P<0.05
组别 24 h平均血糖浓度(mmol/L) 白天血糖波动幅度(mmol/L) 夜间血糖波动幅度(mmol/L) 每日低血糖发生次数(次) 每日高血糖发生次数(次) C-C 组治疗前 8.7±1.6 6.2±0.9 4.5±1.2 2.0±1.4 2.1±1.0治疗后 6.6±2.0*# 4.1±0.7*# 2.2±0.8*# 1.0±0.8*# 0.9±0.8*# N组治疗前 8.5±1.9 5.8±1.2 4.8±0.9 2.4±1.0 2.1±0.9治疗后 6.9±2.1# 4.2±0.9# 2.6±1.3# 1.0±0.6# 0.9±0.7#
3 讨论
随着糖尿病患病率和糖尿病患者人数快速增长,糖尿病对人类的健康威胁已是一个全球性的共同关注问题,糖尿病复杂的发病过程使人类至今尚未找到根治的方法,青少年作为一个特殊的人群,糖尿病的显著增加已经被广泛认识和重视。儿童和青少年患糖尿病后的危害比成人更大,发病年龄的提前使儿童在青壮年时就出现并发症,发生心脑血管病的危险增加[1-4]。同时不断增加的发病率和病死率的风险指数将加重社会负担,对公共健康造成严重的影响。
儿童T1DM是在遗传易感基因的基础上,受环境因素的激发,引起机体本身免疫功能紊乱,导致胰岛B细胞的损伤和破坏,患者体内胰岛素绝对缺乏,而又处于生长发育阶段,运动和饮食欠规律,故血糖极易波动,尤其是“蜜月期”后,随着病程的延长,血糖不易控制。为减少和延缓糖尿病慢性并发症的发生,需要根据血糖监测结果及时调整胰岛素治疗方案。
CSII可准确控制胰岛素输入剂量、速度和时间,模拟人体胰岛素的生理分泌,是目前进行胰岛素强化治疗的一个理想手段,与每日多次皮下注射(MDI)相比,CSII治疗T1DM可以明显改善血糖水平,减少血糖波动,延缓和减轻糖尿病并发症的发生发展,改善患儿生存质量[4,5]。但临床亦发现该强化治疗手段可使低血糖的发生率显著增高[6,7]。CGMS是一种糖尿病血糖监测的高新科技手段,通过每天288个血糖数据,连续、动态的血糖监测,确保不遗漏任何重要的血糖波动趋势,能全面反映血糖的整体情况,从而更好地帮助患儿调整胰岛素用量,控制较理想的血糖水平[8,9]。本组60例患儿CGMS值与指测血糖值进行相关性分析,结果发现两者血糖值之间有很好的相关性,这与国外多家研究结果一致[10]。从而表明,CGMS与手指血血糖监测可以提供同样准确的血糖数据[11]。
本研究中,CSII联合CGMS与单用微量血糖仪在血糖稳定达标时间、低血糖发现次数差异均有统计学意义,与国外文献相符[7,12]。从而进一步证实,双C方案应用于T1DM,可以达到更快、更有效地控制高血糖,缩短患儿住院日的目的,但易发现低血糖事件,应注意防止严重低血糖事件的发生。
1 Haller MJ,Atkinson MA,Schatz D.Type 1 diabetesmellitus:Etiology,presentation,and management.Pediatr Clin N Am,2005,52:1553-1578.
2 Rytkonen M,Moltchanova E,Ranta J,et al.The incidence of type 1 diabetes among children in Finland-rural-urban difference.Health Place,2003,9:315-325.
3 Legault L,Polychronakos C.Annual incidence of type 1 diabetes inQuebec between 1989-2000 in children.Clin Invest Med,2006,29:10-13.
4 Lee JM,Herman WH,McPheeters ML,et al.Anep idemiology p rofile ofchildren with diabetes in the US.D iabetes Care,2006,29:420-421.
5 朱艳玲,钱林,赵霞,等.动态血糖监测在初诊2型糖尿病治疗中有效性和安全性的研究.河北医药,2010,32:3354-3355.
6 Simon B,Treat V,Marco C,et al.A comparison of glycaemic variability in CSII vs.MDI t reated type 1 diabetic patient susing CGMS.Int J Clin Pract,2008,62:1858-1863.
7 Maia FF,Araujo LR.Is silent hypoglycemia part of ideal glycemic control in DM1 patients?-hypoglycemic state by CGMS vs glycemic average. Arq Bras Endocrinol Metabol,2008,52:994-1000.
8 Ryan EA,Germsheid J.Use of continuous glucose monitoring system in the management of severe hypoglycemia.Diabetes Technol Ther,2009,11:635-639.
9 陆忠,沈水仙,罗飞宏,等.儿童1型糖尿病动态血糖监测的临床意义.中国实用儿科杂志,2005,20:721-723.
10 Tseghai B,Daniel P,Bruce W,et al.Feasibility and safety of insulin pump therapy in children aged 2 to 7 yearswith type 1 diabetes:A retrospective study.Pediatrics,2006,117:2132-2137.
11 王战建,苏杰英.动态血糖监测系统在糖尿病诊治中的应用进展.中国实用内科杂志,2007,27:307-309.
12 Woderer S,Henninger N,Garthe CD,et al.Continuous glucose monitoring in interstitial fluid using glucose oxidase-based sensor compared to established blood glucosemeasurement in rats.Anal Chim Acta,2007,581:7-12.

