磁共振波谱NAA与Lac在脑梗塞各时期的临床意义*
福建院中医药大学附属人民医
1.影像科; 2.神经内科
(福建 福州 350000)
戚 婉1 张彩霞1 黄成华1许亚晔1 叶成斌1 阮 甦2
脑血管疾病目前仍然是常见的神经系统危重疾病。而脑梗死占脑血管疾病的56.6%-80.0%[1],脑梗死是中老年人死亡及致残的重要原因,其致残率位居第一,给社会和家庭带来沉重负担。由于对脑梗死预后缺乏客观可靠的预测工具,难以实施个性化的治疗措施,从而影响康复效果。因此,建立一个能够准确预测脑梗死预后的方法,对脑梗死的治疗和康复训练具有临床指导意义。氢质子磁共振波谱技术是将功能检查与影像学检查相结合,是目前唯一的无创性连续动态观察活体组织代谢物浓度变化和定量分析的方法,在脑梗死的诊断、发生发展过程、评价预后及疗效等方面显示出独特的优势[2,3]。
材料与方法
1.1 临床资料 选取2008年1月-2011年4月间在福建中医药大学附属人民医院住院治疗的脑梗死患者100例,其中男57例,女43例。年龄37-86岁,平均62.5岁。根据发作时间将其分为超急性期(6小时内)10例,急性期(6小时后至2天内)52例;亚急性期(2天后至6周内)25例;慢性期(6周后)13例。将对侧相同部位正常区域作为自身对照组。
1.2 实验方法 选择经过SCT扫描排除脑出血者,使用SIEMENS Avato1.5T磁共振扫描仪行常规头颅T1WI、T2WI、水抑制扫描及弥散成象;根据病变部位、范围和时期,确定波谱分析的病变区域,一个患者如有多时期病变,可多次波谱采集。选择病灶感兴趣区(VOI),VOI为正方体,体素大小为15mm×15mm×15mm—20mm×20mm×20mm。选择VOI时尽量避开脑沟裂、侧脑室的脑脊液,颅底的骨及脂肪。采用点解析波谱序列(PRESS),TR=1500ms,TE=135ms,单体素采集,采集次数192次,体素内匀场、水抑制和无水扫描等均由自动扫描程序完成,时间约4.48分钟,获得单体素MRS(SVS)。每一个病例均行对侧正常区域相应部位波谱采集,描绘每一例病变波谱曲线,进行相位和基线校正,根据化学位移确定各化合物对应的峰面积,以此估算该化合物的浓度;分析各化合物的峰值和比值,包括N-乙酰冬氨酸峰(NAA),含胆碱化合物峰值(Cho),肌酸峰(Cr),乳酸峰(Lac),NAA/Cho比值,NAA/Cr比值和Lac/Cho比值。重点研究NAA、Lac两个指标在脑梗塞各时期的变化规律。
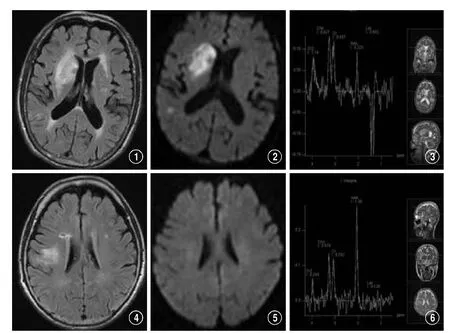
图1-3 男性,79岁,突发左侧肢体无力5小时,诊断为超急性脑梗死。图1,水抑制图像上右侧基底节区略高信号,图2,弥散成像上呈不均匀高信号,图3,波谱上Lac峰呈倒双峰,NAA有下降。图4-6 女,71岁,头晕2月,加重3天,MRI诊断为慢性脑梗死。图4,水抑制图像上右侧脑室旁不均匀略高信号,图5,弥散成像上未见高信号,图6,波谱上显示较低浓度的Lac峰。
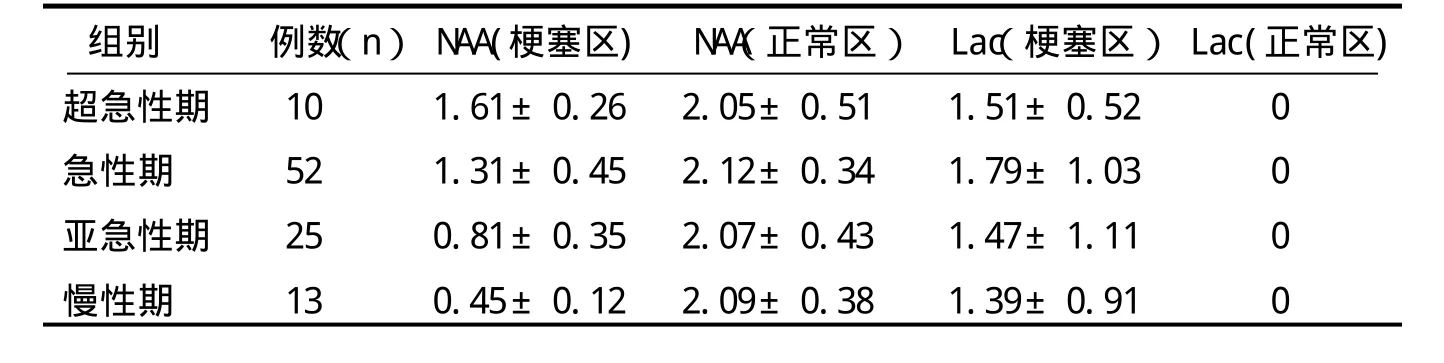
表1 脑梗死患者代谢物变化表(x±s) n=100例
1.3 统计学处理 采用SPSS 13.0 统计分析软件,对MRS所测得的代谢物质相对浓度分别进行梗死灶病侧与对侧正常组织做配对设计t检验,比较脑梗死病灶与对侧正常脑组织之间的差异。不同脑梗死时期Lac、NAA做成对t检验。
结 果
2.1 常规MRI检查表现 超急性期10例脑梗死患者在MRI平扫上均表现为T1WI等信号、T2WI稍高信号,边界不清;急性期52例脑梗死患者在MRI平扫上均表现为T1WI稍低信号、T2WI稍高信号,界限模糊,其中有17例患者可见局部病灶脑组织肿胀,另有12例出现不同程度的占位效应;亚急性期25例脑梗死患者中有15例在MRI平扫上表现为T1WI稍低信号、T2WI高信号,10例表现为T1WI低信号、T2WI高信号,所有病灶边界清楚;慢性期13例脑梗死患者在MRI平扫上均表现为界限清楚的T1WI低信号、T2WI高信号。
2.2 脑梗塞MRS表现 10例超急性期均出现Lac(图1-3),而NAA改变不明显;52例急性期Lac均增加,NAA显示不同程度地减少;25例亚急性期,其中17例Lac开始下降,但仍维持较高的浓度,其余8例未见明显乳酸峰,NAA进一步减少;13例慢性期,其中11例在病灶区仍可检测到一定浓度的Lac(图4-6),2例未出现明显Lac峰。
在各分期脑梗死患者的检查中,脑梗死病灶中心区的NAA均有不同程度的下降,病灶与对侧相应部位NAA自身配对t检验P<0.05,表明差异有显著性。各分期脑梗死区NAA之间比较P<0.01,表明有显著性差异,表明NAA在超急性期就出现降低,随着缺血时间的延长呈进行性下降。(见表1)
100例脑梗死患者MRS检查中,90例可检测到Lac峰,表现为1.33ppm处得特征性倒置双峰,其中最早5小时,最迟5.5天;10例未检测到Lac(8例亚急性期,2例慢性期)。在对侧正常区未检测到Lac,各期之间经统计学处理无显著性差异。
讨 论
近年来许多研究者对波谱的各个指标包括NAA、Cr、cho、lac进行了研究,多项研究发现NAA和Lac是MRS定量测定脑梗死区的两个重要物质, NAA和Lac定量测定及综合分析能反应梗死区脑组织的病理生理变化和脑组织的存活状态[4]。
3.1 NAA在脑梗死中的变化NAA的表现是N-乙酰基的特征,化学位移位于2.02ppm。其波峰在波谱中最高[5]。NAA主要存在于有功能的神经元的胞体和轴突内,反映神经元和轴索的密度和功能状态[6],能敏感地反映神经元的功能及残存神经元的状态。
本研究发现,脑梗死灶内NAA均进行性减少,但下降时间并不一致。NAA在超急性期就出现降低,随梗死时间延长, 呈明显降低趋势,说明梗死区神经元在超急性期就出现损伤, 随梗死时间延长, 梗死区残存神经元越来越少。不同病例NAA下降程度不完全一样,在脑梗死各时期NAA下降幅度未见明显差异,这有可能说明神经细胞死亡主要与缺血程度和缺血持续时间密切相关[7]。说明NAA检测值可作为预测脑梗死预后的重要指标,但下降到什么程度才产生不可逆的损伤目前还没有得出明确结论。在超急性期梗死中心区细胞已出现不可逆性损伤,而缺血半暗带即周围区可进展为脑梗死,因此缺血半暗带功能的恢复是临床溶栓治疗的目标。标志着要恢复严重脑缺血的有效灌注时间应在发病6小时内进行[8]。
3.2 Lac在脑梗塞中的变化
乳酸(Lac)为糖酵解产物,化学位移位于1.33ppm。正常脑组织内Lac水平很低,MRS不能为谱线所显示。当血管闭塞后脑组织出现缺血缺氧时,Lac水平显著升高,MRS可以检测到特征性的双峰。这标志着脑组织局部血流灌注低,正常细胞内氧化呼吸抑制而糖酵解加强,是早期脑梗死的敏感指标[9]。
在脑梗死中Lac浓度呈动态变化过程。Lac在超急性期即达高峰,有人报道超急性期发作3小时内检测到Lac升高[10];在急性期48小时内,Lac显著升高,与无氧代谢有关;在亚急性期Lac继续升高,2周左右Lac开始下降,但仍维持较高浓度[11],本组有7例符合这一结果;而慢性期Lac变化各家报道并不完全一致,有些病例Lac持续存在,直到梗塞后4个月,甚至9个月后;有些病例在慢性期检测不到Lac,可能被脂质污染不能发现。由于Lac不存在于正常脑组织中, Lac在超急性期和急性期的升高是脑组织缺血缺氧的标志;Lac在脑组织出现的范围和部位, 应代表梗死区大小和部位;Lac增高程度反应脑梗死严重程度。Graham等发现乳酸持续大量存在的患者均有明显神经损伤并遗有中到重度残疾,而乳酸信号变化不大者其临床过程较好。NAA正常而乳酸轻度升高的轻偏瘫患者较乳酸大量存在及NAA显著降低者预后好,说明MRS有评价预后功能。因此,认为乳酸水平是反映早期缺血性脑梗死严重程度的信息,同时认为Lac是早期(24小时以内)脑梗死的敏感指标,但并不是脑梗死特异性指标。
3.3 MRS在脑梗死中的应用价值、限度及展望 MRS为常规影像学所显示的解剖学改变补充了重要代谢信息。本研究结果说明MRS分析为临床不同时期脑梗死治疗提供了病理生理变化和演变规律的新途径,NAA和Lac是反映脑梗死时期的可靠指标,为临床不同时期脑梗死的治疗提供病理生理学依据,为临床的溶栓、抗凝、降纤等治疗提供了科学的指导,为脑梗死的早期诊断以及预后和疗效的判断提供了重要依据。但是由于脑梗死缺血程度不一样;单体素波谱不能提供不同区域脑梗死区的代谢变化差异;在选择VOL时受病变部位附近的脑脊液或颅骨影响,MRS结果将受到干扰;技术方面,体素要求较大,不能对小病灶进行测量。近年来,磁共振技术飞速发展,MRS新技术层出不穷,多体素2D及3D技术等的开发,加之软件和设备不断更新,相信MRS必将在人类脑梗死诊断和治疗等方面发挥越来越重要作用。
1.王晓蓉,王文安,刘振国等.亚急性期脑梗死的质子磁共振波谱研究[J].上海交通大学学报(医学版),2007,27(6):719-722.
2.Asato R , Okumura R , Konishi J ,et al.“Fogging effect”in MRI of cerebral infarct[J]. J Comput Assist Tomogr, 1991,15:160.
3.Beck H, Desch H, Hacker H. CT fogging effect with ischemic cerebral infarcts[J]. Neurology,1979,18:185.
4.Beauchamp NJ, Barker PB, Wang PY, et al.Imaging of acute cerebral ischemia[J].Radiology,1999,212(2):307-324.
5.筠主译.Lara A,Branda MD,Romeu C,等.脑磁共振波谱成像[M].天津:天津科技翻译出版公司,2005:1-14.
6.D.P.Soares,M.Law.Magnetic resonance spectroscopy 0f the brain:review of metabolites and clinical applications[J].Clinical Radiology,2009,64:12-21.
7.Beauchamp NJ, Barker PB, Wang PY, et al.Imaging of acute cerebral ischemia[J].Radiology,1999,212(2):307-324.
8.莫昌期,谭彩姬,杨兴桂,等.1H磁共振波谱在诊断超急性脑梗死中的应用[J].实用医技杂志,2008,15:708-709.
9.张玉梅,张宁,周筠,等.应用磁共振波谱观察脑卒中患者的脑内代谢变化[J].中国临床康复,2005,9(33):111-113.
10.Saunders DE, Howe FA, Boogaart A,et al. Discrimination of metabolite from lipid and macromolecule resonance in cerebral infarction in human using short echo proton spectroscopy[J].J Magn Reason Imaging,1997, 7(6):1116-1121.
11.Saunders DE, Howe FA, Bogart A,et al. Continuing ischemic after acute middle cerebral artery infarction in humans demonstrated by shortecho proton pectroscopy[J]. Stroke,1995, 26:1007.

