应用ADC值对新生儿缺氧缺血性脑病追踪复查的初步研究
1.广东省江门市中心医院放射科(广东 江门 529030)
2.暨南大学附属第一医院影像中心(广东 广州 510632)
左克扬1 罗学毛1 龙晚生1 刘斯润2
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是指围产期的宫内缺氧和产后窒息导致的缺氧缺血性脑损害,HIE严重者病情重、病死率高,存活者可产生永久性神经功能障碍,如智力低下,脑性瘫痪、癫痫、痉挛与共济失调等[1],早期诊断和及时干预治疗非常重要。
常规MRI主要通过T1WI、T2WI上脑白质信号的改变来定性评价髓鞘化进程,由于缺乏量化指标,有一定主观性,且不够敏感,对HIE复查的作用有一定限度。而磁共振弥散张量成像(Diffusion Tensor Imaging,DTI)则可用于脑髓鞘发育成熟度的定量评价,其应用于成人中枢神经系统已比较成熟,但由于新生儿及婴幼儿期的脑是处于不断动态发育及髓鞘化过程中,其特点与成人明显不同。故无论对于正常儿童还是脑疾患儿童,动态追踪观察是非常重要和必需的。而对于HIE患儿,病损是否影响其脑白质发育及髓鞘化,对其是否存在智力和运动障碍等后遗症至关重要。本研究尝试用弥散张量成像的方法进行研究,结合常规MRI成像,ADC值量化评价HIE轻重程度对白质和髓鞘发育的影响情况。
材料与方法
复查45例新生儿期临床诊断为轻、中、重度缺氧缺血性脑病的足月产新生儿(孕龄在37-42周之间),轻度组20例,其中男12例,女8例;中度组16例,其中男10例,女6例;重度组9例,其中男6例,女3例。复查时患儿为月龄6-30个月不等的婴幼儿,新生儿期初始病例诊断标准按照中华医学会儿科学会新生儿学组1996年10月于杭州修订的《新生儿缺氧缺血性脑病诊断依据和临床分度》[2]将患儿分为轻、中、重度三组。

表1 45例轻、中、重HIE复查ADC值比较
所有病例均进行了一次以上MR复查(包括常规MRI及DTI检查),以最后一次MR复查时间为准,扫描时患儿处于自然睡眠状态,不能自然入睡者应用10%水合氯醛0.5-1ml/kg口服或灌肠。使用GE SIGNA 1.5T Horizon echo speed超导磁共振扫描机(最大梯度场幅值为23mT/m,梯度场切换率为120T/m/s),环形线性表面线圈。扫描序列采用DW/T2W EPI、T2W快速自旋回波(FSE)、T1W自旋回波(SE)、液体衰减反转恢复(FlAIR)和弥散张量(DTI)扫描序列。扫描参数:横轴面扫描所有序列均采用16层左右,层厚为5mm,层间距为1mm,FOV=22cm,DTI序列使用非同一直线上的13个方向的弥散梯度场。另外,横断面扫描之后进行冠状位的T1WI及DTI扫描,参数与横断面相同。然后利用美国GE公司Functool功能软件对DTI原始弥散图像进行后处理得彩色ADC图。感兴趣区(ROI)在T2WI上选定,分别于轴位基底节层面选择性的测量胼胝体压部、内囊后肢及豆状核,于侧脑室顶层面测量放射冠及额、顶叶中央白质。之所以选择这些区域,主要是考虑到新生儿发生缺氧缺血性脑病时较易损伤这些部位,因这些部位为正在积极进行髓鞘化的组织,对缺氧缺血性损伤特别敏感[3]。主要测量指标为ADC值。
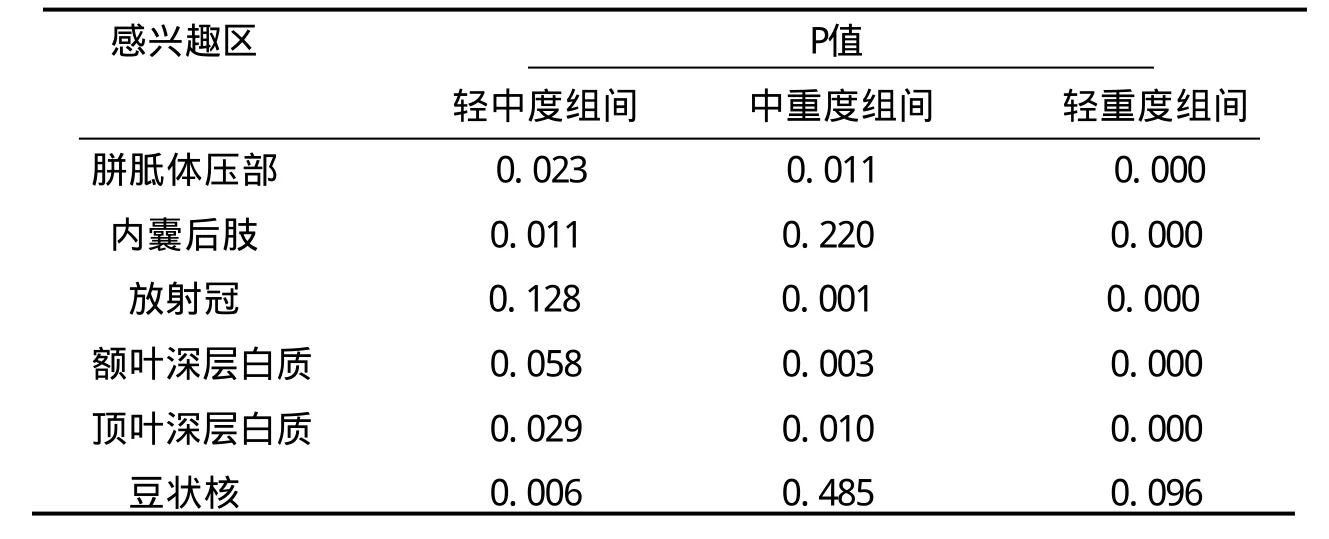
表2 45例轻、中、重HIE复查ADC值两两组之间统计学差异比较
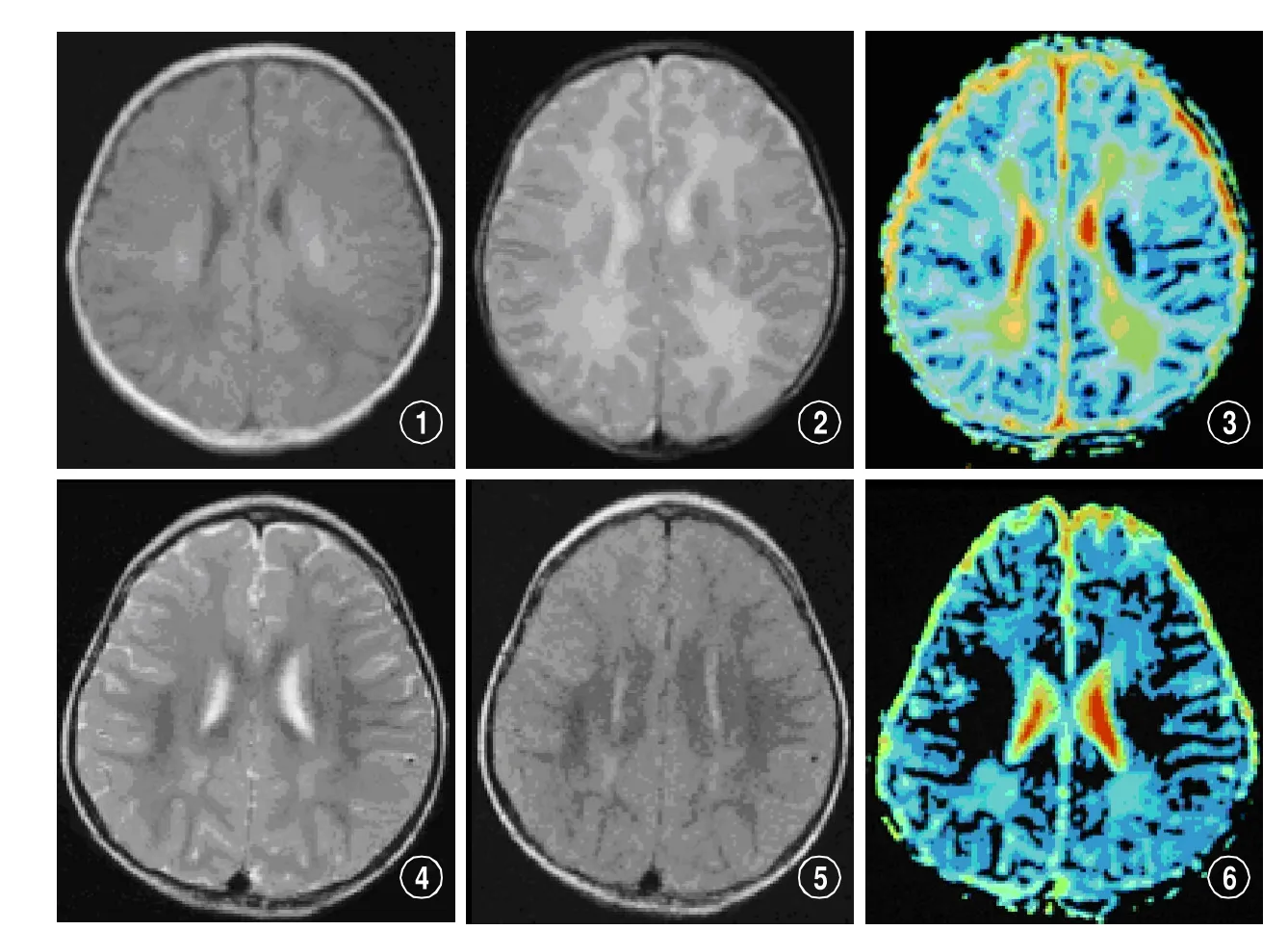
图1-3 一轻度HIE足月新生儿(孕龄39+2周)出生后1天 初诊时常规MRI扫描T1WI及T2WI上未发现明显异常信号(图1、2)。 而双侧侧脑室后方白质于DTI的ADC图上呈信号增高的红黄色,测ADC值升高(ADC值2.08×10-3 mm2/s)(图3)。图4-6 与图1-3同一患儿18个月复查时,双侧侧脑室后方白质呈长T2信号(图4)和T2-FLAIR上高信号(图5),同时呈ADC值增高的髓鞘发育不良改变(图6)。临床表现为肌张力增高,伴有间断抽搐。
数值用SPSS11.5统计软件进行处理。HIE复查的轻度、中度、重度组之间的ADC值比较的统计方法采用单因素方差分析,两两组之间比较方法根据方差齐性检验结果,方差齐性时用Bonferroni法,方差不齐时用Tamhane’s T2法。检验水准均为0.05,均以P<0.05被认为是差异有统计学意义。
结 果
轻度、中度、重度HIE复查DTI各指标均数之间比较。轻度、中度、重度HIE组的感兴趣部位ADC值均有明显组间差异,且表现为除豆状核外,轻度、中度、重度HIE组的ADC值均逐渐升高;两两组之间比较,除内囊后肢中重度组间、放射冠和额叶深层白质轻中度组间、豆状核中重和轻重度组间差别无统计学意义外,余两两组间差别均有统计学意义(表1,2)。
讨 论
3.1 正常婴幼儿脑髓鞘发育及常规MRI的定性评价 中枢神经系统的发育和成熟是一个复杂的过程,胎儿时期该系统发育尤为迅速,经历了其发育的几乎全部重要阶段。髓鞘化在妊娠中期即由脑干开始发生,出生后继续进行,髓鞘的发育具有特定的方向性(由尾端向头端,由后向前,由下向上顺序发展)和选择性(感觉纤维早于运动纤维)。由于婴幼儿脑发育中髓鞘是动态变化的,与成人脑髓鞘的MRI信号表现不同,且不同年龄时段信号亦不同,所以熟悉正常的新生儿和婴儿的脑发育常规MRI表现,对认识和正确评估小儿脑发育迟缓,异常髓鞘化和治疗后髓鞘演变都具有极大的帮助。
脑髓鞘化是指脑白质的髓鞘形成,是脑发育成熟的重要标志之一。髓鞘是由少突胶质细胞膜沿轴突缠绕而成的一种复合的细胞膜。生后6个月内的小儿脑含水量多达90%,灰白质内水和脂质含量相似,故此时在T2WI上未成熟的髓鞘亦呈高信号,与呈高信号的灰质无法区别。故在6-8个月内的小儿采用T1WI 评估脑白质髓鞘化优于T2WI。随着髓鞘的成熟,T2驰豫时间下降,信号减低,在T2WI上,脑白质的信号强度低于脑灰质。而在T1WI上,由于髓鞘内含量增多的磷脂缩短水分子T1驰豫时间所致的高信号,被磷脂的疏水性导致水分子含量即氢质子密度减少所抵偿,故在T1WI上,脑白质信号强度仍稍高于灰质信号强度,与呈高信号的未成熟髓鞘仍无法区别。由此可见在小儿6~8个月后用T2WI更有利于评估成熟的髓鞘。
Miller JH等[4,5]发现胼胝体压部、膝部及内囊前肢髓鞘成熟时间分别为6,8,9个月,至2岁时大多数髓鞘已发育成熟,2岁后的常规MRI定性表现与2岁时无区别。
3.2 磁共振弥散张量成像的基本原理及定量评价正常婴幼儿脑髓鞘化 弥散是指分子的不规则随机运动即布朗运动。如果组织中水弥散的受限程度在各个方向都是相同的,就称之为各向同性弥散,而在一些结构性排列非常有序的组织如脑白质,水的弥散受限程度在一些方向要较其他方向大,称之为各向异性弥散。
各向同性ADC值代表的平均弥散度反映了水分子的弥散能力,对正常脑组织而言,这主要取决于其含水量的多少,ADC值的降低程度可较准确反映脑组织含水量的减少程度。ADC值随年龄增大而减少,其原因除含水量减少外,与白质的髓鞘化,神经元和胶质细胞的生长致细胞外空间减小亦有很大关系。
3.3 ADC值在HIE追踪复查中的作用 对于HIE的复查,由于常规MRI可定性反映髓鞘化的进程,T1WI和T2WI被广泛用于从视觉上评估儿童发育的脑的成熟程度的变化,它主要通过不同年龄阶段灰白质间信号对比的变化来判断脑的发育情况,而这种信号对比的变化一般认为主要是由于髓鞘化进程的结果. 常规MRI这种特异的定性评价髓鞘化的特性被证明对于区分脑发育的正常与否是有用的[6]。
正常婴幼儿随着年龄的增大,脑组织逐渐成熟,水含量渐少,平均弥散度减小,本研究通过定量测量不同深部白质及深部灰质核团(豆状核)的ADC值,客观监测HIE所致白质损伤。ADC值较常规MRI更有利于早期发现HIE损害,且为追踪复查后的MR表现及临床症状所证实。(图1-3及图4-6)
本研究还发现所有感兴趣区的轻、中、重组间ADC值均有统计学差异,且除豆状核之外,深部白质ADC值在轻、中、重组间依次均呈线性增加趋势。说明随髓鞘损伤程度不同,导致ADC值到婴幼儿时期不随年龄增大而明显下降或反而不同程度上升。说明髓鞘发育不良后,脑含水量没减少或增多。与有关研究相符[7、8];而组间两两比较,内囊仅中重度之间无统计学意义差别,说明内囊作为出生前即已髓鞘化成熟的中央白质,易受HIE损伤[9],但对重度损伤有一定抗损伤性。豆状核ADC值仅轻中度间有统计学差异,说明虽HIE损伤后致神经元发育受影响,含水量增加,但不随病情加重而线性增加,可见以ADC值评价HIE的灰质核团损伤有一定作用,但亦有限度,需结合常规MRI观察
1.金汉珍,黄德珉,官希吉.实用新生儿学[M].2版.北京:人民卫生出版社,1997:624-625.
2.韩玉昆整理.新生儿缺氧缺血性脑病临床诊断依据和分度[J].中华儿科杂志,1997,35(2):99-100.
3.Rutherford MA,Pennock JM,Counsell SJ,et al.Abnormal magnetic resonance signal in the internal capsule predicts poor neurodevelopmental outcome in infants with hypoxicischemic encephalopathy[J].Pediatrics,1998,102(2):323-328.
4.Miller JH,McKinstry RC,Philip JV,et al.Diffusion-Tensor MR Imaging of Normal Brain Maturation:A Guide to Structural Development and Myelination[J].AJR,2003,180:851-859.
5.吴茂雄,林霓阳,黄旭璇,等. 新生儿缺氧缺血性脑病CT诊断和随访的价值[J]. 中国CT和MRI杂志, 2004, 2(2):5-7.
6.Barkovich AJ. Pediatric neuroimaging[M].3rd ed.Philadelphia: Lippincott,2000: 13-69.
7.Miller SP,Vigneron DB,Hery RG,et al.Serial quantitative diffusion tensor MRI of the premature brain:development in newborns with and without injury[J].JMRI,2002,16(6):621-632.
8.Filippi CG,Lin DDM,Tsiouris AJ,et al.Diffusion-Tensor MR Imaging in Children with Developmental Delay:Preliminary Findings[J].Radiology,2003,229(1):44-50.
9.Hunt RW,Neil JJ,Coleman LT,et al.Apparent Diffusion Coefficient in the Posterior Limb of the Internal Capsule Predicts Outcome After Perinatal Asphyxia[J].Pediatrics,2004,114(4):999-1003.

