15-KETE对慢性缺氧大鼠肺动脉平滑肌细胞钾离子通道的作用
张一飞,郭守利,刘 晔,朱大岭
(1.哈尔滨医科大学第二临床医学院药学部,哈尔滨 150086;2.哈尔滨医科大学第二临床医学院实验动物中心,哈尔滨 150086;3.哈尔滨医科大学药学院,哈尔滨 150086)
肺血管收缩反应增强和结构重建是低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)的重要特征,其主要表现形式是肺血管收缩和中膜平滑肌细胞的增殖和迁移,但其机制尚未明确。近来关于花生四烯酸(arachidonic acid,AA)及其一系列代谢产物在肺动脉收缩节律的调节作用越来越受到人们的关注。15-酮基二十碳四烯酸(15-KETE)是AA的15-脂质氧化酶(15-LO)一种代谢终产物,同时也是AA的15-LO另一种代谢产物15-HETE脱氢氧化产物[1,2]。有研究表明缺氧可上调肺动脉平滑肌细胞15-LO的表达[3],因此缺氧时AA的代谢产物有其相应的细胞分布及相应的作用位点。
电压门控钾通道(KV)作为肺动脉平滑肌细胞的氧感受器,在缺氧性肺动脉高压发病中的重要性越来越受到重视。有研究报道15-HETE通过抑制Kv通道引起肺动脉收缩[3],15-KETE对大鼠肺动脉环的收缩作用比15-HETE更强烈[4],其收缩作用依赖于Kv通道、细胞外液钙离子和L-型钙离子通道[5],外源性15-KETE能浓度依赖性地抑制常氧大鼠PASMCs IK[6]V。本实验观察了15-KETE对缺氧大鼠PASMCs IKV的影响,并与其对常氧大鼠PASMCs IKV的作用加以比较,为进一步阐明15-KETE收缩肺动脉离子通道机制提供依据。
1 材料和方法
1.1 材料
1.1.1 实验动物:12只健康雄性SD大鼠,体重200±20g,由哈尔滨医科大学实验动物学部提供[SCXK(黑)2006-033]。
1.1.2 药品与试剂:胶原酶I型,弹性酶,BSA,TEA,Na2ATP,Na2GTP,HEPES和BAPTA(Sigma,美国);DTT(Roche,美国),15-KETE(Biomol,美国),其余试剂均为国产分析纯产品。
1.1.3 主要仪器:体视解剖显微镜(SMZ-168,Motic),膜片钳仪,Axopatch 200B,USA;数-模转换器,DigiData 1322A,USA;Olympus IX-70倒置显微镜,Japan;三维液压推进仪,Narishige Co LTD,Japan;微电极拉制仪,Narishige Co LTD,Japan。
1.1.4 液体配制:(1)生理盐溶液(physiological salt solution,PSS):成分(mmol/L):NaCl 130、KCl 5、MgCl21.2、CaCl21.5、HEPES 10和glucose 10;分离细胞用无钙PSS液,CaCl2由等摩尔的MgCl2取代,用NaOH调pH7.4。(2)灌流液:同PSS液,记录Kv时含1mmol/L TEA灌流液,灌流速度为1mL/min。(3)电极内液(Pipette solution,mmol/L):KCl 125,Na2ATP 5,Na2GTP 0.5,MgCl24,CaCl22,HEPES 10,BAPTA 10),5mol/L KOH调至pH 7.2,GTP提供信号转导通路的底物,ATP一方面提供能量代谢所需底物,一方面抑制IKATP。
1.2 方法
1.2.1 动物模型的制作:参见文献[7],将12只健康雄性SD大鼠,随机分为两组(n=6),一组置于正常的培养箱中,其吸入氧(FiO2)浓度为21%,作为正常组;一组置于缺氧的培养箱中,其吸入氧浓度为10%,连续饲养9d,培养箱内大鼠呼出的CO2、水蒸气分别用氧化钙和无水氯化钙吸收,排出的氨气由硼酸吸收,大鼠自由采食和饮水。
1.2.2 大鼠肺动脉压力和右心室肥厚的检测:饲养9d后,大鼠经1.5%戊巴比妥钠(40mg/kg)腹腔注射麻醉后,固定于手术台上,分离出右外颈静脉并剪一小切口,插入聚乙烯导管经右心室至肺动脉,另一端接压力感受器,以RM-6000型多导生理仪测定肺动脉平均压(mPAP)。然后剖胸取出大鼠心脏,剪去心房组织,沿室间隔边缘分离右心室(RV)和左心室+室间隔(LV+S),将残血冲静后,用滤纸将水吸干,自然干燥片刻后,称量RV和LV+S,以RV/(LV+S)比值反映右心室肥厚程度。
1.2.3 大鼠单个肺动脉平滑肌细胞的急性分离[8]:SD大鼠经1.5%戊巴比妥钠(40mg/kg)麻醉后,迅速开胸取出心和肺,放入盛有4℃的生理盐溶液的烧杯中洗去血液,剪下肺叶移入冰浴盛有生理盐溶液硅胶板的培养皿中,用大头钉把肺叶固定在硅胶板上,体视显微镜下分离肺内小动脉(内径300~700μm),放入含1.5mg/mL胶原酶的生理盐溶液中孵育20min,用显微外科剪刀细心的剥离掉肺动脉外的一薄层结蒂组织及外膜,沿长轴剪开,用湿棉球轻擦去除内皮,以上过程均通以95%O2和5%CO2,剩下的平滑肌剪成1mm×1mm的组织块,然后用含2.0mg/mL胶原酶和0.5mg/mL弹性酶的生理盐溶液37℃消化45min,用吸管轻轻吹打,使之分散成单个细胞。分离好的细胞悬液置于4℃冰箱保存,6h内可用于膜片钳实验。
1.2.4 全细胞膜片钳实验[9]:取几滴细胞悬液于细胞池,静置20~30min,使细胞充分贴壁,然后平放在倒置显微镜上,选取胞膜光滑,胞核清晰,胞浆均匀的细胞进行膜片钳实验。记录电极用玻璃毛细管,经电极拉制仪两步法拉制成微电极,阻抗为3~5MΩ。采用全细胞膜片钳记录方法,在电流钳下记录细胞膜电位(Em),在电压钳下记录Kv电流。记录电流时,钳制电压为-60mV,给予从-60mV至+50mV,阶跃电压为10mV,脉冲时间为400ms的去极化刺激12次,频率为0.2Hz;信号采集频率:10kHz,滤波频率:2kHz。采样后数据由pClamp7.0软件自动记录,存储于计算机硬盘内供测量分析。细胞外给药采用排管给药法,即通过三维操纵器移动快速换药装置的排管进行,排管每管直径为0.2mm,管口距所记录的细胞约100μm。所有的实验均在室温(22℃~24℃)进行。
1.2.5 数据处理:抑制率的计算:抑制率=(用药前的峰电流值-用药后的峰电流值)/用药前的峰电流值×100%。所有结果用±s表示,采用SAS软件进行统计学分析,自身对照用配对t检验,组间资料的比较用非配对t检验,用Origin7.5软件包作图。
2 结果
2.1 慢性缺氧大鼠模型的建立
检测结果表明,经过9d饲养后,缺氧组大鼠mPAP、RV、RV/(LV+S)均显著高于对照组,显示慢性缺氧大鼠模型复制成功(表1)。

表1 慢性缺氧大鼠的肺动脉平均压和右心室/(左心室+室间隔)的变化(n=6)Tab.1 The change of mPAP and RV/(LV+S)of rats exposed to chronic hypoxia(n=6)
2.2 慢性缺氧对大鼠PASMCs影响
2.2.1 慢性缺氧对大鼠PASMCs Em、Cm影响:分别在电流钳制模式、斜坡刺激模式记录正常组和缺氧组大鼠PASMCs静息膜电位(Em)、膜电容(Cm)的变化,结果发现慢性低氧可明显引起PASMCs去极化,但对PASMCs的Cm并没有显著的影响(表2)。

表2 慢性缺氧对大鼠PASMCs Em、Cm的影响(n=6)Tab.2 Effect of chronic hypoxia on Em,Cm in rat PASMCs(n=6)
2.2.2 慢性缺氧对PASMCs IKV的影响:在电压钳模式下记录正常组和缺氧组大鼠PASMCs全细胞电压门控钾电流(IKV)的变化,结果发现低氧明显抑制IKV,-20mV时电流从(26±6)pA/pF降至(21±3)pA/pF,+50mV时从(136±24)pA/pF降至(98±12)pA/pF,(P<0.01,n=6),抑制率分别为(20.1±1.2)%和(28.4±2.4)%(图1)。从全细胞电流图及I-V曲线可以看出,低氧并没有改变IKv的活化阈值及基本电流特征。
2.3 15-KETE、4-AP、TEA对慢性低氧大鼠PASMCs的影响
2.3.1 15-KETE、4-AP、TEA对慢性低氧大鼠PASMCs Em和Cm的影响:分别在电流钳制模式和斜坡刺激模式下记录大鼠PASMCs静息膜电位(Em)和膜电容(Cm)。分别在用药前1min,用药时2min和用药后3min记录15-KETE(1×10-8mol/L、1×10-7mol/L、1×10-6mol/L)、TEA(1×10-3mol/L)对慢性低氧大鼠PASMCs Em和Cm的影响。结果发现15-KETE、4-AP、TEA对慢性低氧大鼠PASMCs Cm无影响(表3);15-KETE、4-AP均可引慢性低氧大鼠PASMCs起PASMCs去极化,TEA对慢性低氧大鼠PASMCs Em无影响(表2)。
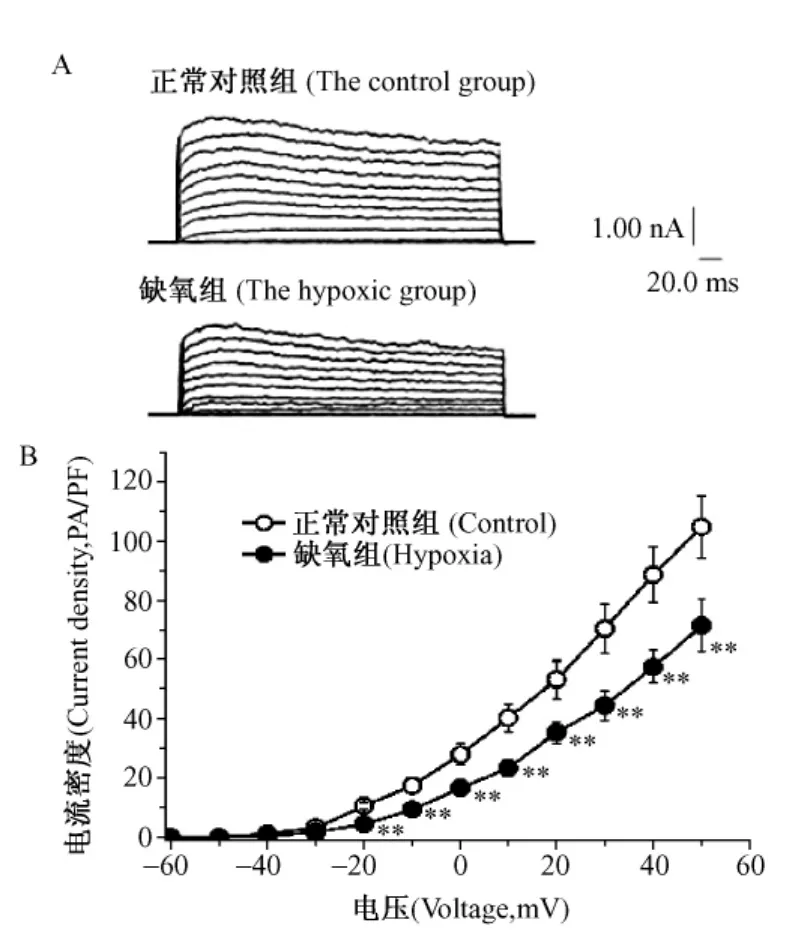
图1 慢性缺氧对PASMCs IKV的影响Fig.1 Effect of chronic hypoxia on KVcurrent in PASMCs
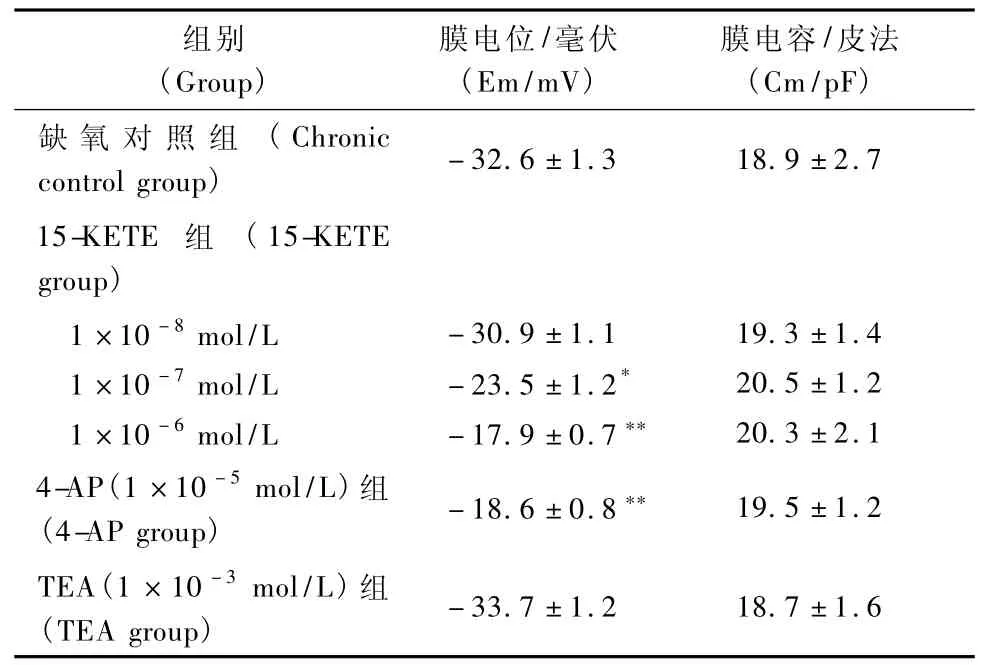
表3 15-KETE、4-AP、TEA对慢性低氧对大鼠PASMCs Em和Cm的影响(n=6)Tab.3 Effect of 15-KETE、4-AP,TEA on Em,Cm in chronic hypoxic rat PASMCs(n=6)
2.3.2 15-KETE对慢性缺氧PASMCs IKV的影响:采用排管给药法观察各浓度(1×10-8~1×10-6mol/L)15-KETE对IKV的影响。结果表明,15-KETE于3min内作用稳定,每间隔3min给一个药物浓度,结果发现15-KETE对IKV的影响呈浓度依赖性抑制,随着浓度的增加,15-KETE使其I-V曲线明显下移(图2)。
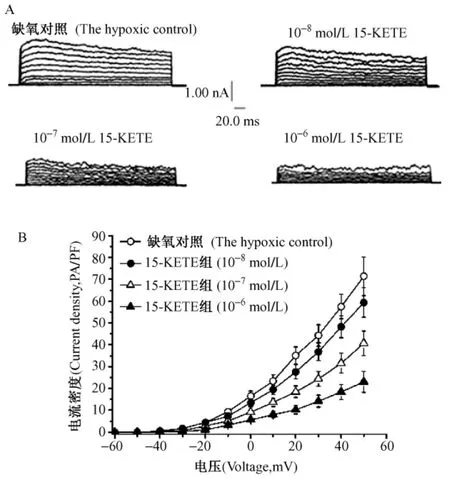
图2 不同浓度的15-KETE对慢性缺氧大鼠SMCs的IKV影响Fig.2 Effect of varying concentration of 15-KETE on IKv of PASMCs
2.3.3 15-KETE对正常和慢性缺氧大鼠PASMCs的IKV抑制率的比较:在急性分离的正常和缺氧的大鼠肺动脉平滑肌上,封接破膜形成全细胞记录方式,将膜电位钳制在-60mV,给予-60mV至+50mV(步幅为10mV)去极化方波刺激,于封接破膜形成全细胞记录后第1min在浴槽内采用排管给药法观察各浓度下(1×10-8~1×10-6mol/L)15-KETE对常氧、慢性缺氧PASMCs IKV的影响。15-KETE约于3min内作用稳定,每间隔3min给一个药物浓度,结果发现在两种情况下15-KETE对IKV的影响呈浓度依赖性抑制。低浓度15-KETE(1×10-8mol/L)对常氧、慢性缺氧PASMCs IKV的平均阻抑率无显著差异。较高浓度15-KETE(1×10-7、1×10-6mol/L)对缺氧PASMCs IKV的平均阻抑率显著高于常氧PASMCs(图3)。
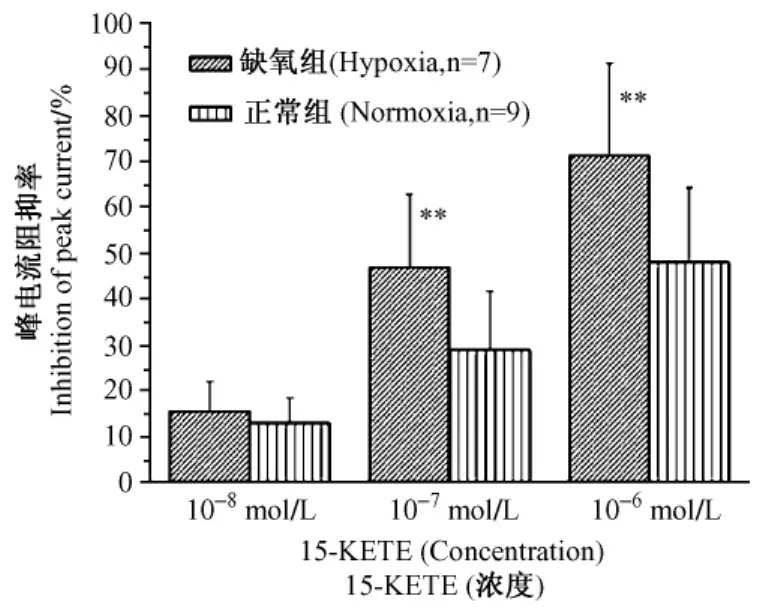
图3 15-KETE对正常和慢性缺氧大鼠PASMCs的IKV抑制率的比较Fig.3 Comparison of IKVinhibition induced by 15-KETE on rat PASMCs from normoxia and chronic hypoxia
3 讨论
已知大鼠PASMCs至少上存在3种钾通道,分别是延迟整流钾通道(Kv)、钙激活的钾通道(KCa)和ATP敏感的钾通道(KATP),目前的研究表明,Kv在控制静息膜电位及氧感受方面起着重要的作用[10]。
本研究表明,在常氧和低氧两种情况下,Kv阻断剂4-AP均可引起PASMCs去极化,即Em负值升高,且这种变化在常氧和低氧时无差异,这说明低氧并没有改变Kv在控制Em方面的基础作用。而特异性的KCa阻断剂TEA无论在常氧还是低氧情况下对Em均无影响,说明KCa对调节Em不起作用,这可能是因为KCa的激活电位高于Em所致[11]。
本研究结果表明,慢性低氧大鼠PASMCs Kv通道电流密度明显减少,但单位细胞的电容即表面积无明显变化,提示单位细胞的Kv通道电流幅度降低是电流密度变化的主要原因。但也有报道低氧对IKv无影响[12],这可能是因为培养的细胞与新鲜急性酶分离的细胞离子通道的特性发生了变化,抑或是因为动物的种属、体内或体外缺氧的不同,以及后者的PASMCs来源于主肺动脉所致。本研究中PASMCs来源于肺内动脉4~6级分支,而这些动脉中Kv细胞占优势[11]。低氧抑制PASMCs IKv的机制目前尚未阐明,这可能是因为低氧引起PASMCs表型转化、PKC上调、抑制了低氧敏感性钾通道的表达[13],或是通过其他影响PASMCs增殖的转录因子,间接抑制IKv,如c-jun的过度表达不仅可以抑制PASMCs Kv活性,并可抑制Kv基因的表达[14]。
15-KETE是AA的15-脂质氧化酶(15-LO)一种代谢终产物。由于缺氧可上调肺动脉平滑肌细胞15-LO的表达[3],因此15-KETE在PASMCs有其相应的细胞分布及相应的作用位点。我们先前研究表明,15-KETE以浓度依赖性方式强烈收缩离体肺动脉环[4],并且收缩作用依赖于Kv通道、细胞外液钙离子和L-型钙离子通道[5]。另有研究表明,缺氧抑制PASMCs上的K+通道,主要是Kv通道[15]。因此,15-KETE可能是联系缺氧与Kv通道之间的重要介质。
本研究发现,15-KETE在常氧和慢性低氧时均可引起Em的升高,但升高的程度并无差异,不同的是慢性低氧时,较高浓度15-KETE对IKv的抑制作用明显强于常氧时,这说明低氧可能改变了PASMCs对一些内源性因子的敏感性。
先前的研究已经证明,在有钙的环境中,15-KETE对常氧PASMCs IKv的抑制作用明显增强[6]。因此,本研究中慢性低氧时15-KETE对IKv的抑制作用加强,可能与慢性低氧时PASMCs细胞内钙水平增高有关[16]。
另外,本实验发现慢性低氧及15-KETE对肺动脉平滑肌细胞的Cm没有影响,说明两者均不能改变肺动脉平滑肌细胞的大小。
[1]Bergholte JM,Soberman RJ,Hayes R,et al.Oxidation of 15-hydroxyeicosatetraenoic acid and other hydroxy fatty acids by lung prostaglandin dehydrogenase[J].Arch Biochem Biophy,1987,257:444-450.
[2]Landino LM,Marnett LJ.Mechanism of hydroperoxide reduction by mangano-prostaglandin endoperoxide synthase[J].J Biol Chem,1996,35:2637-2743.
[3]Daling Z,Medhora M,Campbell WB,et al.Chronic hypoxia activates lung 15-lipoxygenase,which catalyzes production of 15-HETE and enhances constriction in neonatal rabbit pulmonary arteries[J].Circ Res,2003,92:992-1000.
[4]郭守利,张嘉保,刘晔,等.15-HETE及其代谢产物对大鼠离体肺动脉环作用的比较[J].中国比较医学杂志,2006,16(12):716-719.
[5]郭守利,张一飞,刘晔,等.15-酮基二十碳四烯酸对大鼠离体肺动脉环的作用[J].中国药理学通报,2006,22(11):1339-1343.
[6]郭守利,张一飞,刘晔,等.15-KETE对大鼠肺动脉平滑肌细胞钾离子通道的作用[J].中国实验动物学报,2007,15(4):275-279.
[7]Baker EJ,Boerboom LE,Olinger GN,et al.Tolerance of the developing heart to ischemia:impact of hypoxemia from birth[J].Am J Physiol,1995,268:H1165-1173.
[8]Platoshyn O,Yu Y,Golovina VA,et al.Chronic hypoxia decreases KV channel expression and function in pulmonary artery myocytes[J].Am J Physiol Lung Cell Mol Physiol,2001,280:L801-L812.
[9]骆红艳,唐明,杜以梅,等.大鼠肺动脉平滑肌细胞的分离及电压门控性钾电流的记录方法[J].微循环学杂志,2005,15:9-11.
[10]Gurney AM,OsipenkoON,MacMillanD,etal.Potassium channels underlying the resting potential of pulmonary artery smooth muscle cells[J].Clin Exp Pharm acol Physiol,2002,29:330-333.
[11]Archer SL,Huang JM,Reeve HL,et al.Differential distribution of elctrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and hypoxia[J].Circ Res,1996,78:431-442.
[12]Peng W,Hoidal JR,Karwande SV,et al.Effect of chronic hypoxia on K+channels:regulation in human pulmonary vascular smooth muscle cells[J].Am J Physiol,1997,272:C1271-1278.
[13]Platoshyn O,Yu Y,Golovina VA,et al.Chronic hypoxia decreases KV channel expression and function in pulmonary artery myocytes[J].Am J Physiol Lung Cell Mol Physiol,2001,280:L801-L812.
[14]Yu Y,Platoshyn O,Zhang J,et al.c-Jun decreases voltagegated K+channel activity in pulmonary artery smooth muscle cells[J].Circulation,2001,104:1557-1563.
[15]Takahashi T,SomaS,Muramatsu M,etal.Discrepant distribution of big endothelin(ET)-1 and ET receptors in the pulmonary artery[J].Eur Respir J,2001,18:5-14.
[16]樊再雯,张珍祥,徐永健.钾通道对大鼠肺动脉平滑肌细胞[Ca2+]i的调节[J].中国病理生理杂志,2004,20:150-153.

