蛋白激发子PeaT1在枯草芽胞杆菌中的分泌表达及重组菌株提高小麦抗旱和促生的作用
王立梅,杨秀芬,曾洪梅,邱德文,郭立华,刘峥
中国农业科学院植物保护研究所 农业部作物有害生物综合治理综合性重点实验室,北京 100081
诱导植物抗病性已经成为植物病害生物防治的重要途径之一,蛋白激发子能够激发植物防御信号反应,通过信号识别和信号转导,调节植物体内一系列基因的表达,启动植物防卫反应,激活植物的免疫系统,调节植物生长代谢系统,促进植物生长[1-2]。PeaT1是作者实验室从极细链格孢菌 Alternaria tenuissima中分离到的一种蛋白激发子 (GenBank Accession No. EF030819),相关研究获得一项中国发明专利[3],peaT1基因在大肠杆菌中的表达产物能提高植物体内相关防卫基因的表达[4-5],促进作物生长,诱导作物产生抗逆性,提高作物的产量与品质[6-8]。
枯草芽胞杆菌对许多植物病原生物具有拮抗作用[9],不仅可以在土壤、植物根际体表等外界环境中广泛存在,而且是植物根、茎部常见的内生细菌。植物内生枯草芽胞杆菌在小麦、水稻、棉花等农作物上显示出很好的病害防治效果[10]。由于枯草芽胞杆菌易于培养、可产生耐热、抗逆芽胞,在生产、剂型加工及在环境中容易存活、定殖与繁殖,已成为一类理想的生防细菌[11]。
通过现代生物技术将外源功能基因导入植物内生枯草芽胞杆菌中,提高其生物功能、扩大防治对象,是增强其应用前景的途径之一。目前已有将Bt cry基因导入植物内生枯草芽胞杆菌,构建杀虫抗病工程菌的报道[12-13]。作者实验室与合作单位将激活蛋白Ap36导入苏云金芽胞杆菌中,获得的重组菌株能诱导植物产生抗病性[14]。但在枯草芽胞杆菌中表达蛋白激发子的研究尚未见报道。
本研究的目的是将蛋白激发子 peaT1基因导入植物内生枯草芽胞杆菌,在信号肽的引导下,使peaT1基因能在枯草芽胞杆菌中进行分泌表达,构建既能在植物体内长期定殖又能促进植物生长、增加植物抗旱能力的重组菌株,从而为PeaT1激发子在农业生产上的应用提供新的途径。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒
枯草芽胞杆菌168,枯草芽胞杆菌WB800由华中农业大学生命科学技术学院赵秀云老师惠赠;大肠杆菌Escherichia coli DH5α、质粒pET28a-peaT1为本实验室保存;大肠杆菌-枯草芽胞杆菌穿梭载体pHY300-PLK由中国农业大学农学与生物技术学院王琦老师惠赠。
1.1.2 主要试剂
各种限制性核酸内切酶、T4 DNA连接酶、Ex Taq DNA聚合酶、DNA marker等均购自TaKaRa公司;溶菌酶、DNA回收试剂盒购自北京天根生化有限公司;所用抗生素为AMRESCO公司产品;蛋白质预染Marker购自Fermentas公司;引物合成及测序由上海英骏生物工程公司完成,其他常规试剂采用进口分装或国产分析纯。
1.1.3 培养基
试验所用培养基为 LB培养基,根据需要分别加入50 mg/L氨苄青霉素,20 mg/L卡那霉素、10 mg/L四环素,用于重组大肠杆菌和枯草杆菌的筛选。
1.2 方法
1.2.1 枯草芽胞杆菌基因组DNA的提取
采用天根生化科技公司细菌基因组提取试剂盒提取枯草芽胞杆菌168基因组DNA,方法参考试剂盒说明书。
1.2.2 引物设计及PCR扩增
P43启动子与 nprB信号肽编码序列的克隆及融合:以枯草芽胞杆菌168 基因组DNA为模板,利用引物 P3和P4扩增P43启动子序列[15];利用 P5和P6扩增中性蛋白酶基因nprB的信号肽编码序列,其中P3、P6中分别引入EcoRⅠ和PstⅠ酶切位点,在P5中将起始密码子 (TTG) 改为ATG,以两者纯化回收后的混合物作为模板,以P3、P6为引物,利用重叠延伸法 (SOE) 扩增[16],将P43启动子和nprB信号肽编码序列融合。peaT1基因序列的扩增:根据已知的 peaT1基因序列设计引物 P1、P2,以pET28a-peaT1质粒为模板扩增peaT1基因,引物中分别引入PstⅠ和HindⅢ酶切位点。将得到的P43与nprB的融合片段及 peaT1基因分别用 PstⅠ酶切,用T4 DNA连接酶连接,得到含有P43启动子和nprB信号肽及peaT1基因的连接产物P43-SP-peaT1。
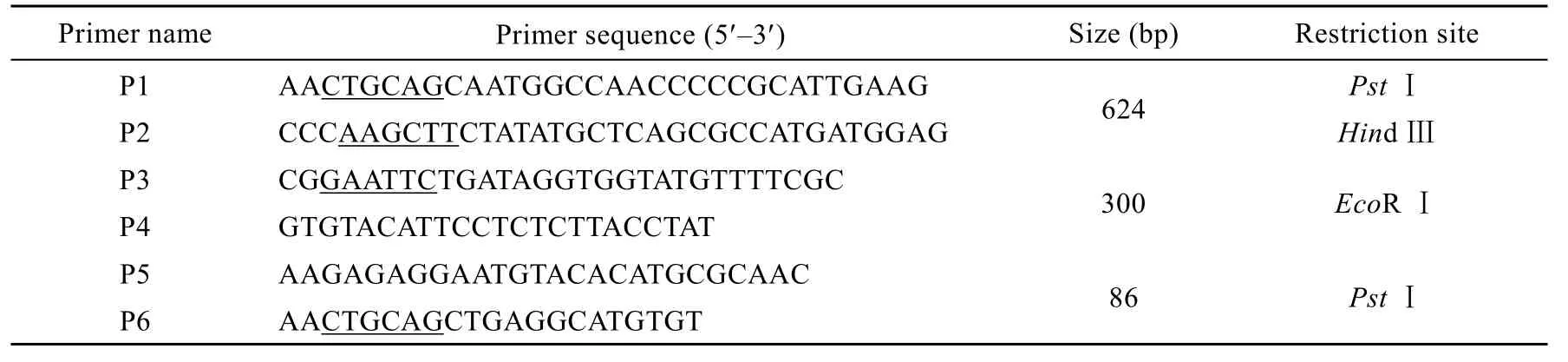
表1 PCR扩增所用引物序列Table 1 Primer sequences for PCR amplification
1.2.3 重组表达载体的构建
上述连接产物经回收纯化后,用EcoRⅠ/HindⅢ进行双酶切。将回收到的酶切产物与同样双酶切的大肠杆菌-枯草芽胞杆菌穿梭载体 PHY300-PLK连接,转化大肠杆菌 DH5α感受态细胞,筛选阳性克隆,提取质粒,鉴定分析后测序,获得重组表达载体pHY43N- peaT1。
1.2.4 枯草芽胞杆菌感受态细胞的制备及转化
将过夜培养的B. subtilis,接入培养基 (LB+山梨醇) 中,37 ℃、200 r/min条件下培养至 OD600= 0.85~0.95,冰上冷却10 min,4 ℃、5 000 r/min离心 5 min收集菌体,用等体积预冷的电击缓冲液(0.5 mol/L山梨醇,0.5 mol/L甘露醇,10%葡萄糖)重悬菌体,离心除去上清,如此漂洗 4次,最后用1 mL电击缓冲液重悬菌体,获得感受态细胞。向60 μL 的感受态细胞中加入重组表达载体pHY43N-peaT1 8 μL (约50 ng),冰上孵育2 min,转入预冷的电转杯中,2.0 kV,2 mm,电击1次,立即加入1 mL LB培养基 (含0.5 mol/L山梨醇和0.38 mol/L甘露醇),37 ℃、200 r/min复苏3 h后,涂布于含四环素的LB 平板,37 ℃过夜培养,观察菌落形态并筛选阳性克隆。
1.2.5 PeaT1在B. subtilis WB800中的分泌表达及检测
将重组菌株和对照菌株 (含空载体质粒) 分别接种于含有四环素的 LB液体培养基中,同时,以不加抗生素培养基培养B. subtilis WB800菌株。37 ℃、200 r/min条件下培养,分别在24、36、48、60、72 h吸取培养液。将上述不同时间取样的培养液进行SDS-PAGE电泳,检测蛋白表达情况,观察显色结果。
1.2.6 Western blotting分析
表达蛋白经SDS-PAGE电泳后,通过BIO-RAD蛋白电转移系统,转移至PVDF膜上,以PeaT1抗体为一抗,辣根过氧化酶标记的羊抗兔抗体为二抗,进行Western blotting分析。
1.2.7 重组菌株的生长曲线测定
分别挑取 B. subtilisWB800和重组菌株WB800-PeaT1的单菌落接种到 LB培养基中 (后者加入四环素),过夜培养,各取5 mL菌液离心收集菌体,用新鲜的 LB培养基洗涤菌体 3次,重悬菌体,测定菌株的 OD600值,然后按 1% (V/V) 的接种量分别接种于无抗生素的 LB培养基中,在37 ℃、200 r/min条件下培养,设3个平行培养,每隔一定时间测定OD600。以光密度转化值lg(1 000× OD600) 为纵坐标,培养时间为横坐标绘制菌株的生长曲线。
1.2.8 重组菌株稳定性测定
将过夜活化的菌株,以 1%的接种量转接于无抗生素LB培养基中,37 ℃培养,再以1%接种量转接于无抗生素的 LB培养基中培养,如此重复培养至60 h,每次稀释后吸取少量培养液涂布无抗生素的LB平板上,37 ℃培养至长出单菌落,随机挑取100个单菌落分别点种于含有抗生素和不含抗生素的LB平板上,37 ℃培养,观察其质粒的丢失情况。同时,分别挑取培养36 h和60 h的克隆子,培养并提取质粒,进行限制性内切酶分析,以检测质粒的存在及其结构稳定性。
1.2.9 重组菌株对小麦幼苗生长及抗旱性的测定
取健康饱满的小麦种子表面消毒后,用无菌水洗涤 5次。在准备好的对照菌和重组菌培养液中浸泡3 h,移栽于装有无菌土的苗钵中,以不接菌的植株作为对照,每处理10株,重复3次。10 d后,测量小麦株高。同时停止补水进行干旱胁迫,待对照70%叶片萎蔫、卷曲后复水,再次干旱胁迫后,再复水,1 d后调查植株叶片抗衰度和幼苗存活率,计算幼苗抗旱综合系数[17]。
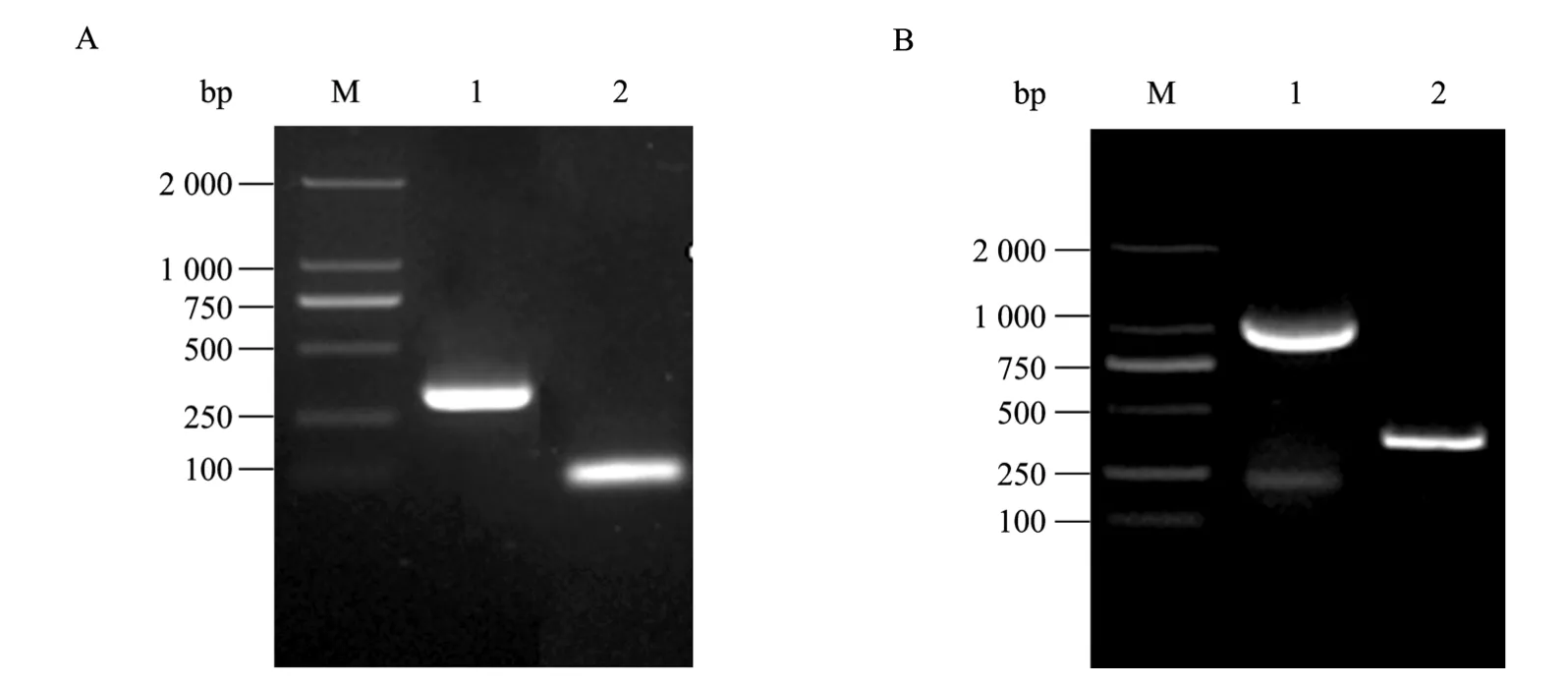
图1 PCR扩增产物的电泳分析Fig. 1 Gel electrophoresis analysis of PCR amplification product. (A) M: DNA marker; 1: PCR product of P43 promoter; 2: PCR product of nprB signal peptide encoding sequence. (B) M: DNA marker; 1: PCR product of recombinant P43-SP-peaT1; 2: overlap extension product of P43 promoter and nprB signal peptide encoding sequence.
2 结果与分析
2.1 重组表达载体的构建
以 P3/P4、P5/P6为引物,从枯草芽胞杆菌总DNA中扩增P43启动子和nprB基因,分别得到了约100 bp信号肽和300 bp启动子片段 (图1A),以两者混合物为模板,利用重叠延伸法扩增到约400 bp左右的融合片段 (图 1B),分别将融合片段和 PCR扩增得到的peaT1基因 (约624 bp) 用PstⅠ进行酶切后,用T4 DNA连接酶进行连接,得到约1 000 bp的含有启动子和信号肽的连接片段 P43-SP-peaT1 (图 1B),测序结果与已知序列一致。将连接产物克隆到大肠杆菌-枯草芽胞杆菌穿梭表达载体pHY300-PLK上,构建了重组表达载体 pHY43N-peaT1。
2.2 重组表达载体和重组菌株的鉴定
将构建好的重组表达载体转化大肠杆菌 DH5α感受态细胞,挑取阳性克隆子进行培养,提取质粒进行酶切鉴定 (图 2),从图 2可以看出,经 PstⅠ/HindⅢ双酶切后可得到624 bp左右的目的片段,与peaT1大小相符,测序结果与已知 peaT1基因序列一致,说明所构建的含有peaT1的重组表达载体正确。
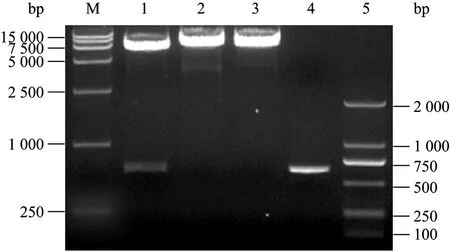
图2 重组表达载体pHY43N-peaT1的酶切鉴定Fig. 2 Identification of recombinant expression vector pHY43N-peaT1 by enzyme digestion. M: DL15 000 marker; 1: pHY43N- peaT1 digested with Pst Ⅰand Hind Ⅲ; 2−3: pHY43N-peaT1 digested with Pst Ⅰor Hind Ⅲ; 4: PCR product of peaT1; 5: DL2 000 marker.
将获得的重组表达载体电击转化 B. subtilisWB800感受态细胞,然后涂布于添加四环素的LB平板上,挑取阳性转化子,用P3/P2引物进行菌落PCR,鉴定阳性克隆 (图3),表明peaT1基因已成功转化到枯草芽胞杆菌WB800中。
2.3 分泌表达蛋白 PeaT1的 SDS-PAGE和Western blotting分析
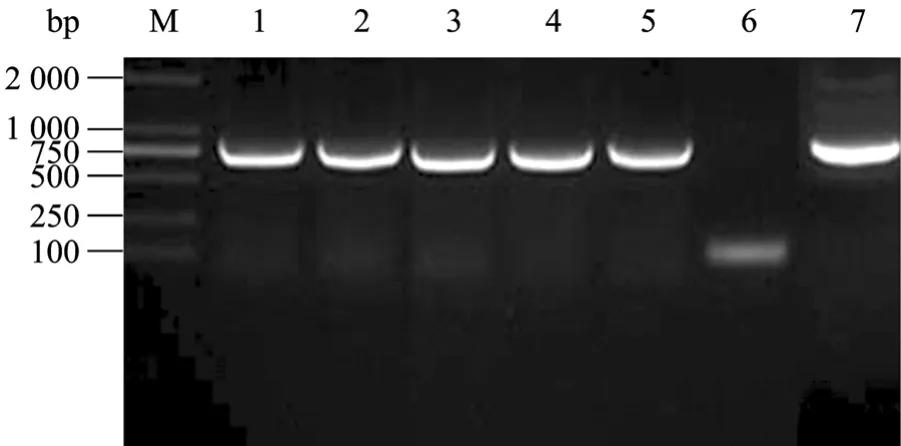
图3 B. subtilis WB800克隆子peaT1片段PCR扩增产物的琼脂糖凝胶电泳Fig. 3 Agarose gel electrophoresis of PCR amplified products of P43-SP-peaT1 from B. subtilis WB800 clones. M: DNA marker; 1−5: PCR product of WB800-peaT1 clones; 6: negative control; 7: PCR product of P43-SP-peaT1.
取不同培养时间的重组菌上清液和对照菌上清液进行SDS-PAGE分析。重组菌上清在35 kDa处出现一条明显的条带,与预期的PeaT1分子量大小相符,而含空载体 B. subtilis WB800和 B. subtilis WB800在35 kDa处无条带 (图4A)。说明在P43启动子的带动和NprB信号肽的引导下peaT1基因表达蛋白成功分泌到培养基中。
为进一步验证 peaT1基因在枯草芽胞杆菌WB800菌株中的分泌表达,对重组表达蛋白进行Western blotting检测 (图 4B),重组菌上清液在35 kDa处出现特异性条带,而对照中并未出现相应的条带,表明在枯草芽胞杆菌中表达的目的蛋白能被兔抗PeaT1抗体所识别,表达产物具有PeaT1蛋白抗原性。由此证明蛋白激发子PeaT1在枯草芽胞杆菌中进行了正确的分泌表达。
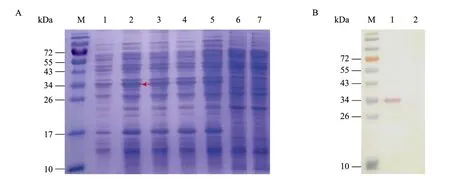
图4 WB800-PeaT1上清液中PeaT1的SDS-PAGE (A) 和Western blotting分析 (B)Fig. 4 SDS-PAGE (A) and Westernblotting analysis (B) of PeaT1 in WB800-peaT1 supernatant. (A) M: protein marker; 1−5: WB800-PeaT1 culture supernatant harvested at 24, 36, 48, 60, 72 h, respectively; 6: WB800 ((pHY300-PLK) culture supernatant; 7: WB800 culture supernatant. (B) M: protein marker; 1: WB800-PeaT1 culture supernatant; 2: WB800 culture supernatant.
2.4 重组菌株 WB800-PeaT1生长曲线及其稳定性
B.subtilis WB800和WB800-PeaT1在LB培养液中的生长动力学曲线如图 5所示。从生长曲线上可以看出,两菌株生长曲线的变化趋势大致相同,B. subtilis WB800在接种后1.5 h进入对数生长期,5 h对数生长期结束,而B. subtilis WB800-PeaT1 2 h时进入对数生长期,比对照菌滞后了0.5 h,对数生长期结束于6 h,比对照菌滞后了1 h,之后两菌株的生长速度基本保持一致。根据生长曲线,计算出B. subtilis WB800和B. subtilis WB800-PeaT1在LB培养液中生长的代时分别为30 min和35 min,说明外源基因的导入对菌体的生理代谢未造成太大的影响。
重组菌株遗传稳定性实验结果表明,重组菌株在连续稀释培养60 h后的遗传稳定性为94% (图6)说明重组质粒在B. subtilis WB800中可以稳定遗传。分别提取培养36 h和60 h时菌株的质粒进行检测,未发现有重排或丢失现象。
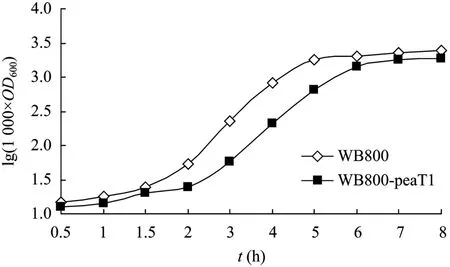
图5 B. subtilis WB800和WB800-peaT1菌株的生长曲线Fig. 5 Growth curve of B. subtilis WB800 and WB800-PeaT1 strain.
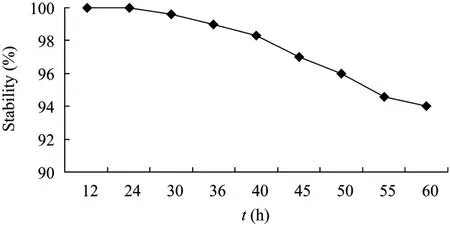
图6 重组菌株稳定性分析Fig. 6 Stability of recombinant strains WB800-PeaT1.
2.5 重组菌株对小麦生长和小麦抗旱的促进作用
用重组菌WB800-PeaT1和WB800处理的小麦,生长10 d后株高明显高于对照 (表2)。WB800比对照提高10.76%,WB800-PeaT1比对照提高26.25%,表明工程菌 WB800-PeaT1比枯草芽胞杆菌WB800对小麦幼苗的促生长效果更加明显,说明导入peaT1后提高了枯草芽胞杆菌WB800促生长的功能。
小麦植株干旱胁迫后,清水和对照菌两组小麦植株均出现萎蔫、叶片干枯现象,而重组菌株处理的小麦大部分仍然保持直立状态。复水处理1 d后,两组对照大部分植株死亡,重组菌株处理的小麦植株存活率达80.87% (表3),而且幼苗抗旱综合指数明显高于对照,说明重组菌株增强了小麦的抗旱性。
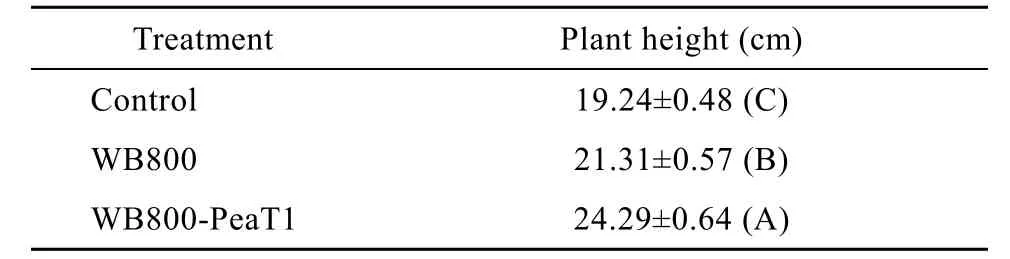
表2 重组菌株对小麦的促生长作用Table 2 Effect of recombinant entophytic bacteria on promoting wheat growth
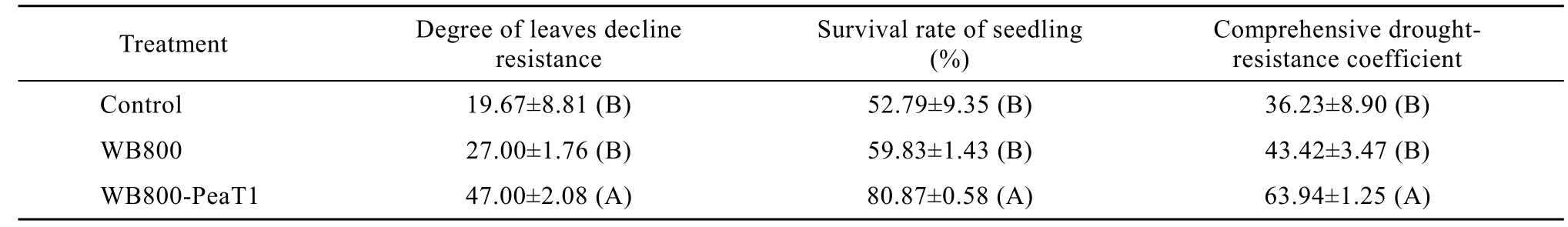
表3 重组菌株对小麦抗旱性的影响Table 3 The effect of recombinant entophytic Bacteria on wheat drought tolerance
3 讨论
枯草芽胞杆菌虽然具有较强的分泌蛋白能力,但是外源蛋白产率往往受到多种因素影响,其中蛋白酶降解是导致外源蛋白低产率的主要因素之一,因此,在野生型枯草芽胞杆菌内表达外源蛋白相当困难。为了提高外源基因的表达量,研究者相继构建了一系列缺失蛋白酶基因的突变体菌株[18]。本研究采用了缺失 8种蛋白酶基因的枯草芽胞杆菌WB800作为实验菌株,更有利于目的基因的分泌表达。本研究构建的重组菌培养24~72 h,培养基中PeaT1蛋白未出现明显降解,含量保持相对稳定。
实现外源基因在枯草芽胞杆菌中的表达,选择合适的信号肽和启动子非常重要。在构建载体时,我们选择了来自蜡样芽胞杆菌的 α-淀粉酶的信号肽和枯草芽胞杆菌自身的 NprB信号肽[19],预备试验结果表明只有 NprB信号肽能引导 PeaT1分泌到培养基中,说明选择宿主本身的信号肽更有利于外源基因的分泌表达。这可能是因为宿主本身的信号肽在引导外源蛋白分泌到胞外的过程中能够被宿主体内一系列与分泌相关的元件所识别[20],最终被信号肽酶切除,而外源的信号肽则不能被识别无法引导外源蛋白的分泌。
在枯草芽胞杆菌表达系统中应用频率最高的启动子有蔗糖诱导的sacB基因的启动子PsacB[21]、组成型表达的淀粉酶基因启动子PamyE[22]和P43启动子[15]等。Ye等研究发现,在应用最多的这几个启动子中,P43启动子的启动强度最大[22]。本研究选用了强启动子 P43和分泌效率较高的 NprB信号肽作为表达元件,构建了大肠杆菌-芽胞杆菌穿梭表达载体pHY43N-peaT1,使peaT1基因在NprB信号肽的引导下在枯草芽胞杆菌WB800中成功的分泌表达。
构建多功能生防工程菌是目前生防微生物的重要研究内容之一,本研究首次尝试在枯草芽胞杆菌中分泌表达蛋白激发子PeaT1,所构建的重组菌株具有促进植物生长和提高植物抗旱性的双重功能,增强了菌株的生防功能,更有利于菌株在生产中的应用,同时该研究为今后构建生防效果更明显、更持久的多功能生防工程菌株提供了可行性的研究方法。
微生物在自然环境中不仅要与周围的微生物菌群产生生存竞争而且会受各种环境变化的影响,包括温度、湿度、氧气和营养条件等。其生长繁殖速度远远低于实验室理想条件,据报道枯草芽胞杆菌在土壤中的代时平均为50~100 h,而实验室条件下代时平均20~30 min[23]。由此可以推断,本研究所得到的重组菌株其遗传稳定性 (60 h),能够持续作用一个生长季节。本研究是在温室条件进行的生物测定,在田间复杂环境下,重组菌株和周围微生物菌群的相互作用以及对生防效果的影响还有待进一步研究。
致谢:感谢华中农业大学生命科学技术学院赵秀云老师惠赠枯草芽胞杆菌168 (B. subtilis 168) 和枯草芽胞杆菌WB800,感谢中国农业大学农学与生物技术学院王琦老师惠赠大肠杆菌-枯草芽胞杆菌穿梭载体pHY300-PLK。
REFERENCES
[1] Nürnberger T, Brunner, F. Innate immunity plants and animals: emerging parallels between the recognition of general elicitors and pathogen-associated molecular patterns. Curr Opin Plant Biol, 2002, 5(4): 318−324.
[2] Nürnberger T, Scheel D. Signal transmission in the plant immune response. Trends Plant Sci, 2001, 6(8): 372−379.
[3] Qiu DW, Liu Z, Yang XF, et al. Gene encoding a protein triggering resistance and promoting growth in plant: Chinese patent, ZL 200610152700.8. 2010-05-19.邱德文, 刘峥, 杨秀芬, 等. 一种提高植物抗性促进植物生长的蛋白质及其编码基因: 中国专利, ZL 200610152700.8. 2010-05-19.
[4] Zhang W, Yang XF, Qiu DW, et al. PeaT1-induced systemic acquired resistance in tobacco follows salicylic acid-dependent pathway. Mol Biol Rep, 2010, 38(4): 2549−2556.
[5] Li GY, Yang XF, Zeng HM, et al. Stable isotope labelled mass spectrometry for quantification of the relative abundances for expressed proteins induced by PeaT1. Sci China Life Sci, 2010, 53(12): 1410−1417.
[6] Zhao MZ, Yang XF, Zhang M, et al. Purification and bioactivities of a protein growth-activator fron Alternaria tenuissima. Chin J Biol Control, 2007, 23(2): 170−173.赵明治, 杨秀芬, 张明, 等. 一种促进植物根系生长的极细链格胞菌蛋白质分离、纯化和生物功能. 中国生物防治, 2007, 23(2): 170−173.
[7] Yang XF, Qiu DW, Zeng HM, et al. Purification and characterization of a glycoprotein elicitor from Alternaria tenuissima. World J Microbiol Biotechnol, 2009, 25(11): 2035−2042.
[8] Mao JJ, Liu Q, Yang XF, et al. Purification and expression of a protein elicitor from Alternaria tenuissima and elicitor-mediated defense responses in tobacco. Ann Appl Biol, 2010, 156(3): 411−420.
[9] Emmert EAB, Handelsman J. Biocontrol of plant disease: a (Gram-) positive perspective. FEMS Microbiol Lett, 1999, 171(1): 1−9.
[10] Msadek T, Dartois V, Kunst F, et al. ClpP of Bacillus subtilis is required for competence development, motility, degradative enzyme synthesis, growth at high temperature and sporulation. Mol Microbiol, 1998, 27(5): 899−914.
[11] Backman PA, Sikora RA. Endophytes: an emerging tool for biological control. Biol Control, 2008, 46(1): 1−3.
[12] Theoduloz C, Vega A, Salazar M, et al. Expression of a Bacillus thuringiensis δ-endotoxin cry1Ab gene in Bacillus subtilis and Bacillus licheniformis strains that naturally colonize the phylloplane of tomato plants (Lycopersicon esculentum, Mills). J Appl Microbiol, 2003, 94(3): 375−381.
[13] Yan GX, Song FP, Shu CL, et al. An engineered Bacillus thuringiensis strain with insecticidal activity against Scarabaeidae (Anomala corpulenta) and Chrysomelidae (Leptinotarsa decemlineata and Colaphellus bowringi). Biotechnol Lett, 2009, 31(5): 697−703.
[14] Zhou CF, Peng DH, Qiu DW, et al. Expressing activator protein Ap36 in Bacillus thuringiensis and the function of recombined strain on disease resistance. J Agric Biotech, 2008, 16(1): 142−147.周臣飞, 彭东海, 邱德文, 等. 植物激活蛋白Ap36在苏云金芽胞杆菌的表达及抗病作用. 农业生物技术学报, 2008, 16(1): 142−147.
[15] Wang PZ, Doi RH. Overlaping promoters transcribed by Bacillus subtilis δ55and δ37RNA polymerase holoenzymes during growth and stationary phases. J Biol Chem, 1984, 259(13): 8619−8625.
[16] Ho SN, Hunt HD, Horton RM, et al. Site-directed mutagenesis by overlap extension using the polymerase chain reaction. Gene, 1989, 77(1): 51−59.
[17] Zhang YH. Purification, Gene Cloning and Functional Research of Activator Protein from Botrytis cinerea[D]. Shenyang: Shenyang Agricultural University, 2008.张云华. 灰葡萄孢菌激活蛋白的纯化、基因克隆与功能研究[D]. 沈阳: 沈阳农业大学, 2008.
[18] Wong SL. Advances in the use of Bacillus subtilis for the expression and secretion of heterologous proteins. Curr Opin Biotechnol, 1995, 6(5): 517−522.
[19] Nagarajna, V, Ramaley R, Albertson H, et al. Secretion of streptavidin from Bacillus subtilis. Appl Environ Microbiol, 1993, 59(11): 3894−3898.
[20] Bron S, Bolhuis A, Tjalsma H, et al. Protein secretion and possible roles for multiple signal peptidases for precursor processing in Bacilli. J Biotechnol, 1998, 64(1): 3−13.
[21] Deuerling E, Paeslack B, Schumnan W. The ftsH gene of Bacillus subtilis is transiently induced after osmotic and temperature upshift. J Bacteriol, 1995, 177(14): 4105−4112. [22] Ye RQ, Kim JH, Kim BG, et al. High-level secretory production of intact, biologically active staphylokinase from Bacillus subtilis. Biotechnol Bioeng, 1999, 62(1): 87−96.
[23] Msadek T. When the going gets tough: survival strategies and environmental signaling networks in Bacillus subtilis. Trends Microbiol, 1999, 7(5): 201−207.

