产α-半乳糖苷酶菌株的筛选、鉴定及其酶学特性的研究
董岩岩 张燕婕 黄遵锡 周峻沛 唐湘华 李俊俊
α-半乳糖苷酶能专一性催化α-D-半乳糖苷键的水解,可以作用于具有α-半乳糖苷结构的碳水化合物,故称α-半乳糖苷酶。具有α-D-半乳糖苷键结构的碳水化合物称α-半乳糖苷类物质。由于单胃动物肠道内缺乏α-半乳糖苷酶,所以α-半乳糖苷类物质在小肠内不能被消化、吸收,进入大肠后,其被大肠杆菌等微生物发酵利用,产生挥发性脂肪酸及CO2、H2和少量的CH4气体,引起胀气、呕吐、下痢等现象,因此,α-半乳糖苷类物质又称抗营养因子。在饲料中添加α-半乳糖苷酶,不仅可以降解不溶性的低聚糖,同时还可以消除肠道的胀气现象,增加动物的采食量。因此,对α-半乳糖苷酶在饲用添加剂中的研究具有非常重大的意义[1-5]。此外,α-半乳糖苷酶在医药、食品工业等领域也有广泛应用,特别是近年来α-半乳糖苷酶在血型改造、异种器官移植及法布里病等方面的应用,显示出诱人的前景[6-9]。为了满足人们生产生活的要求,针对微生物易培养、繁殖快、产物易收集和提纯等特点,我们选择研究微生物源的α-半乳糖苷酶。
由于本试验中的α-半乳糖苷酶是作为酶制剂应用到饲料中,所以需要对该酶进行酶学性质的研究。在饲料加工过程中不可避免地出现的高温,如制粒、膨化过程中的温度可达70~150℃以上[10],从而对酶制剂的应用效果产生影响,因此就需要进行酶的热稳定性的研究。在消化道中,胃的pH值为2.0~3.0,酶在体内起催化作用的部位是小肠,其pH值为6.0左右[11],因此就需要对该酶进行pH值耐受性研究。作为饲料,还要添加多种无机离子,对酶活性有一定的影响,所以还需要研究金属离子对酶活的影响。
综合目前有关微生物源α-半乳糖苷酶方面的文献发现,不同菌种,或同一菌种在不同培养条件下产酶水平相差较大,酶学性质也有差别,其中霉菌类的产酶水平最高。因此,利用筛选培养基获得酶活力较高的一株霉菌并对其所产的α-半乳糖苷酶的酶学性质进行了初步探讨,旨在为α-半乳糖苷酶在饲料与食品中的应用研究提供参考。
1 材料与方法
1.1 材料
1.1.1 样品
不同豆制品作坊附近的土样。
1.1.2 主要试剂
对硝基酚、对硝基酚-α-D-吡喃半乳糖苷(pNPG)2 mmol/l、柠檬酸—磷酸氢二钠缓冲液(pH值3.0~8.0)、Tris碱、SDS、EDTA、PCR试剂。
1.1.3 主要仪器
实验室专用超纯水机CRM-420型、电子天平PL203型、隔水式电热恒温箱PYX.DHS型、电热烘干箱101-2型、分光光度计JH722s型、数显恒温水浴锅Hll-2型、小型台式高速离心机SW-CJ-2FD型、摇床HZ-9310K型、基因扩增仪EDC-810等。
1.1.4 培养基
种子培养基为(g/100 ml):PDA培养基。
初筛培养基为(g/100 ml):Peptone 0.1、NaCl 0.1、豆粕0.5、样品1、琼脂1.6,dH2O 100 ml。
复筛培养基为(g/100 ml):棉籽糖0.5、(NH4)2SO40.5、琼脂1.6,dH2O 100 ml。
发酵培养基为(g/100 ml):豆粕2、(NH)2SO42、KH2PO40.2、MgSO4·7H2O 0.2,dH2O 100 ml。
1.2 方法
1.2.1 产α-半乳糖苷酶菌株的筛选
在无菌条件下,用无菌双蒸水对样品进行逐级梯度稀释(10-1~10-7),吸取10-5、10-6及10-73个梯度各100 μl溶液分别涂布初筛固体培养基上,30℃下培养4~7 d;用接种环将培养出的不同菌种从初筛培养基转接到复筛培养基上培养,检测其是否具有α-半乳糖苷酶活性;然后将有α-半乳糖苷酶活性的菌株在PDA培养基上进行划线分离,并按上述方式重复纯化两次后得到纯菌株;将纯化后的菌种依次转接到发酵培养基中,30℃、150 r/min的条件下培养一定的时间后,对其发酵液进行α-半乳糖苷酶酶活测定;将有活性的菌株加入15%(v/v)甘油后,于-70℃下保存。
1.2.2 酶活力测定pNPG法
1.2.2.1 原理
利用对硝基酚-α-D-吡喃半乳糖(pNPG)与α-半乳糖苷酶反应后,生成有色物质对硝基苯酚(pNPH),测定其含量即可计算出酶活。
1.2.2.2 方法
先加400 μl 2 mmol/l底物pNPG和500 μl缓冲液,在55℃、pH值5.0条件下预热5 min,再加入100 μl酶液反应10 min后,加0.5 mol Na2CO35 ml终止反应,在405 nm下测定OD值。根据标准曲线的公式计算酶活力。
1.2.2.3 酶活单位定义
在一定条件下,每分钟分解底物生成1 μmol对硝基酚所需的酶量为一个α-半乳糖苷酶酶活单位(IU/ml)。
1.2.2.4 标准曲线的制作
以吸光值为横坐标,对硝基苯酚含量为纵坐标绘制标准曲线,每组设三个平行,充分摇匀后于405 nm处比色,0号管为对照管。
对硝基苯酚标准曲线的绘制见表1。

表1 对硝基苯酚标准曲线
1.2.3 D-1基因组总DNA的提取
①将菌种接种于30 ml的PDA液体培养基中,30℃培养2~3 d;
②灭菌纱布过滤得菌丝球,用无菌水冲洗菌丝球2次;
③加入液氮研磨3次后,立即加入提取缓冲液,65℃裂解5 min,12 000 r/min离心10 min,取上清;
④上清液等体积与氯仿混匀,上下摇匀2次,12 000 r/min离心10 min,取上清;
⑤重复步骤④;
⑥上清液加1/10体积的醋酸钠(3 mol/l,pH值5.2)和2倍体积的无水乙醇,-70℃放置2 h,4℃、12 000 r/min,离心20 min,沉淀;
⑦加1 ml 70%的乙醇洗盐,4℃、12 000 r/min,离心10 min,重复一次;
⑧37℃开盖放置10~20 min控干;
⑨加入30 μl TE-RNaseA,37℃放置30 min以上,取5 μl提取物于0.8%琼脂糖凝胶电泳检测提取效果,剩余的提取物-20℃保存备用。
1.2.4 D-1 18SrDNA PCR扩增体系及条件
以提取的D-1基因组为模板,用真菌的ITS1和ITS4引物来扩增D-1的18S rDNA,引物序列为:
ITS1:5’-GGAAGTAAAAGTCGTAACAAGG-3’
ITS4:5’-TCCTCCGCTTATTGATATGC-3’
取5 μl PCR产物进行0.8%琼脂糖凝胶电泳检验。
扩增体系为无菌ddH2O 35.5 μl;10×PCR缓冲液5.0 μl;dNTP混合液(2.5 mmol/l)4.0 μl;引物ITS1(10 pmol/l)2 μl;引物ITS4(10 pmol/l)2 μl;模板DNA 1 μl;TaqDNA聚合酶0.5 μl;总体积50 μl。
扩增条件为94℃预变性4 min、94℃变性30 s、52℃退火30 s、72℃延伸1 min,反应35个循环,最后72℃延伸10 min。
1.2.5 酶学特性的研究
1.2.5.1 温度对酶活性的影响
以pNPG为底物,在pH值5.5,不同温度(20、30、35、40、45、50、55、60、70、80℃)下反应10 min,测定相同的酶液在不同的温度下所具有的酶活力单位,酶活最高的为最适反应温度。
1.2.5.2 pH值对酶活性的影响
以pNPG为底物,温度为55℃,不同pH值条件(3.0、4.0、5.0、5.5、6.0、6.4、7.0、8.0)下反应10 min,测定相同的酶液所具有的酶活力单位,酶活最高的为最适反应pH值。
1.2.5.3 α-半乳糖苷酶的pH值稳定性
将原酶液在不同pH值(3.0、4.0、5.0、5.5、6.0、6.4、7.0、8.0)的缓冲液中于37℃下保温1 h,在最适条件下测定酶残余活性以研究酶的pH值稳定性。以未处理的酶液的酶活为100%计。
1.2.5.4 α-半乳糖苷酶的热稳定性
将原酶液在不同温度(40、50、55、60℃)保温30、60 min,在最适条件下测定酶残余活性以研究酶的热稳定性。以未处理的酶液的酶活为100%计。
1.2.5.5 金属离子对酶活力的影响
用浓度为0.01 mol/l的金属离子Mg2+、Na+、Ca2+、K+、Fe3+、Al3+、Co2+、Cu2+、Zn2+、Pb2+、Mn2+、EDTA分别与原酶液以1∶1的比例进行混合,37℃保存1 h后,分别在最适条件下进行酶活的测定。以未处理的酶液的酶活为100%计。
2 结果与分析
2.1 酶活力计算公式
根据pNPH标准曲线(见图1)得到回归方程,从而得到α-半乳糖苷酶酶活力。
酶活力(IU/ml)=(0.350 4X+0.000 4)×n/(T×V)。式中:X——吸光度;
n——酶液稀释倍数;
V——稀释后反应中的加酶量(ml);
T——酶-底物反应时间(min)。
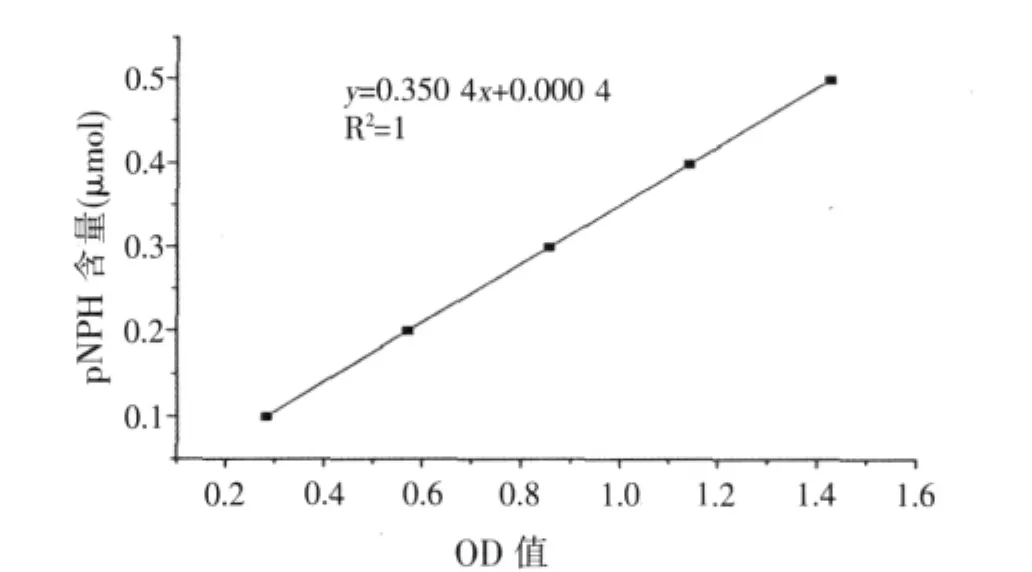
图1 标准曲线
2.2 产α-半乳糖苷酶菌种的筛选(见图2)
利用筛选培养基从20个不同豆制品作坊附近的土样中筛选得到7株产α-半乳糖苷酶的菌株(如图2),从中选取一株产α-半乳糖苷酶酶活最高的菌株D-1并进行酶学特性研究。

图2 不同菌株酶活力的比较
2.3 α-半乳糖苷酶的酶学性质研究
2.3.1 温度对酶活力的影响(见图3)
在不同温度梯度、pH值5.5的条件下,以pNPG为底物,反应10 min后,测定酶活。结果如图3,酶活性随温度的升高而提高,在最适反应温度处酶活力最高,超过这一温度,酶活力便急剧下降。因此,α-半乳糖苷酶的最适作用温度为55℃,当温度超过55℃,酶活显著降低。

图3 温度对酶活力的影响
2.3.2 pH值对酶活力的影响(见图4)

图4 pH值对酶活力的影响
在不同pH值、55℃条件下,以pNPG为底物,反应10 min后,测定酶活。结果如图4,α-半乳糖苷酶在pH值3.0~5.5之间表现较高的酶活力,说明该酶较耐酸,并且其反应最适pH值为5.0左右。碱性条件则不同程度地抑制酶活。
2.3.3 α-半乳糖苷酶的pH值稳定性(见图5)

图5 α-半乳糖苷酶的pH值稳定性
由于动物消化道食糜的pH值变化范围比较大,所以单纯考虑在某一pH值条件下的酶活值并不全面,最好能测定该酶在比较广泛的pH值范围内的酶活表现。因此,将酶液在不同pH值的缓冲液中于37℃下保温1 h,在55℃、pH值5.0条件下测定酶残余活性。结果如图5,表明在pH值3.0~5.5范围内保持64.1%以上的酶活,其中在pH值5.0条件下耐受1 h酶活只下降了11%左右。在消化道中,胃的pH值为2.0~3.0左右,酶在体内起催化作用的部位是小肠,其pH值为5.0~6.0左右。所以该酶在动物肠道中可发挥其作用,能很好的应用到动物饲料中。
2.3.4 α-半乳糖苷酶的热稳定性(见图6、图7)

图6 α-半乳糖苷酶的热稳定性
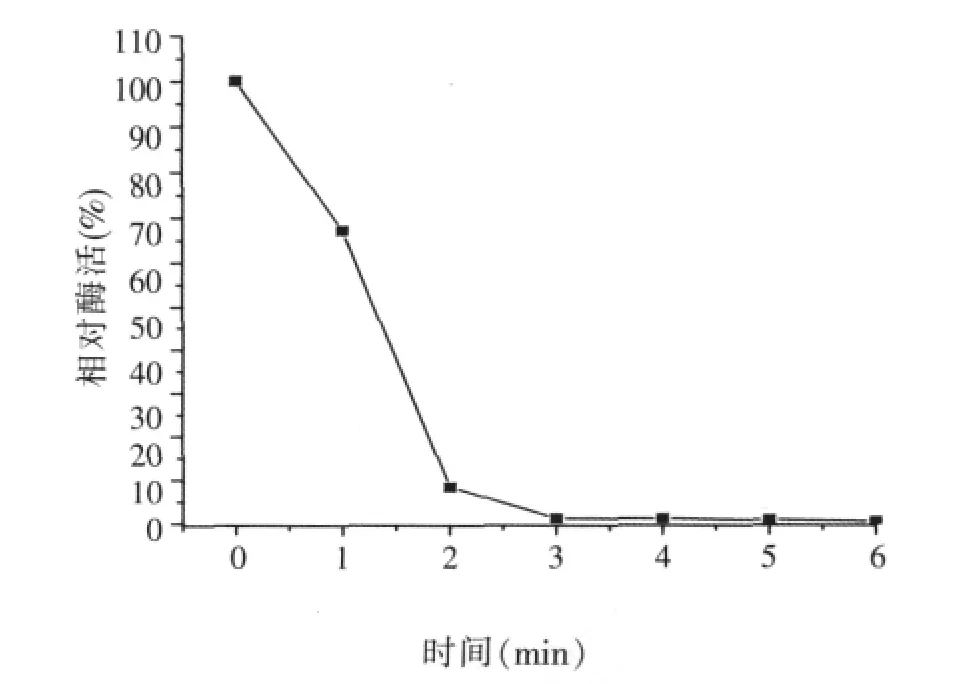
图7 α-半乳糖苷酶的热稳定性(70℃)
将酶液分别在45、50、55、60℃下,保温30、60 min,随着温度的升高和放置时间的延长,酶活保留率降低(如图6),在60℃以下存放稳定性较好。在45、50、55℃中耐受30 min至60 min,酶活下降趋势平缓。60℃保温0.5 h,酶活剩余44.6%,60℃保温1 h,酶活剩余37.2%。此外,还做了在70、80℃下的耐受性试验,70℃下1 min时酶活剩余67.2%,2 min后酶活完全消失(如图7),80℃下酶活完全消失,说明该菌产的酶不够耐热。饲料加工制粒、膨化过程中的温度可达70~150℃以上,所以饲料加工时可在加热后进行添加,如制成液体酶制剂于饲料调质制粒后在颗粒表面进行喷涂。
2.3.5 金属离子对酶活力的影响(见图8)

图8 金属离子对酶活力的影响
原酶液在不同种类的金属离子中耐受1 h后,大多数金属离子对α-半乳糖苷酶均具有不同程度的抑制作用,其中Cu2+和Fe3+的抑制作用较为明显,而Ca2+、EDTA、Zn2+对α-半乳糖苷酶有一定的促进作用,所以在添加酶制剂时尽量避免与铁器、铜器长时间接触。
2.4 D-1基因组DNA的提取(见图9)
提取的D-1基因组DNA经0.8%琼脂糖凝胶电泳鉴定结果,说明提取的总DNA纯度良好。
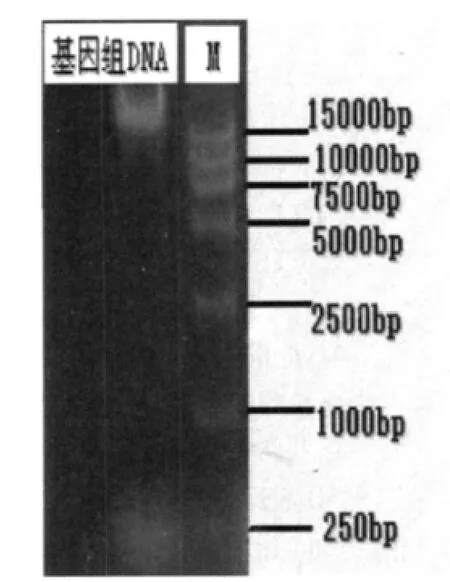
图9 D-1基因组DNA电泳图
2.5 D-1 18S rDNA基因获得
用D-1的基因组DNA为模板进行18S rDNA PCR,PCR扩增产物经琼脂糖凝胶电泳结果见图10,PCR扩增所产生的DNA片段为单一条带,片段大小在600 bp左右。

图10 D-118S rDNA的扩增片段
2.6 D-1 18S rDNA基因的序列分析及进化树的构建(见图11)
测序得到完整的18S rDNA序列,将此序列与NCBI上已有序列进行Blast比对,发现其18S rDNA与多数Aspergillus niger同源性达到99%,用MEGA4和BioXM对目的序列进行比对和聚类分析构建系统进化树,从图11可以看出,D-1与Aspergillus niger聚为一类,且与Aspergillus niger AB369898.1有最大的同源性,遗传距离几乎为0,因此可初步确定D-1属于Aspergillus niger。
3 讨论
在关于产α-半乳糖苷酶的微生物的文献中发现,霉菌等真菌类微生物的α-半乳糖苷酶的产量较高,因此,本研究直接从样品中筛选真菌,筛选出酶活最高的一株霉菌D-1,通过对D-1进行液体发酵获得原酶液的最大酶活为3.48 IU/ml,将粗酶液进行离心后对其进行酶学性质的研究。
经研究发现,该酶的最适反应温度是55℃,最适反应pH值为5.0,与已报道的黑曲霉α-半乳糖苷酶的最适反应温度是60℃,最适反应pH值为4.5的结果有差异[12]。该酶在液体状态下热稳定性较好,60℃以下条件都很稳定,在70、80℃下的耐受性差,说明该菌产的α-半乳糖苷酶不够耐热,饲料加工时可在制粒后进行液体喷涂[13];在pH值3.0~5.5范围内保持64.1%以上的酶活,其中在pH值5.5条件下耐受1 h酶活只下降了11%左右,因此,此酶可以应用于动物饲料中。在金属离子及EDTA对酶活影响的试验中,发现Ca2+、EDTA、Zn2+对α-半乳糖苷酶有一定的促进作用,而Cu2+和Fe3+的抑制作用较为明显,所以在添加酶制剂过程中尽量避免与铁器、铜器长时间接触。
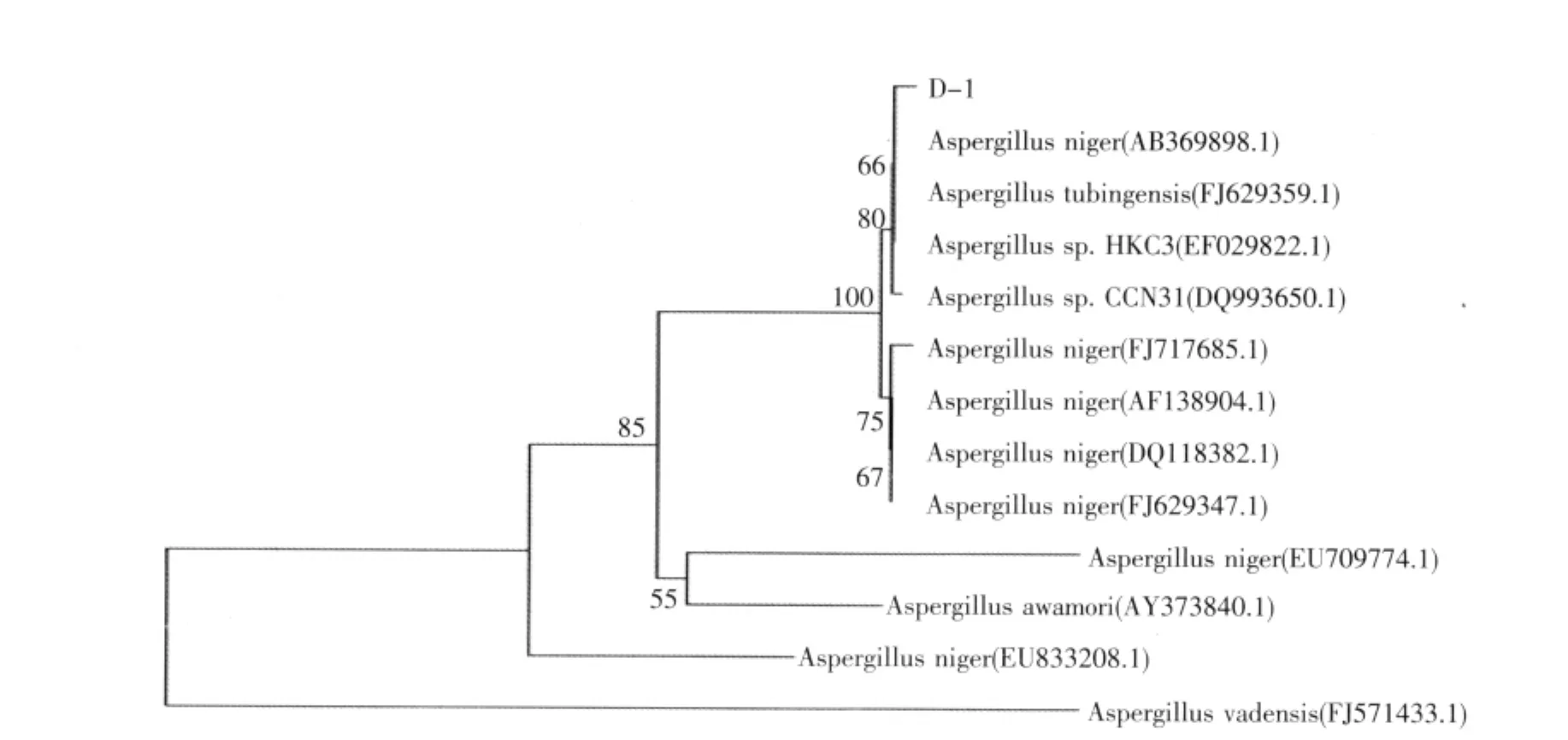
图11 菌株NJY-1 18S rDNA的进化树
[1] 张晋辉.畜禽日粮中的α-半乳糖苷以及相应酶制剂的应用[J].中国农业技术早报,2003,3(1):49-54.
[2] 于桂阳.α-半乳糖苷酶制剂在猪日粮中的应用[J].饲料工业,2006,27(18):46-48.
[3] 许尧兴,许少春,李艳丽,等.在玉米-豆粕型日粮中添加α-半乳糖苷酶对生长猪生产性能的影响[J].饲料工业,2008,29(4):9-10.
[4] Leske K L,C.J.Jevne,C.N.Coon.Extraction methods for removing soybean alpha—galactosides and improving true metabolizable energy for poultry[J].Anim.Feed Sci.Technol.,1993(b),41:74-78.
[5] 蒋小丰,方热军.α-半乳糖苷酶在畜禽日粮中的应用研究[J].饲料工业,2009,30(10):18-21.
[6] 吴劲松,冯万祥.α-半乳糖苷酶[J].生命的化学,2000,20(2):84-86.
[7] 李孝辉,陈声明.微生物源α-半乳糖苷酶的研究进展[J].微生物学通报,2002,29(2):71-75.
[8] 高新.α-半乳糖苷酶及其在输血等方面的应用[J].中国实验血液学杂志,2000,8(3):236-239.
[9] 崔文.α-半乳糖苷酶的医学研究进展[J].中外医疗,2007(19):56-57.
[10] 邱万里.关于饲料制粒工艺中要素的控制[J].粮油加工与食品机械,2002(8):51-52.
[11] 我国饲用酶制剂应用现状与问题[J].河北畜牧兽医,2000,16(7):8.
[12] 许尧兴,李艳丽,柳永,等.黑曲霉变种RM48α-半乳糖苷酶的分离纯化及其酶学性质研究[J].浙江大学学报,2009,35(2):147-152.
[13] 史宝军.饲用添加剂剂型制备及加工工艺技术创新[J].饲料与畜牧,2008(4):39-42.

