日粮精粗比与维生素A添加水平对奶牛体外瘤胃发酵参数的影响
鲍宏云 闫素梅 乔良 倪丽丽 高民 成海荣
维生素A是奶牛重要的微量营养素之一,是调节基因表达,促进胚胎发育,增强机体免疫,维持正常视觉及上皮细胞完整性所不可缺少的低分子有机化合物(Gudas等,1994)[1],因此,在日粮中添加适宜剂量的维生素A充分满足维生素A的需要对奶牛是非常重要的。瘤胃在反刍动物消化和吸收营养物质过程中起着重要的作用,其发酵是保证反刍动物正常生命活动的重要因素。一些研究发现反刍动物日粮中的维生素A只有一部分进入小肠(Fernandez,1976)[2],另一部分维生素A在经过瘤胃时被降解(Rode等,1990)[3]。Weiss等(1995)[4]的研究指出维生素A的降解与日粮精粗比有关,且高精料日粮条件下维生素A在瘤胃内有较高的降解率。乔良亦指出(2007)[5]维生素A的降解率与精粗比及添加剂量有关。因此,在实际生产中人们通常采用提高维生素A添加量、饲喂过瘤胃保护维生素A或肌肉注射维生素A等方法来满足反刍动物机体维生素A的需求。但是这些方法均会影响反刍动物瘤胃内维生素A的含量。而关于瘤胃内维生素A含量的改变是否会对瘤胃发酵造成一定影响的报道却相当有限。鉴此,本试验拟利用体外批次培养法,研究不同日粮精粗比、不同来源及添加水平的维生素A对瘤胃发酵的影响,进而为实际生产中合理选用维生素A的补加方法提供理论支持。
1 材料与方法
1.1 试验动物与饲养管理
选择3头健康、体重相近、安装有永久瘤胃瘘管,并且处于干奶期的荷斯坦奶牛作为瘤胃液的供体牛。供体牛每日早7点和晚7点两次饲喂,饲喂结束后挤奶自由饮水。
1.2 试验日粮
试验日粮参照中国奶牛饲养标准(2004)配制,其组成和营养水平见表1。
1.3 维生素A源
VA 由罗氏(上海)维生素有限公司生产,以维生素A醋酸酯微粒形式存在,效价:50万IU/g。
1.4 试验设计
本试验采用2×3完全随机试验设计,第一因素为培养底物的精粗比,设2∶8和5∶5两个水平,第二因素为维生素A的添加剂量,设低、中、高3个水平,分别为每毫升培养液中5.8、11.7、23.3 IU。试验共分6个处理组,每处理组于体外培养开始后的4、8、12、24 h四个时间点取样,每个时间点3个重复。
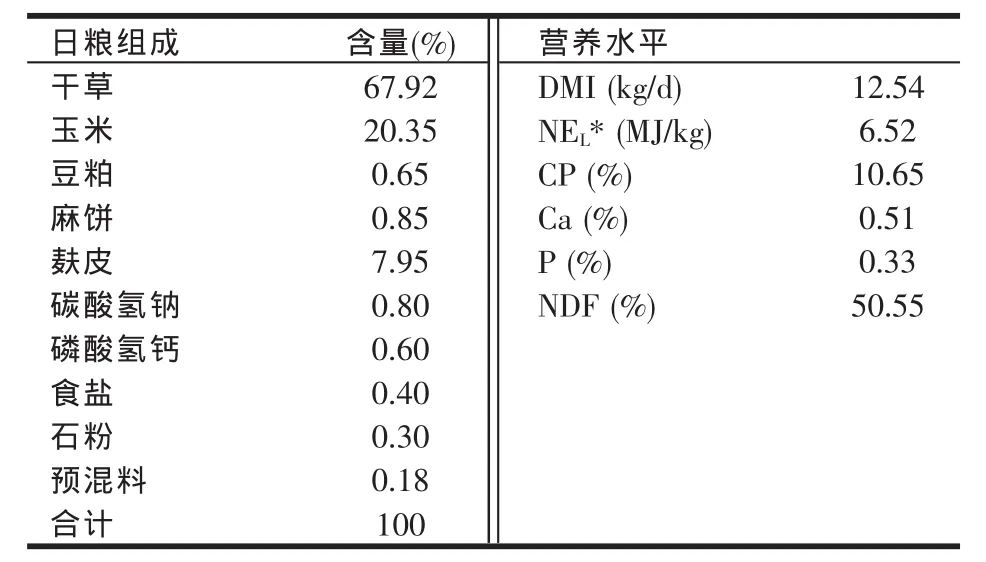
表1 基础日粮组成及营养水平(DM基础)
1.5 体外培养装置
体外批次培养装置自行设计,用150 ml培养瓶,瓶口安装橡皮塞,主体为恒温水浴摇床,水浴温度和振荡频率可调。
1.6 瘤胃液的采集
于晨饲前采集瘤胃液,迅速将样品倒入已预热达39℃并通有CO2的保温瓶中,并且使3头奶牛的瘤胃液等量混合,经两层纱布过滤后,加入到预先装有缓冲液和培养底物的培养瓶中备用。
1.7 体外培养液的制备
体外批次培养的培养体系为60 ml,其中瘤胃液与缓冲液的比例为1∶2,缓冲液的配制及体外培养操作过程参照卢媛(2002)[6]的方法进行。体外培养过程中所用培养底物分为高精料与低精料两组,两组的精粗比分别为5∶5和2∶8。培养底物添加量为0.5 g。体外培养底物组成见表2。

表2 体外培养底物组成(DM基础)
1.8 测定指标与方法
pH值用pHS-3B型精密pH计测定;挥发性脂肪酸(VFA)含量采用内标法测定,测定程序参照秦为琳(1982)[7]的方法进行。体外培养液氨氮(NH3-H)浓度的测定参照冯宗慈等(1993)[8]的比色方法进行测定。菌体蛋白(BCP)用John(1997)[9]的方法进行处理,采用Bradford(1976)[10]的方法测定菌体蛋白含量。
1.9 数据处理
试验数据采用EXCEL2003进行初步整理,利用SAS软件中的方差分析(ANOVA)进行差异性显著检验和多重比较。
2 试验结果与分析
2.1 日粮精粗比、维生素A添加水平对体外培养液pH值的影响(见表3)
由表3结果可知,高精料组体外培养液中的pH值在各个培养时间点均显著低于低精料组(P<0.05)。维生素A添加水平(5.8~23.3 IU/ml)对pH值的影响差异均不显著(P>0.05)。

表3 日粮精粗比、维生素A添加水平对体外培养液pH值的影响
2.2 日粮精粗比、维生素A添加水平对体外培养液VFA含量的影响(见表4~表8)
由表4、表5、表6、表7、表8的结果可知,高精料组在体外培养各个时间点的乙酸、丙酸、丁酸及TVFA含量均显著高于低精料组(P<0.05)。维生素A的添加剂量在5.8~23.3 IU/ml范围内对乙酸、丙酸、丁酸及TVFA含量的影响较小。高精料组在24 h时的乙丙比显著低于低精料组(P<0.05),说明高精料组产生的丙酸在TVFA中所占比例较高。维生素A的添加剂量在5.8~23.3 IU/ml范围内,对乙丙比的影响也较小。在体外培养的过程中,除4 h外,不同维生素A添加剂量之间对于乙丙比的影响均不显著(P>0.05)。
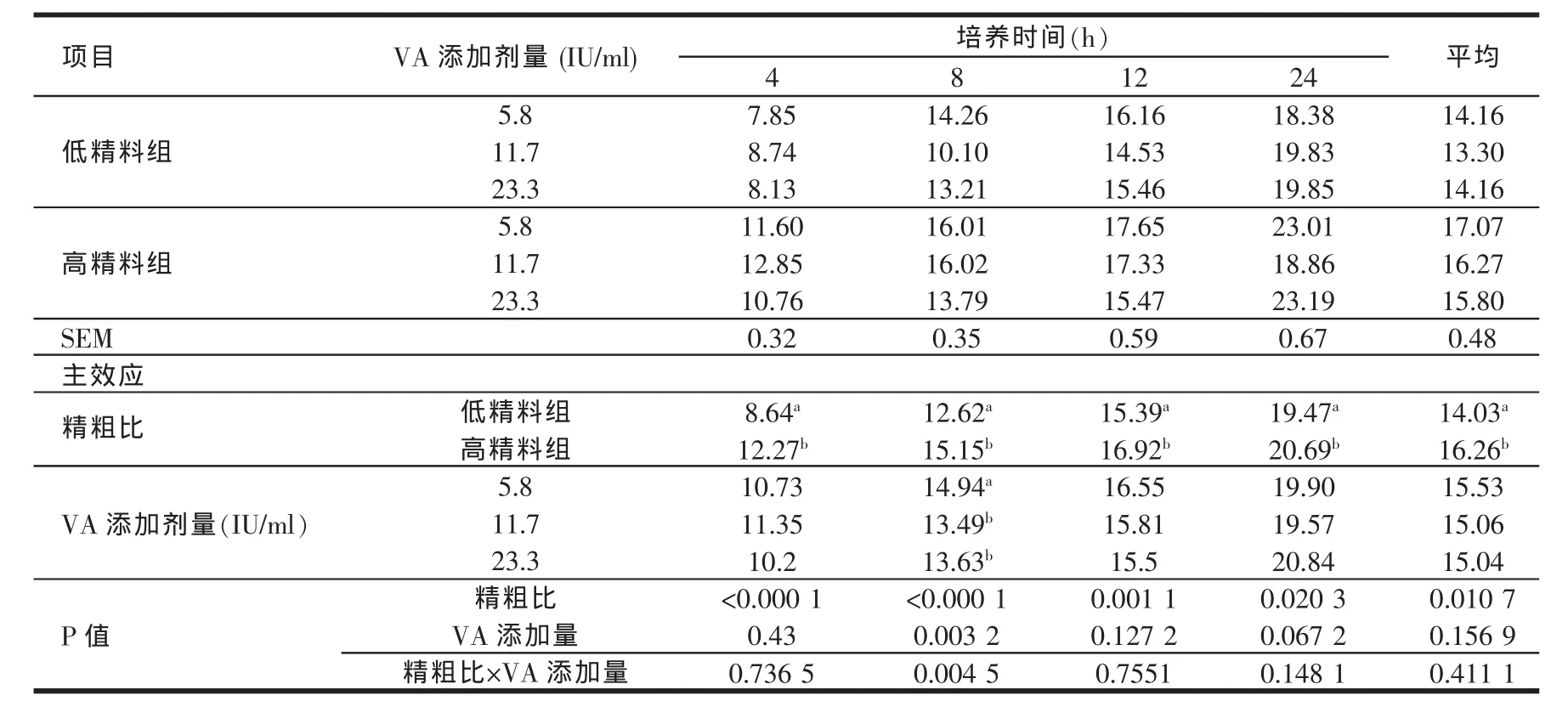
表4 日粮精粗比及VA添加水平对体外培养液乙酸含量的影响(mmol/l)
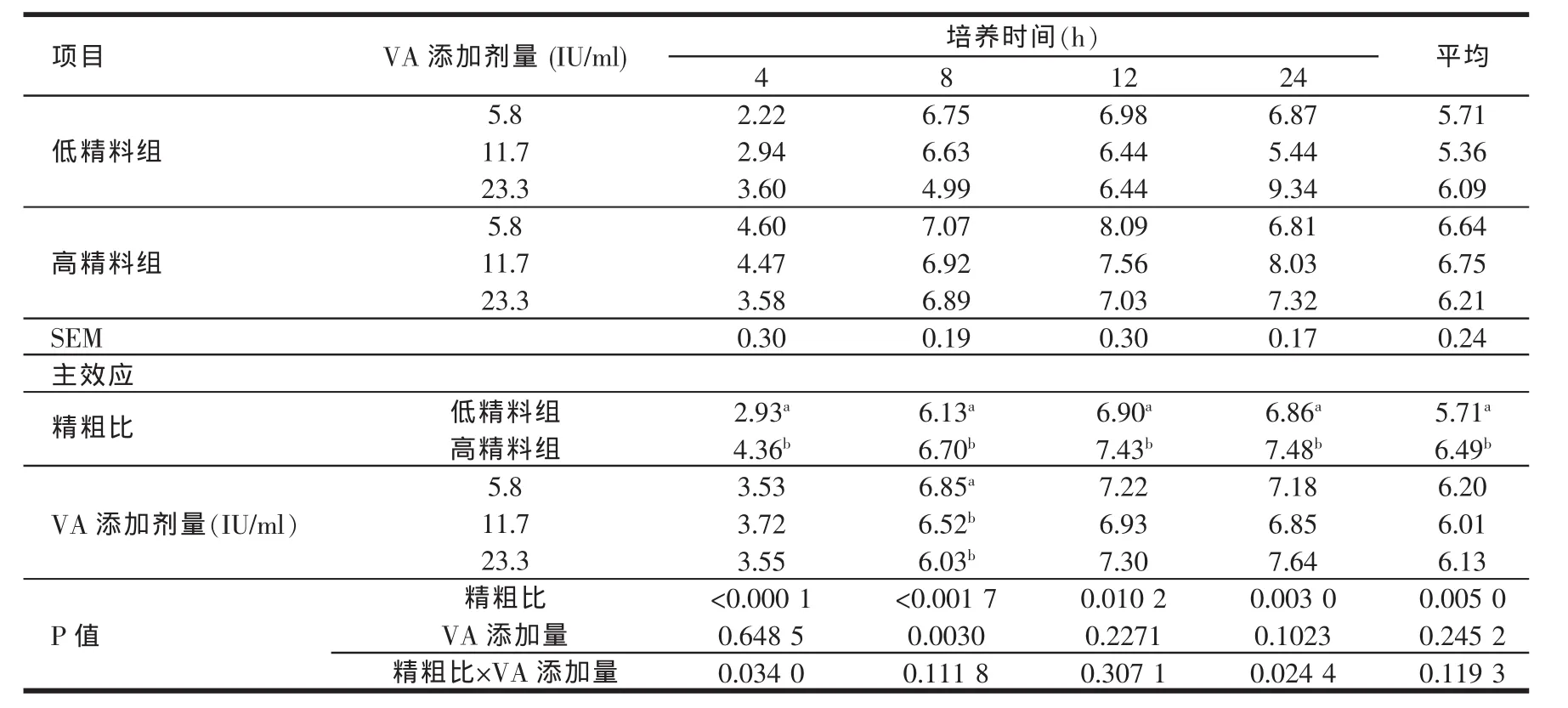
表5 日粮精粗比及VA添加水平对体外培养液丙酸含量的影响(mmol/l)
2.3 日粮精粗比、维生素A添加水平对体外培养液氨氮(NH3-N)浓度的影响(见表9)
由表9可见,高精料组在体外培养的4、12、24 h氨氮浓度均显著高于低精料组(P<0.05)。维生素A添加剂量(5.8~23.3 IU/ml)对体外培养液氨氮浓度的影响在各个时间点差异均不显著(P>0.05)。从整体趋势看,各处理组的氨氮浓度均随着体外培养时间的延长呈现先下降后上升的趋势。
2.4 日粮精粗比、维生素A添加水平对体外培养液菌体蛋白(BCP)含量的影响(见表10)
由表10的结果可知,高精料组在体外培养的各个时间点培养液BCP含量均显著高于低精料组(P<0.05)。维生素A添加剂量(5.8~23.3 IU/ml)对体外培养液BCP含量的影响在各个时间点均不显著(P>0.05)。
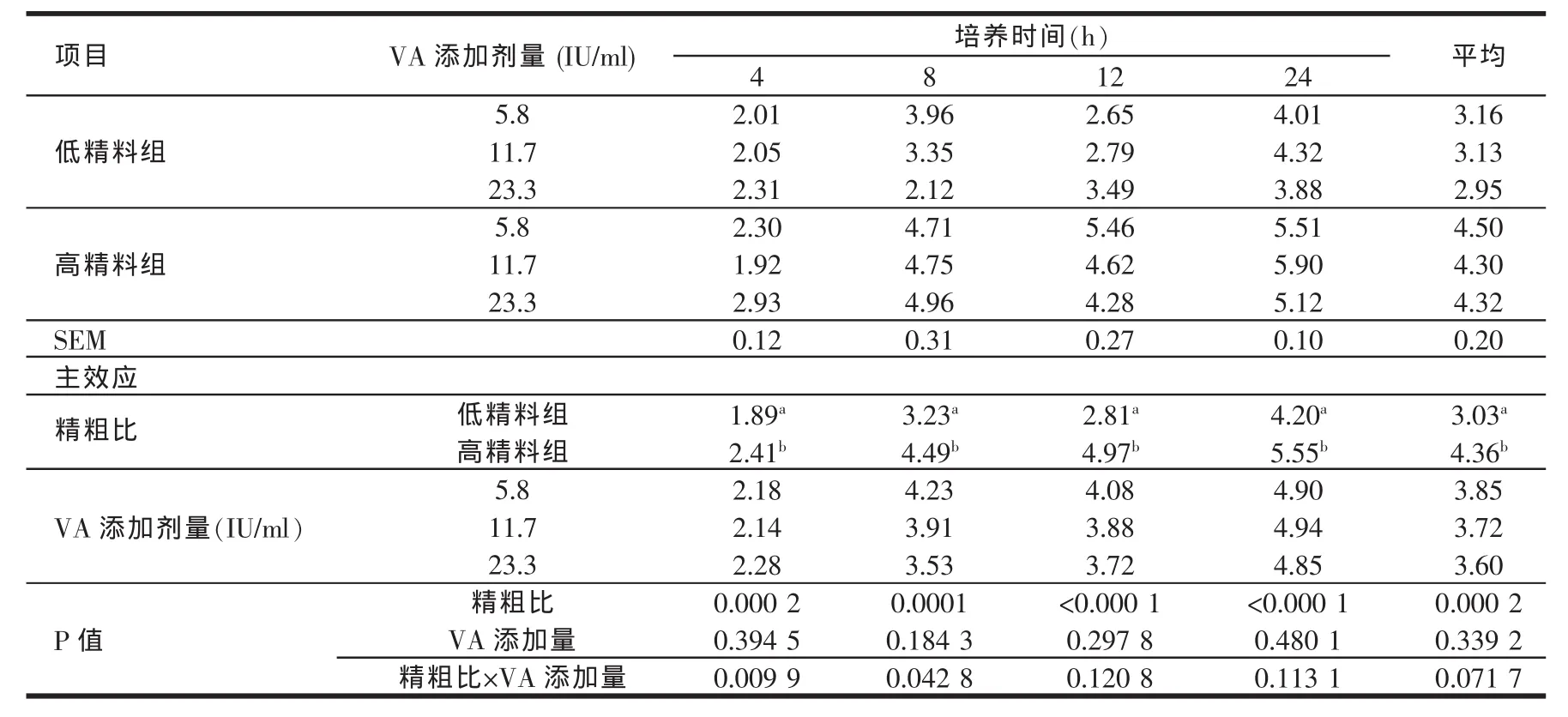
表6 日粮精粗比及VA添加水平对体外培养液丁酸含量的影响(mmol/l)
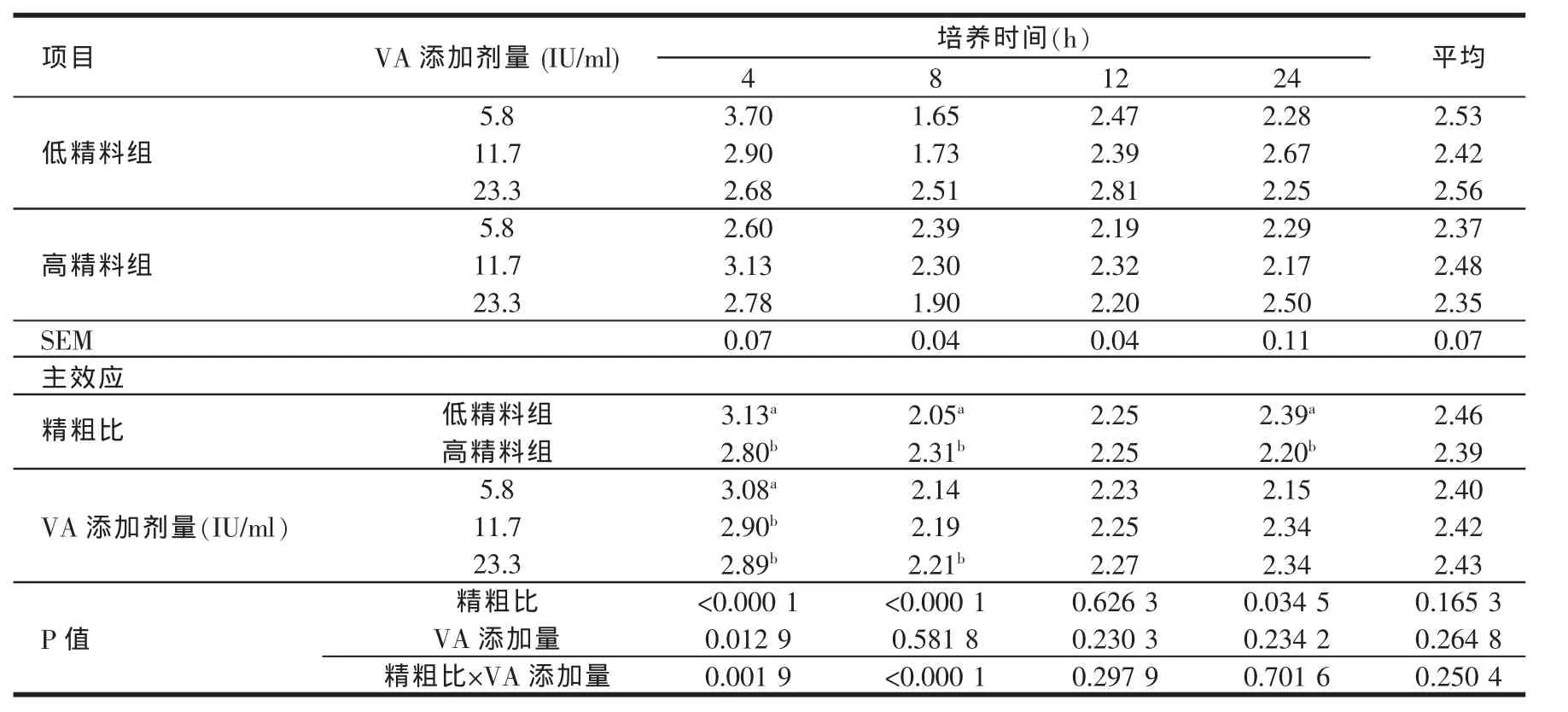
表7 日粮精粗比及VA添加水平对体外培养液乙丙比的影响

表8 日粮精粗比及VA添加水平对体外培养液TVFA含量的影响(mmol/l)
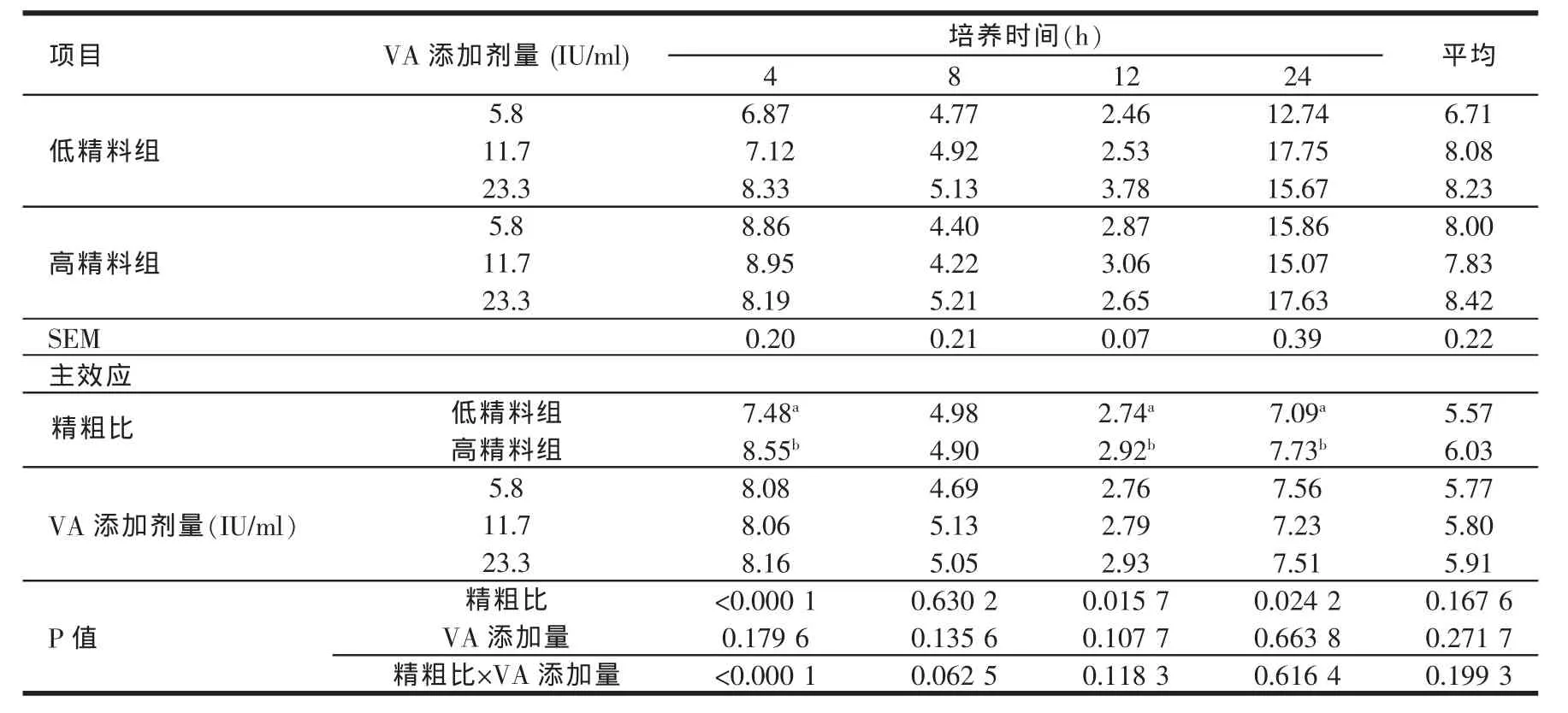
表9 日粮精粗比及VA添加水平对体外培养液NH3-N浓度的影响(mg/100 ml)
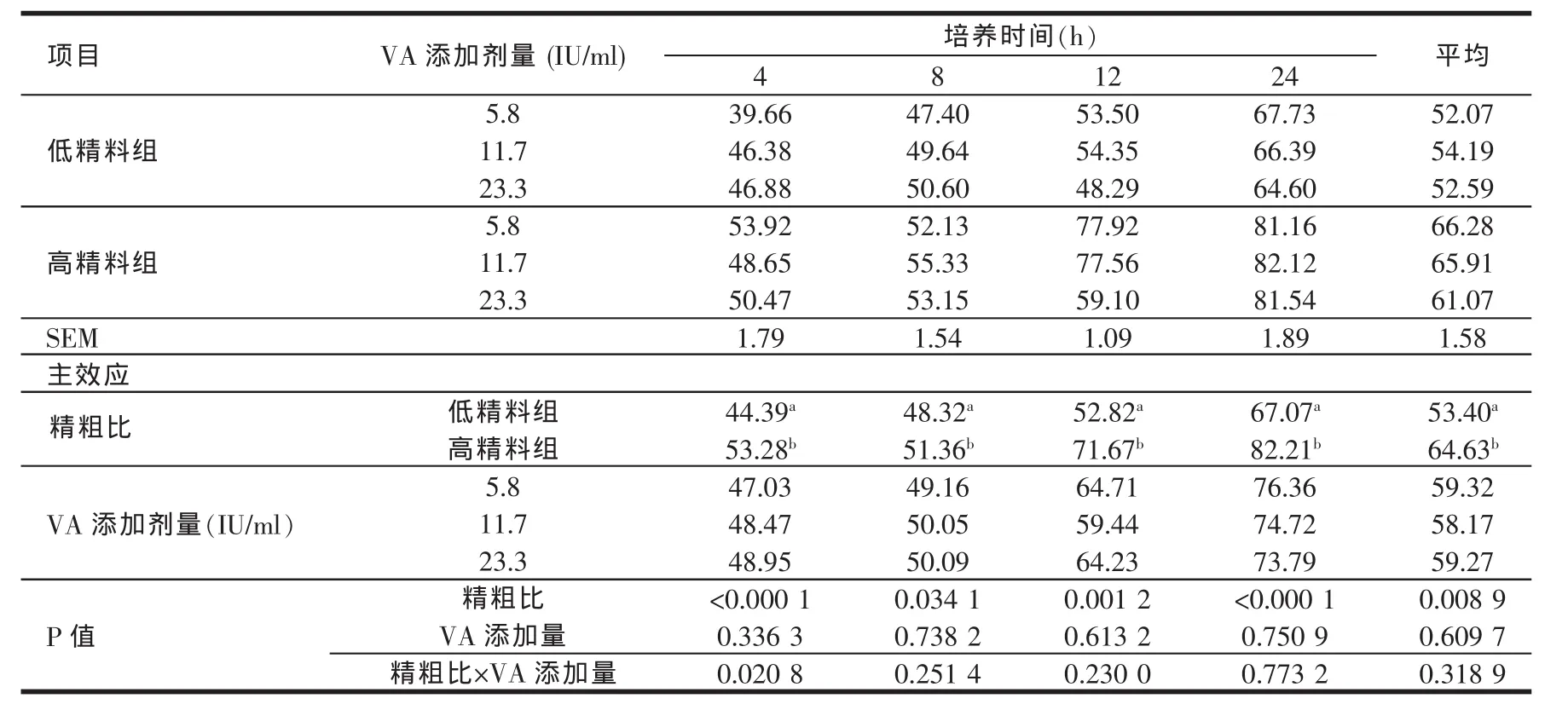
表10 日粮精粗比及VA添加水平对体外培养液BCP含量的影响(mg/100 ml)
3 讨论
3.1 维生素A添加水平对瘤胃发酵参数的影响
关于维生素A添加水平对奶牛瘤胃发酵参数的影响研究报道极少,研究结果也不尽一致。李飞等(2000)[11]报道,在肉牛日粮中添加适量的维生素A(5 000 IU),与对照组相比可以提高瘤胃中乙酸浓度和玉米秸秆干物质的有效降解率(P<0.05)。同时,匡伟等(2006)[12]的报道指出在体外瘤胃培养液中添加一定剂量的维生素A能够使培养液pH值呈上升趋势,NH3-N和VFA的平均浓度呈下降趋势,但差异不显著(P>0.05)。本试验的结果表明,维生素A的添加剂量(5.8~23.3 IU/ml)对于体外培养液pH值、VFA含量、氨氮浓度与BCP浓度的影响均较小。这些结果说明在5.8~23.3 IU/ml范围内,维生素A的添加水平对瘤胃微生物的生长与繁殖无明显影响。关于造成研究结果不一致的原因尚不清楚,可能与动物种类、添加剂量等因素有关,还需要进一步探讨。
3.2 日粮精粗比对瘤胃发酵参数的影响
pH值是反映瘤胃发酵水平的一项综合指标。它直接受唾液分泌、氨氮、VFA及其它有机酸生成、吸收和排出等诸多因素的影响,而引起瘤胃pH值波动的根本原因则是日粮结构和日粮营养[13,14]。在体外培养试验中,不存在唾液的分泌及营养物质外排的情况,因此影响培养液中pH值的变化的主要因素是VFA和有机酸的产生和吸收以及氨氮浓度的变化,VFA含量升高、氨氮浓度下降时pH值则下降。在本试验中,高精料组在所有时间点培养液的pH值均显著低于低精料组(P<0.05)。究其原因是由于低精料组培养底物中有较高纤维含量。纤维物质中所含的糖类多为结构性碳水化合物,其在瘤胃中发酵速度缓慢,从而使微生物产生VFA和其它有机酸的速度减缓,进而导致相同时间点,低精料组pH值高于高精料组。
反刍动物瘤胃发酵所产生的挥发性脂肪酸约占进入机体代谢的碳流量的2/3(Sauvant等,1995)[15],是反刍动物赖以生存、保持正常生长、泌乳、繁殖的主要能源,可提供反刍动物总能量需要量的70%~80%(Bergman等1975;王加启,1992)[16,17]因此,VFA浓度也是瘤胃发酵的主要指标之一;瘤胃发酵类型即乙酸/丙酸比也明显地影响着能量的利用率和能量储存部位。乙酸是反刍动物乳脂合成的主要前体,丙酸则是反刍动物重要的葡萄糖前体,因此丙酸型发酵能为机体提供更多的能量。反刍动物瘤胃内VFA的吸收总是遵循丁酸吸收最快,丙酸次之,乙酸最慢的规律[18]。影响瘤胃VFA含量和比例的最关键因素是日粮结构,Merchen等(1986)[19]用高粗料和高精料羯羊日粮做对比试验,结果表明瘤胃内总VFA浓度不受影响,但高精料日粮组乙酸和丁酸的浓度显著降低,丙酸浓度显著升高。Hart(1987)[20]却认为,随着肉牛日粮中高粱籽实添加量的增加,乙酸和丁酸的浓度不受影响,丙酸的浓度却显著升高。在本试验的研究结果中,高精料组在体外培养的各个取样时间点TVFA、乙酸、丙酸、丁酸含量均高于低精料组,且两组各种酸的含量均随着体外培养时间的延长而逐渐升高。体外培养24 h时,高精料组乙丙比均显著低于低精料组(P<0.05)。这说明虽然高精料组能够刺激微生物产生更多的挥发性脂肪酸,但是低精料组发酵产生的乙酸在总挥发性脂肪酸中所占比例较高,而丙酸比例较低。
瘤胃中的NH3-N主要来源于食糜中蛋白氮和非蛋白氮的降解,瘤胃NH3-N浓度在一定程度上反应了特定日粮组成下,饲料蛋白降解速率与微生物蛋白合成速率间所达到的平衡状况(McDonald,1988)[21]。本试验的结果表明,高精料组氨氮的浓度在体外培养的4、12、24 h均显著高于低精料组(P<0.05),同时高精料组在上述时间点的BCP含量也高于低精料组,这说明高精料组对于饲料蛋白质的降解能力优于低精料组。
菌体蛋白的含量直接反映瘤胃中细菌的数量。由本试验的结果可知,高精料组BCP的含量在各个培养时间点均显著高于低精料组。说明高精料能够促进瘤胃细菌的增加。
4 小结
①日粮精粗比显著影响各项奶牛瘤胃体外发酵参数;提高日粮中的精料比例可以促进挥发性脂肪酸的生成,促进氨氮的释放与BCP的合成,降低pH值。②维生素A添加水平在5.8~23.3 IU/ml范围内,对奶牛瘤胃体外发酵的影响较小。
[1] Gudas L J,Sporn M B.Cellular biology and biochemistry of the retinoids.In:The Retinoids:Biology,Chemistry,and Medicine,2ned.(Sporn,M.B.,Roberts,A.B.&Goodman,D.S.,eds.).Raven Press,New York,NY.1994.
[2] Fernandez S C,Budowski P.Pre-intestinal stability of betacarotene in ruminants.International Journal of Vitamin Nutrition Research.1976,46:439-445.
[3] Rode L M,McAllister T A.Microbial degradation of vitamin A in rumen fluid from steers fed concentrate,hay or straw diets[J].Can.J.Anim.Sci.,1990,70:227-285.
[4] Weiss W P,Smith K L.Effect of Forage to Concentrate Ratio on Disappearance of Vitamins A and E During In Vitro Ruminal FermentationJournal of Dairy Science.1995,78:1837-1842.
[5] Qiao,L.S.M.Yan.The disappearance of different levels and sources of vitamin A during in vitro ruminal fermentation.Journal of Animal and Feed Sciences[J].2007,16(2):411-416.
[6] 卢媛.沙葱、地椒风味活性成分及其对绵羊瘤胃发酵和羊肉风味的影响[D].内蒙古农业大学硕士学位论文,2002.
[7] 秦为琳.应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进[J].南京农学院学报,1982,4:111-115.
[8] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].内蒙古畜牧科学,1993(4):40-41.
[9] John W,Cone.Description of gas production profiles with.Animal[J].feed.Science.Techno logy,1997,66:31-45.
[10] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal.Journal of Biological Chemistry,1976,72:248-254.
[11] 李飞,莫放.维生素A对秸秆NDF瘤胃降解率的影响[J].中国奶牛,2000(4).
[12] 匡伟,郭玉华,尹召华,等.利用体外法研究不同水平维生素A对奶牛瘤胃内环境参数的影响[J].动物营养学报,2006,18(3):197-202.
[13] Reddy N M,Reddy G V N.Effect of fodder based complete diets on the rumen fermentation pattern in crossbred bulls[J].Indian Journal of Animal Science,1993,10(1):7-21.
[14] 参木有,卢德勋,胡明,等.玉米秸处理方法与替换干草对绵羊瘤胃发醉与采食量的影响[J].畜牧兽医学报,2004,35(1):10-14.
[15] Sauvant D,Dijstra J.Optimization of ruminal,digestion:a modelling approach.In:Recent developments in the nutrition of herbivores.Proceedings of the international,paris,1995,143-165.
[16] Bergman E N,McDonald I W.Digestion and Metabolism in the Ruminant.Univ.of New England Publishing Unit,Armidale,Australia,1975:292-300.
[17] 王加启.反刍家畜瘤胃内碳水化合物和氮代谢研究进展[J].国外畜牧科技,1992,19(5):34-37.
[18] 卢德勋.发展反刍动物绿色营养新技术[J].动物营养学报,1999,12:1-16.
[19] Merchen N R,Firkins J L.Effect of intake and forage level on ruminal Journal of Animal Science.turn overates,bacterial protein synthesis and duodenal aminoacid flows in sheep,1986,62:216-225.
[20] Hart S P.Associative effects of sorghum silage and sorghum grain diets Journal of Animal Science,1987,64:1779-1789.
[21] McDonald.The extent of conversion of food protein to microbial protein in the rume of sheep Journal of Biological Chemistry,1988,56:120-125.

