非小细胞肺癌中抑癌基因PTEN表达、突变与肿瘤发生发展及预后的相关性研究
舒红,张洪兰,马颖,姜卫国
(1.中国医科大学附属盛京医院病理科,沈阳 110004;2.连云港市第一人民医院病理科,连云港 222000)
非小细胞肺癌中抑癌基因PTEN表达、突变与肿瘤发生发展及预后的相关性研究
舒红1,张洪兰2,马颖1,姜卫国1
(1.中国医科大学附属盛京医院病理科,沈阳 110004;2.连云港市第一人民医院病理科,连云港 222000)
目的通过检测非小细胞肺癌(NSCLC)中PTEN基因的表达及突变,进一步阐明PTEN基因与NSCLC发生发展及预后的关系。方法 收集有完整随访资料的61例NSCLC蜡块,用免疫组化SP法检测PTEN蛋白的表达;选择其中30例癌组织蜡块提取DNA,PCR扩增PTEN基因第3、5、7、8外显子,并进行DNA测序。结果 PTEN蛋白表达在NSCLC组织中低于癌旁正常组织;并随着临床分期的增加及出现淋巴结转移而降低;PTEN蛋白阳性组的生存期明显高于阴性组,而与年龄及肿瘤的分化程度无关。仅1例标本发生了PTEN基因外显子5、7、8的纯和性丢失,2例发现了2类突变位点的存在,这2类突变均位于内含子中。结论PTEN蛋白的表达水平下调在NSCLC的发生发展中可能起了重要作用;而PTEN基因的改变比率远远低于其蛋白表达下调的程度。
非小细胞肺癌;PTEN基因;基因突变;蛋白表达
肺癌的发生发展是多因素参与的复杂过程。人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homology deleted on chromosometen,PTEN)突变和蛋白表达异常与多种恶性肿瘤有关[1]。然而该基因与非小细胞肺癌(nonsmall cell lung cancer,NSCLC)的确切关系各家报道不一[2,3]。本研究通过观察PTEN蛋白在NSCLC中表达及PTEN基因的突变情况,进一步认识PTEN基因在NSCLC发生发展中的作用。
1 材料与方法
1.1 临床病理资料
收集中国医科大学附属盛京医院病理科存档的NSCLC石蜡标本61例作为实验组,取距肿瘤5cm以上的正常肺组织20例作为对照组。实验组中男46例,女15例,年龄30~77岁,中位年龄60岁,术前均未接受放化疗。按组织类型划分,腺癌22例,鳞癌36例,腺鳞癌3例。其中Ⅰ、Ⅱ期45例,Ⅲ、Ⅳ期16例。所有病例均有完整的随访数据,其中30例存活,3例复发,28例病故,随访时间2.5~10年。
1.2 主要试剂与设备
PCR反应试剂盒及PCR扩增仪均为TaKaRa公司;兔抗人PTEN多克隆抗体为美国SANTA CRUZ公司产品;引物序列由上海Introgen公司合成。
1.3 实验方法
1.3.1 免疫组化SP法检测NSCLC中PTEN蛋白表达:石蜡切片脱蜡后,3%H2O2阻断内源性过氧化物酶,高压锅加热进行抗原修复。滴加一抗,湿盒中4℃过夜。滴加二抗,37℃孵育30min,DAB显色。
1.3.2 石蜡包埋组织DNA提取:由于NSCLC组织标本存在坏死,我们选取了其中30例质量较好的标本,各年龄段、临床分期及生存期情况近似于全体的各部分组成比。石蜡切片10μm/片×20片,经脱蜡后加入蛋白酶K消化,酚/氯仿/异戊醇法提取DNA。
1.3.3 引物设计与合成:PTEN 基因第 3、5、7、8外显子引物设计采用gene tool 1.0软件设计(表1)。

表1P T E N基因第3、5、7、8外显子P C R扩增引物序列及退火温度T a b.1P r i me r s e q u e n c e o f e x o n 3,5,7,a n d 8o fP T E Ng e n e a n d a n n e a l i n g t e mp e r a t u r e PTENexon Primer sequence Fragment Annealing temperature Exon3 upstream: 5′GTAATTTCAAATGTTAGCTCA3′ 149bp 56℃downstream:5′GAAGATATTTGCAAGCATACA3′Exon5 upstream: 5′CCTGTTAAGTTTGTATGCAACA3′ 338bp 59℃downstream:5′TCCAGGAAGAGGAAAGGAAA3′Exon7 upstream: 5′TGACAGTTTGACAGTTAAAGG3′ 347bp 58℃downstream:5′AACACCTGCAGATCTAATAGAA3′Exon8 upstream: 5′CTCAGATTGCCTTATAATAGTC3′ 558bp 59℃downstream:5′TCATGTTACTGCTACGTAAAC3′
1.3.4 PCR反应及琼脂糖凝胶电泳:PCR反应总体系为50μl,含模板DNA 1μl(300~400ng)。反应条件为94℃5min,40个循环,94℃持续1min,退火持续1min,72℃持续1min,最后1次循环结束后,于72℃继续延伸10min。取5μlPCR产物反应液加入1/5体积的6×Loadingbuffer,进行2%琼脂糖凝胶电泳。
1.3.5 PCR产物DNA序列测定:由北京六合华大基因科技股份有限公司进行产物纯化及DNA序列测定。
1.3.6 免疫组化结果判定:参照文献[1],根据显色细胞的比例及染色强度分别计1~3分,两项乘积≥3分为阳性。
1.3.7 基因突变判定:(1)外显子纯和性丢失判定:以β-actin为内参,在凝胶电泳中不出现目的扩增条带,则判定为某个外显子的纯合性丢失;(2)点突变判定:在DNA测序图中,舍弃测序开始的30个左右的碱基,基线较平的峰图中出现套峰,且对照NCBI基因序列出现碱基改变时,判定为突变。
1.4 统计学分析
计数资料采用率表示,组间比较用χ2检验或Fisher确切概率法;应用Kaplan-Meier法进行生存分析,并用Log-rank检验。用SPSS13.0的统计软件进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组织表达与临床病理学特征的关系
PTEN蛋白阳性表达在NSCLC组织中为49.2%(30/61),在正常对照组中为 95.0%(19/20),二者差异有统计学意义(P<0.05)。
PTEN蛋白表达在肺腺癌明显高于肺鳞癌(χ2=8.86,P<0.05);PTEN 蛋白表达与临床分期(χ2=5.074)及淋巴结转移(χ2=5.003)呈负相关(P<0.05);而与年龄(χ2=3.599)及分化程度(χ2=0.807)无关(P >0.05)。
2.2 NSCLC组织中PTEN表达与患者术后生存期的关系
用Kaplan-Meier生存分析显示,PTEN表达(-)组患者平均生存期为36.462个月,中位生存期为22.000个月;PTEN表达(+)组患者平均生存期为70.982个月,中位生存期为90.000个月,患者术后生存率与PTEN的表达呈正相关(Log-rank检验P<0.05),见图 1。
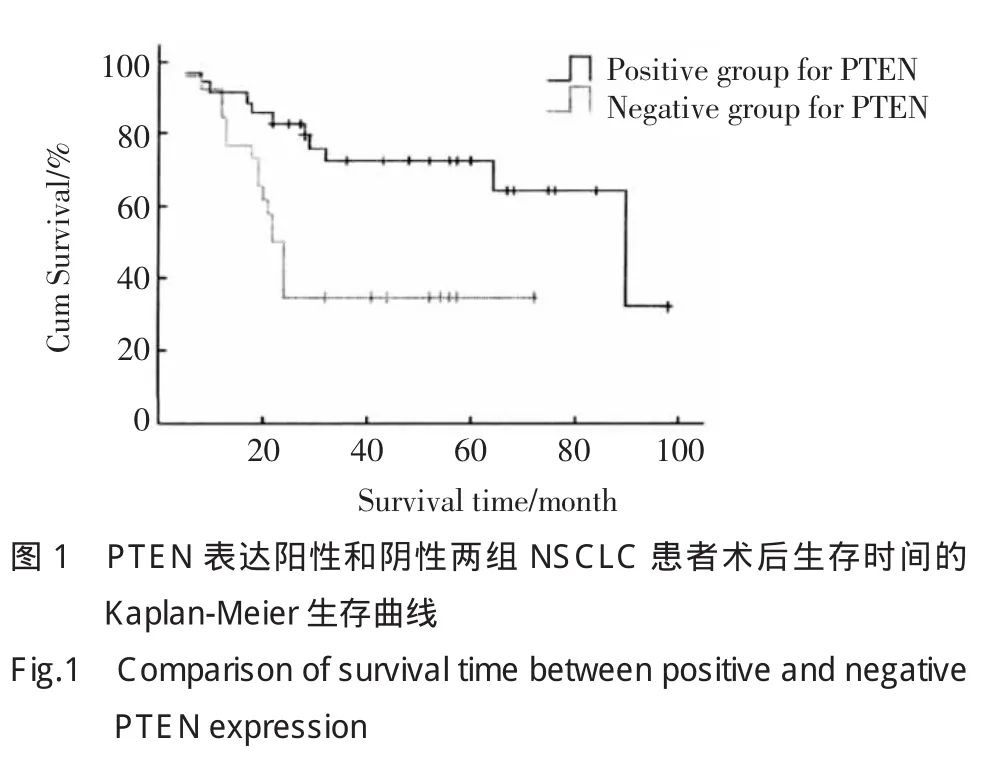
2.3 NSCLC 中 PTEN 基因外显子 3、5、7、8的突变情况
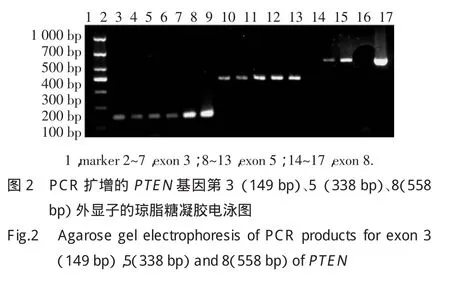
PCR产物经电泳后显示PTEN基因4个外显子片段,其中外显子5、7、8各有1例(图2中12、15泳道。外显子7图略)未出现扩增产物(以β-actin作为内参),而这3个外显子属于同一个患者,说明该患者出现了PTEN基因外显子5、7、8的纯和性缺失。
PCR产物经测序检测出2类2个突变位点的存在。这2类突变均位于内含子中,包括在第7外显子 3'侧翼下游 46bp处检测到 1个 G→A(116033)点突变(图3)和在第8外显子5'侧翼上游2bp和3bp之间插入了1个T(图4)。

2.4 NSCLC组织PTEN基因改变与其临床病理学特征之间的关系
3例PTEN基因改变的NSCLC患者均为晚期;其中2例为鳞癌且为中低分化肿瘤;3例术后生存期都不足1年。提示临床分期越晚、病理分级越差术后生存期短的NSCLC患者易于发生PTEN基因的突变。
3 讨论
PTEN[5]定位于染色体 10q23.3,有 9个外显子。它是具有双重磷酸酶活性的抑癌基因,其缺失、突变、表达产物的失活等均可影响着肿瘤的发生发展[6]。
目前有关PTEN蛋白表达与肺癌关系的研究结论不太一致[2,3]。本实验研究结果表明,NSCLC 组织中PTEN蛋白阳性表达明显低于癌旁正常肺组织;Ⅰ、Ⅱ期组高于Ⅲ、Ⅳ期组;无淋巴结转移组高于有淋巴结转移组,说明PTEN基因的低表达参与了NSCLC的发生,并促进了肿瘤的发展及淋巴结转移。肺腺癌中PTEN蛋白表达明显高于鳞癌,说明PTEN蛋白的丢失在鳞癌中的作用可能高于腺癌。Kaplan-Meier生存曲线证实PTEN蛋白阳性表达组的生存率明显高于阴性组。PTEN蛋白表达与NSCLC年龄及分化程度无关。
PTEN基因最常见的突变发生于外显子5、7和8[7]。本研究选取 PTEN 基因的第 3、5、7、8外显子(跨部分内含子)进行PCR扩增及DNA测序。结果发现,仅1例标本(男性,68岁,低分化鳞癌,临床Ⅳ期,术后生存12个月)发生了PTEN基因外显子5、7、8的纯合性丢失,提示临床晚期、分化程度低、发生淋巴结及远处转移且生存期较短的NSCLC患者容易发生PTEN基因的纯合性丢失。DNA测序发现了2类2例突变位点的存在。这2类突变均位于内含子中,根据目前的文献分析,我们所发现的突变位点均为首次报道,鉴于2例均为内含子的点突变,推测这些突变在PTEN基因的选择性剪切和转录过程中可能起了一定作用。本研究表明PTEN基因改变在NSCLC中是少见的,合计突变率为10.0%,纯合性丢失率为3.33%。Ferraro等[8]报道,NSCLC中PTEN的突变率仅为6%~8%,而PTENDNA纯合性丢失在肺癌细胞系中却占8%~40%。因本研究未对PTEN基因的全部外显子及内含子进行检测,故可能低估了PTEN基因在NSCLC中的突变率。
本研究与以往的研究结果类似,肿瘤组织中PTEN蛋白表达减少明显高于PTEN基因纯合或杂合性缺失及基因突变的比率。这一现象表明除基因水平异常外,基因转录、翻译和翻译水平后修饰等基因各阶段异常导致的PTEN蛋白表达及功能异常更为重要[9]。鉴于蛋白质是执行生物学功能的基本单位,基因的突变最终要通过蛋白质的改变来实现,因此PTEN蛋白的表达情况对NSCLC的影响似乎比其突变与缺失更有说服力。
[1]Zhang Y,Yu D,Li X,et al.Reduced expression of PTEN protein and its prognostic significance in the gastrointestinal stromal tumor[J].J Huazhong Univ Sci Technolog Med Sci,2010,30(2):165-169.
[2]Bepler G,Sharma S,Cantor A,et a1.RRM1and PTEN as prognostic parameters for overall and disease-free survival in patients with non small cell lung cancer[J].J Clin Oncol,2004,22(10):1878.
[3]张尚福,苏学英,谢斌,等.肺癌中PTEN蛋白的表达[J].中华病理学杂志,2000,29(3):220-221.
[4]Freitas S,Moore DH,Michael H,et al.Studies of apurinic/apyrimidinic endonueclease/ref-1expression in epithelial ovarian cancer:correlations with tumor progression and platinum resistance[J].Clin Cancer Res,2003,9(13):4689-4694.
[5]Li J,Yen C,Liaw D,et al.PTEN a putive protein tyrosine phoshatage gene mutated in human brain,breast and prostate cancer [J].Science,1997,275(5308):1943-1947.
[6]Grill C,Guelly C,Ebner B,et al.Loss of PTEN/MMAC1activity is a rare and late event in the pathogenesis of nephroblastomas[J].Human Pathology,2010,41(8)1172-1177.
[7]Ali IU,Schriml LM,Dean M.Mutational spectra of PTEN/MMAC1gene:a tumor suppressor with lipid phosphatase activity[J].J Natl Cancer Inst,1999,91(22)∶1922-1932.
[8]Ferraro B,Bepler G,Sharma S,et al.EGR1predicts PTEN and survival in patients with non-small cell lung cancer [J].Clin Oncol,2005,23(9):1921-1926.
[9]Erkanli S,Kayaselcuk F,Kuscu E,et al.Expression of surviving,PTENandp27innormal,hyperplastic,andcarcinomatousendometrium[J].Int J Gynecol Cancer,2006,16(3):1412-1418.
(编辑武玉欣,英文编辑郑华川)
PTENMutation and Expression in Non-Small Cell Lung Cancer
SHU Hong1,ZHANG Hong-lan2,MA Ying1,JIANG Wei-guo1
(1.Department of Pathology,Shengjing Hospital,China Medical University,Shenyang 110004,China;2.Department of Pathology,Lianyungang First People’s Hospital,Lianyungang 222000,China)
ObjectiveTo clarify the relationship betweenPTENand the tumorigenesis,progression or prognosis of non-small cell lung cancer(NSCLC).MethodsExpression of PTEN was examined in 61cases of NSCLC and 20cases of normal lung tissue by SP immunohistochemistry.Exon 3,5,7,9ofPTENgene were evaluated by PCR and sequencing.ResultsPTENexpression was lower in NSCLC than in control.PTENexpression was correlated with lymph node metastasis,clinical stage and overall survival,but not with patient’s age,sex and histological grading.One of 30cases showed loss of homozygosity ofPTENexon 5,7and 8in NSCLC and 2showed mutations ofPTEN.ConclusionDown-regulation of PTEN protein might be involved in the development of NSCLC pathogenesis.However,the genetic alterations ofPTENwere infrequent.
non small cell lung cancer;PTENgene;mutation;protein expression
R734.2
A
0258-4646(2011)01-0070-04
舒红(1967-),女,副教授,博士.E-mail:shuhong0302@hotmail.com
2010-11-15

