Box-Behnken效应面法优化牛蒡苷pH敏感脂质体处方
武鑫朋,孙李妍,2,慕宏杰,杨绍梅,魏俊花,周绣棣,陈大全
(1.烟台大学药学院,山东烟台264005;2.烟台山医院,山东烟台264001)
牛蒡苷(arctiin,AC)具有显著的抗菌,抗病毒,抗肿瘤,抗PAF受体作用,在体内被分解为牛蒡苷元而产生众多药理作用,具有很高的新药开发价值。经家兔静脉注射牛蒡苷元10 mg·kg-1,其药物动力学行为符合单室模型,消除半衰期t1/2(Ke)为52.164 73 min,药物体内消除较快,故该药较适合制成缓释剂型[5~8]。鉴于人体阴道pH值为4~5,本研究将其设计为pH敏感脂质体,并初步考察其稳定性,拟为今后研制其凝胶剂型及其体内研究奠定基础。
Box-Behnken效应面法是Design Expert(7.1.4试用版,Stat-Ease Inc)实验设计软件中的一种实验设计方法,许多国外药学工作者已将其用于制剂处方的优化,而国内仍为少见。作者采用薄膜分散法制备了牛蒡苷pH敏感脂质体,并采用Box-Behnken效应面法对处方进行优化[9]。
本实验拟通过构建牛蒡苷pH敏感脂质体,通过Box-Behnken效应面法优选处方并对其进行一系列性质研究。
1 仪器与试药
RE252A旋转蒸发仪(上海亚荣生化仪器厂),NicompTM 380动态光散射粒度测定仪(SantaBarbara,USA PSS),JM21200EX透射电镜(日本电子公司)。
牛蒡苷(纯度质量分数>99.15%,东北制药总厂),大豆磷脂(注射级,上海太伟药业有限公司),胆固醇(生化级,天津博迪化工有限公司),pH敏感材料mPEG2000-Hz-Chol(PHC)(实验室自己合成),三氯甲烷、甲醇(色谱纯,山东禹王试剂有限公司),其他试剂(分析纯,市售)。
2 实验方法与结果
2.1 AC脂质体的制备
2.1.1 AC脂质体的制备 称取处方量的AC原料药、大豆磷脂、胆固醇、PHC,溶于适量三氯甲烷中,置于250 mL茄形瓶中,在42℃减压除去有机溶剂,得到透明均匀薄膜,继续抽真空10 min后,加入磷酸盐缓冲液(pH值为7.2),在20℃条件下超声水化磷脂膜30 min后过0.45 μm微孔滤膜,得到略带乳光脂质体混悬液,于4℃下保存备用。
在河湖周边区,结合平原区造林,在城市河道两侧50~100 m范围内,按照乔灌草立体配置模式,建设河滨植物过滤带,进一步过滤、净化入河水质。
2.1.2 实验条件筛选 a.按2.1.1中处方,将茄形瓶改为50 mL和500 mL体积,其余操作同上制备脂质体;b.按2.1.1中处方,将温度改为38℃和45℃,其余操作同上制备脂质体;c.按2.3步骤测定脂质体包封率和载药量并进行比较,结果:选择250 mL茄形瓶,设定旋蒸温度为42℃制备脂质体,此时得到的脂质体包封率及载药量最高。
2.1.3 实验方法筛选 按照2.1.1中处方,分别采用逆向蒸发法、注入法、pH梯度法等制备脂质体,并测其包封率,结果:薄膜分散法所制备的脂质体包封率最高。
2.2 含量测定方法学的建立[8~10]
2.2.1 检测波长选择 分别称取AC对照品与空白辅料适量,加甲醇溶解,配制成一定浓度的AC和辅料溶液,分别在200~400 nm内进行紫外扫描。AC在280 nm处有最大吸收,且空白辅料不干扰测定,选定检测波长为280 nm。
2.2.2 标准曲线的制备 精密称取AC对照品置量瓶中,以甲醇配制成质量浓度为0.102 mg·mL-1贮备液,稀释得到质量浓度分别为0.0102、0.0204、0.0306、0.0408、0.051、0.0612 mg·mL-1溶液。按“2.2.1”在280 nm处测定吸光度(A),以吸光度(A)对药物质量浓度(C)作线性回归,得标准曲线方程为:A=16.509×C+0.008 9(R2=0.999 9)。结果表明,AC质量浓度在0.010 2~0.061 2 mg·mL-1内与吸光度呈良好的线性关系。
高、中、低3个质量浓度的日内、日间精密度良好,RSD均小于2%。
2.3 AC脂质体包封率及载药量的测定 采用过膜法测定脂质体的包封率。精密量取脂质体0.3 mL置10 mL量瓶中,甲醇定容,按“2.2.2”中UV法测定溶液中AC含量。药物包封率(entrapment efficiency,EE)、载药量(loading content,LC)计算公式如下:EE%=ρ测 /ρ总×100;LC%=(m总-m游离)/m脂质×100。式中ρ总、ρ测分别代表投入脂质体溶液中AC的总质量浓度、被包封AC的质量浓度;m测、m脂质分别代表单位体积脂质体包封AC的量以及制备单位体积脂质体所用脂质的量。
2.4 脂质体粒径的测定 动态光散射粒度测定仪测定牛蒡苷脂质体的粒径大小及分布,结果如图1,表明脂质体粒径在228 nm左右,呈正态分布。
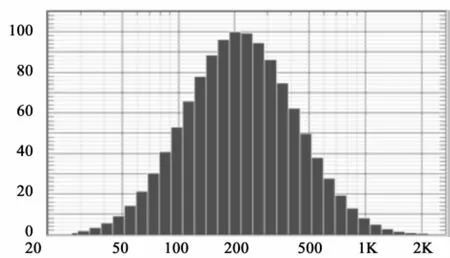
图1 牛蒡苷pH敏感脂质体粒径分布
2.5 Box-Behnken效应面法优化处方试验 在预实验的基础上,选择对脂质体性质影响较显著的3个因素:磷脂-胆固醇比(X1)、磷脂-药质量比(X2)、pH敏感材料含量(X3)作为考察对象。以包封率(Y1,EE)、载药量(Y2,LC)及粒径(Y3,d)为评价指标,安排试验,因素水平见表1,试验结果见表2。

表1 Box-Behnken设计因素水平
2.5.1 二次回归模型的建立 利用Box-Behnken实验软件对表2实验数据进行回归分析,得二次多元回归模型为:
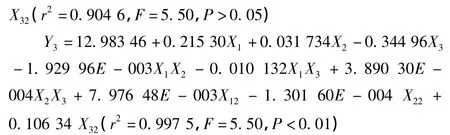
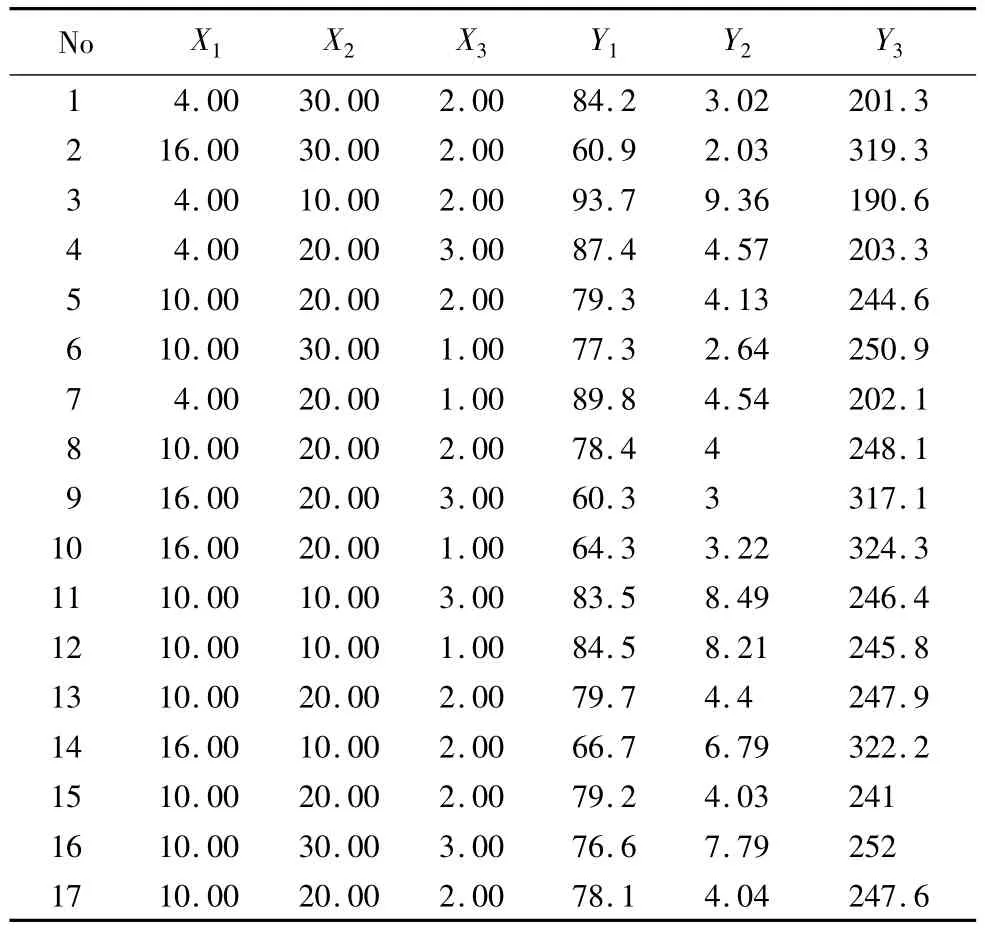
表2 Box-Behnken实验设计与结果
2.5.2 方差分析和显著性检验 以上拟合方程的相关系数说明设计模型拟合程度良好,可以用此模型对AC脂质体的处方进行分析和预测。从r2来看,3个指标均以二项式拟合度较优。3个考察指标中包封率和粒径与自变量之间呈显著相关性。从表3回归系数的显著性检验可知,模型(1)中X1(P<0.000 1)、X2(P=0.000 1)项极显著,其他项不显著;模型(2)中X2(P=0.000 5)、X22(P=0.003 9)显著,其他项不显著;模型(3)中X1(P<0.000 1)、X12(P=0.000 1)显著,其他项不显著。

表3 回归方程中的显著性系数
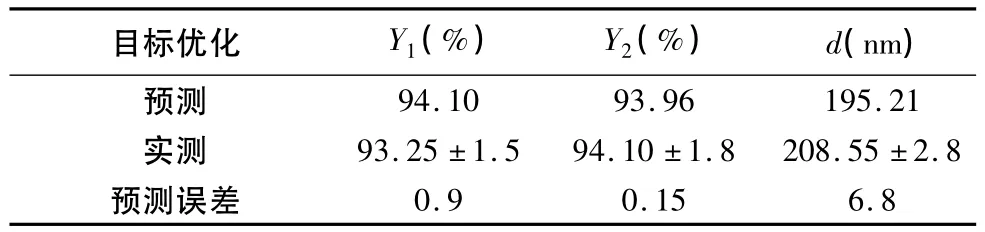
表4 按照最优处方制备的牛蒡苷pH敏感脂质体实验观察值与模型预测值
2.5.3 效应面优化与预测 按照二项式拟合方程描绘效应对各因素的效应面,本试验欲控制纳米粒径在<200 nm范围内,并取得较高的收率和包封率。根据上述分析的结果,效应面优化与预测应用实验设计软件绘制各指标与影响较显著的2个自变量的三维曲面图(另一自变量设为中心点值,图2),设计各指标权重,得到优化后处方(X1=4.36,X2= 10.01,X3=1.32)。按此处方制备了3批脂质体,其包封率、载药量和粒径见表4。从表4可知,实验观察值和模型预测值都比较接近,模型的预测性良好。
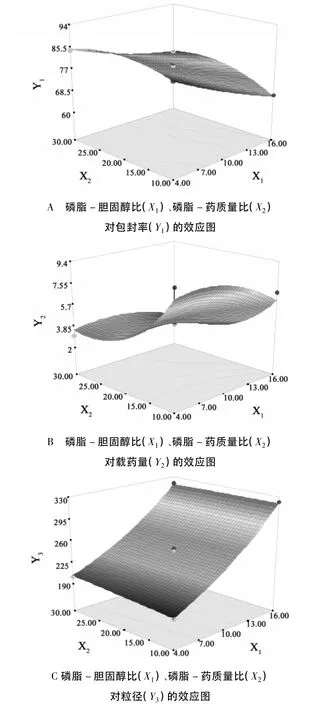
图2 考察因素与评价标准效应曲面图
2.6 AC脂质体稳定性考察
2.6.1 性状 本品为均匀,细腻,黏稠的乳白色液体。
2.6.2 pH值 取本品5.0g,加100 mL蒸馏水稀释,搅拌5 min,测定pH值在6.0~7.0之间。
2.6.3 稳定性实验 a.将脂质体装入无菌安瓿中,封口,分别在冰箱(4℃)、室温(22℃)和60℃下放置24 h,观察其性状并测定包封率;b.将脂质体装入无菌安瓿中,封口,给与光照24 h,测包封率;c.将脂质体装入无菌安瓿中,封口,分别在室温下放置一周、两周、一个月,测包封率结果:脂质体在冰箱和室温下可以稳定保存,室温下保存一个月后包封率基本没有变化,说明该法制得的脂质体性质稳定不易泄漏;而对于光照和60℃条件表现出不稳定性。
2.7 形态学观察(TEM) 取适量牛蒡苷pH敏感脂质体溶液滴在喷碳铜网表面,使液体尽量铺满整个铜网,以质量分数2.0%磷钨酸负染3 min后,于透射电镜下观察形态。从图3可以看出,牛蒡苷pH敏感脂质体为球形或类球形粒子,大小均一,结构完整。

图3 透射电镜下牛蒡苷pH敏感脂质体形态学
3 讨论
3.1 在脂质体单因素(磷脂-胆固醇比(X1)、磷脂-药质量比(X2)、pH敏感材料含量(X3))考察过程中发现,影响脂质体性质的因素主要是磷脂-胆固醇比(X1)、及磷脂-药质量比(X2)。因此以这3个因素为考察对象,以包封率、载药量及粒径为考察指标进行Box-Behnken实验设计。
3.2 根据实验研究发现,影响包封率和载药量的最主要因素为磷脂-胆固醇比(X1)和磷脂-药质量比(X2),根据图2中的图A和B可知,包封率和载药量随着磷脂-胆固醇比的增大呈先增大后减小的趋势,原因可能为磷脂质量浓度增加,形成的脂质体增多,其粒径也增大,包封在脂质体内药物相应增多,因而能包载更多药物及药物胶束,包封率相应提高,同时载药量也相应增大。但是磷脂质量浓度过大,相同投药量下的载药量下降,而且形成的脂质体容易聚集融合,导致药物泄漏,使得载药量和包封率降低。
3.3 由图2中图C可知,脂质体粒径大小受磷脂-胆固醇比(X1)影响最大,而磷脂-药质量比(X2)影响较小,粒径随着磷脂量的增多而增大。
3.4 pH敏感材料含量(X3)对脂质体的包封率、载药量和粒径的影响都较小,根据参考文献[2~4]可知,以该材料修饰合成的脂质体在体内可表现良好的pH敏感性,为后期进行pH敏感脂质体体内研究奠定基础。
4 结论
本实验通过Box-Behnken效应面设计法优化了牛蒡苷脂质体的处方,按此处方制备了3批脂质体,包封率、载药量和粒径实测值与预测值的偏差均较小,说明该方法预测性能较好,可以准确的优化牛蒡苷脂质体的处方;通过对优化后脂质体处方的粒径测定结果可知,含有pH敏感材料的脂质体粒径均在228 nm左右,通过透射电子显微镜观察,脂质体大小分布均匀,结构完整,为下一步的体内研究奠定了良好基础。
[1] Shin J,Shum P,Thompson DH.Acid-triggered release via dePEGylation of DOPE liposomes containing acid-labile vinyl ether PEG-lipids[J].J Control Release,2003,91(1-2):187-200.
[2] Chen D,Jiang X,Huang Y,et al.pH-Sensitive mPEGHz-Cholesterol Conjugates as a Liposome Delivery System[J].Journal of Bioactive and Compatible Polymers,2010,25(5):5527-5542.
[3] Chen D,Jiang X,Liu J,et al.In vivo evaluation of novel pH-sensitive mPEG-Hz-Chol conjugate in liposomes: pharmacokinetics,tissue distribution,efficacy assessment[J].Artif Cells Blood Substit Immobil Biotechnol,2010,38(3):136-142.
[4] Liu J,Li H,Chen D,et al.In vivo evaluation of novel chitosan graft polymeric micelles for delivery of paclitaxel[J].Drug Deliv,2011,18(3):181-189.
[5] 王潞,赵烽,刘珂.牛蒡子苷及牛蒡子苷元的药理作用研究进展[J].中草药,2008,39(3):467-470.
[6] 徐朝晖,李婷,邓毅,等.牛蒡子提取物的降血糖作用[J].中草药,2005,36(7):1043-1045.
[7] 徐传芬,孙隆儒.牛蒡的研究现状.天然产物研究与开发,2005,17(6):818-821.
[8] 王劲,杨松松.牛蒡子抗病毒有效部位研究[D].沈阳:辽宁中医学院,2004.
[9] 邢传峰,胡海洋,杨春荣.Box-Behnken效应面法优化长春西汀长循环脂质体处方[J].沈阳药科大学学报,2009,10(26):761-766.
[10] 阎婷,王佩琪,郭伟英.紫外分光光度法测定牛蒡子提取物总木脂素含量[J].沈阳药科大学学报,2009,30 (1):63-64.

