新型癌症患者突发性疼痛治疗药——芬太尼
林 娜
(烟台市毓璜顶医院,山东烟台 264000)
2011年 1月 7日,美国食品药品管理局 (FDA)批准奥雷佐 (Orexo)公司及其合作伙伴普罗斯特拉坎集团 (ProStrakan Group)公司联合开发的 Abstral(fentanyl,芬太尼)舌下含片,用于控制成人癌症患者的突发性疼痛。Abstral直接贴于口腔粘膜(脸颊内部、牙龈及舌头)或者鼻腔及咽喉,并在这些位置溶解吸收发挥作用。
通用名:Fentanyl
商品名:Abstral
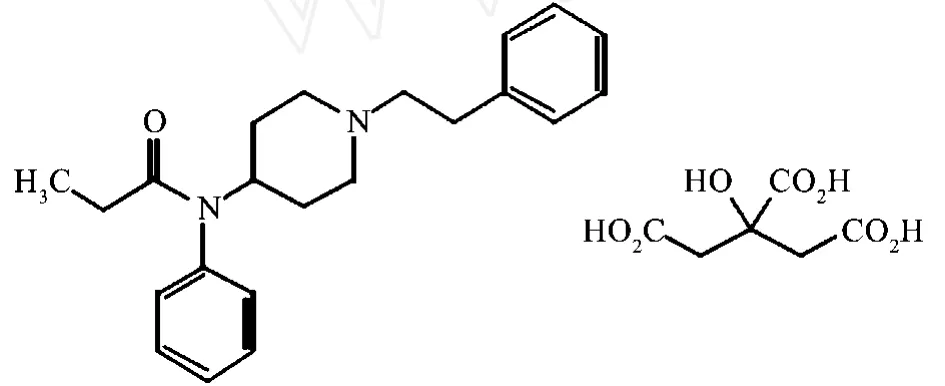
中文化学名:N-(1-苯乙基 -4-哌啶基)丙酰苯胺枸橼酸(1:1)
英文化学名:N-(1-Phenethyl-4-piperidyl)propionanilide citrate(1:1)
结构式:
1 作用机制
芬太尼是一种阿片类激动药,它的主要治疗作用是镇痛。其他已知的阿片类激动药包括吗啡、羟考酮、氢吗啡酮、可待因和氢可酮。
2 药效学
阿片类激动药的药理学作用包括抗焦虑、精神愉快、轻松感、呼吸抑制、便秘、瞳孔缩小、咳嗽抑制、痛觉消失。像所有阿片类激动镇痛药一样,随着芬太尼剂量的增加,疼痛感逐渐减轻。阿片类激动镇痛药没有确定的最大剂量,止痛效果的升限仅限于副作用,更严重的可能包括嗜睡和呼吸抑制。
3 药代动力学
吸收:芬太尼是一种高亲脂的药物。口服芬太尼有显著的肝与肠的首过效应。Abstral舌下含片中芬太尼的吸收主要是通过口腔黏膜。Abstral舌下含片的生物利用度为54%。100~800μgAbstral剂量范围内的药物动力学参数见表 1。这 4个剂量的 Abstral达到最大血浆浓度 (Tmax)的中位时间从 30 min到 60 min不等(范围:15~240 min)。分布:芬太尼脂溶性高。动物数据表明,口服后芬太尼迅速地分布于大脑、心脏、肺、肾和脾脏,接着经过缓慢地再分布至肌肉和脂肪。80%~85%的芬太尼与血浆蛋白结合。主要的结合蛋白是α-1-酸糖蛋白。酸血症时芬太尼的游离部分增加,在稳定状态(Vss)下平均分布容积为 4 L·kg-1。
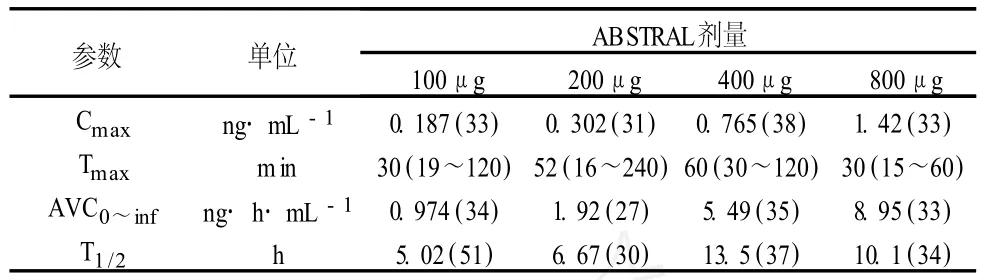
表 1 给予健康受试者 100、200、400和 800μg单次剂量的Abstral后芬太尼的平均(CV%)药物动力学参数(每个剂量水平 n=12)
代谢:芬太尼是在肝脏和肠粘膜中被微粒体混合功能氧化酶 P450(CYP 3A4)代谢成为去甲芬太尼 (norfentanyl)。在动物研究中没有发现去甲芬太尼有药理学活性。
排泄:90%以上的芬太尼经生物转化成N-脱烷基和羟基化无活性代谢产物后排除,少于 7%的芬太尼以原型从尿中排除,仅仅约 1%原型从粪便中排除。代谢产物主要从尿中排除,而很少经粪便排除。芬太尼的总血浆清除率为 0.5 L·(h·kg)-1[范围:0.3~0.7 L·(h·kg)-1]。
4 临床研究
一项采用双盲法、安慰剂控制、正交研究对 Abstral治疗突发性癌症疼痛的功效进行评估。在容许的副作用下,100~800μg剂量范围内采用标签公开逐步增加剂量法鉴别哪个剂量下的患者得到了适当的痛觉缺失。在双盲效能研究中,被鉴别为有效剂量的患者随机地排序,接受 10种疗法:7种Abstral剂量和 3种安慰剂。
在进入逐步增量期研究的 131名患者中,78名 (60%)在逐步增量期完成了有效剂量的鉴别,66名患者进入了双盲试验和 60名患者完成了研究。Abstral的剂量是从 100μg开始的逐步增量法来测定的。Abstral治疗突发性癌症疼痛的逐步增量的最终剂量不是预期的用于缓解持续的癌症疼痛的阿片类药物的每日维持剂量。在用相同的逐步增量法的二次标签安全性研究中,139名患者中有 96名患者(69%)进入了逐步增量至某一剂量的研究,该剂量下,在可容许的副作用内患者获得适当的痛觉缺失。双盲效能和标签公开安全性研究的逐步增量的最终剂量见表 2。
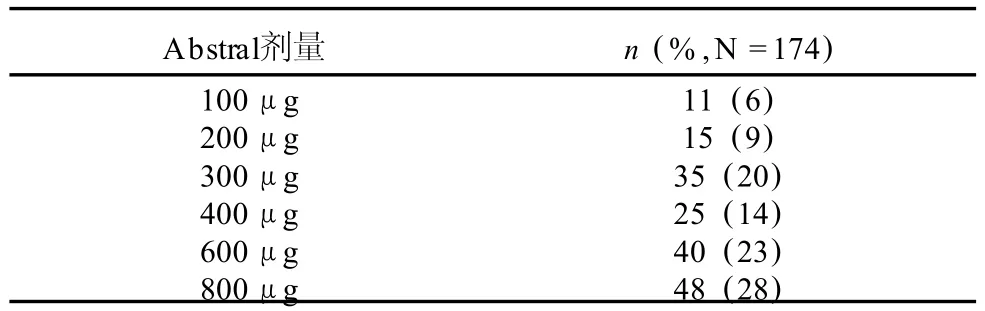
表 2 所有临床效能和安全性研究中从最初逐步增量开始的Abstral的最终剂量
根据初期的结果计算,Abstral治疗突发性疼痛平均疼痛强度差异之和(30 min),在统计学上比安慰剂治疗更加有效(见图 1)。
5 适应证
控制成人癌症患者的突发性疼痛。
6 规格
100μg、200μg、300μg、400μg、600μg和 800μg。
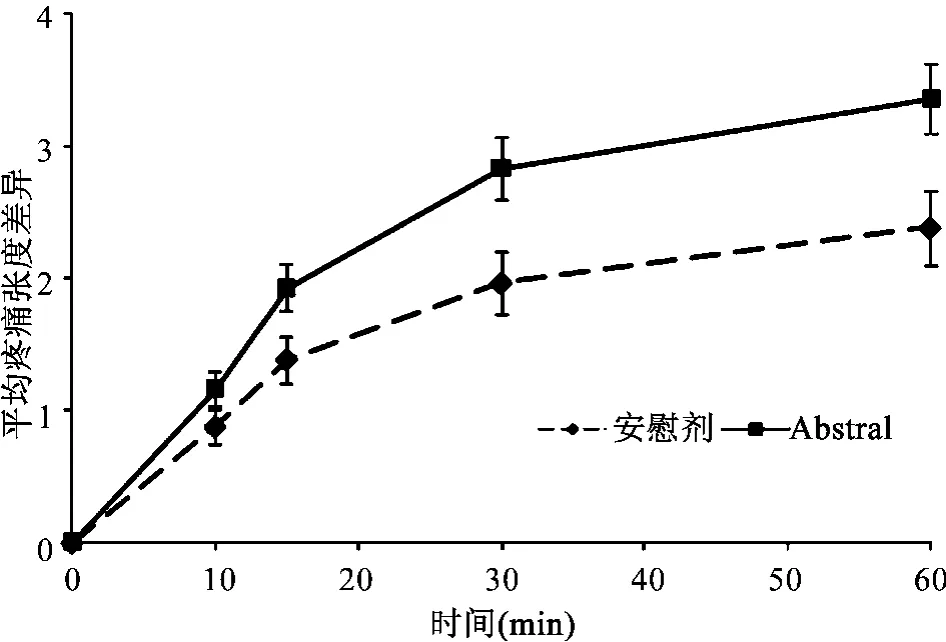
图 1 与安慰剂比较Abstral的平均疼痛强度差别(±SE)
7 不良反应
常见不良反应包括恶心、便秘、嗜睡和头痛。
- 药学研究的其它文章
- 正交试验优选天麻的提取工艺
- 影响聚丙烯输液瓶瓶形因素

