吡咯烷二硫代氨基甲酸酯对2型糖尿病大鼠心肌的保护作用*
朱铁年, 刘建坤, 刘桂红, 张玉娜, 张利众, 赵瑞景
(1中国人民解放军白求恩国际和平医院肿瘤科,河北石家庄050082;2河北医科大学第四医院内分泌科,河北石家庄050011;3河北医科大学免疫学教研室,河北石家庄050017)
动物实验表明,活性氧簇(reactive oxygen species,ROS)在糖尿病心肌病的发生中起重要作用[1]。临床资料显示,糖尿病患者未出现明显微血管病变时也可出现心力衰竭,提示有糖尿病心肌病(diabetic cardiomyopathy,DC)的发生。DC的发病机制迄今未完全明了。本研究以高脂喂养加小剂量链脲佐菌素(streptozotocin,STZ)腹腔注射建立的2型糖尿病大鼠模型为研究对象,通过使用抗氧化制剂吡咯烷二硫代氨基甲酸酯(pyrrolidine dithiocarbamate,PDTC)处理动物,观察氧化应激对糖尿病心肌病发生的影响及其PDTC的保护作用。
材料和方法
1 动物与饲料
健康8周龄雄性Wistar大鼠37只,体重180-210 g,购于河北医科大学动物中心。高脂饲料参照Reed等[2]报道的配方自行配制。
2 主要试剂
STZ及PDTC购自Sigma;抗诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和抗硝基酪氨酸(nitrotyrosine,NT)抗体购于Santa Cruz;免疫组化用PV6001、PV6002试剂盒及DAB显色剂购自北京中杉金桥生物技术有限公司。超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH -Px)和丙二醛(malondialdehyde,MDA)检测试剂盒购于南京建成生物公司。
3 方法
3.1 复制2型糖尿病模型 参照Reed等[2]方法建立2型糖尿病大鼠模型。37只大鼠适应性喂养普通饲料1周后,随机分成2组,12只为正常对照组(normal control,NC),喂普通饲料,25 只为高脂饮食组(high-fat diet,HFD),喂高脂饲料。饲养条件为:室温(23±3)℃,室内相对湿度 (50±5)%,自由光照。实验期间动物自由摄取食物和水,体重每周记录1次。喂养8周后,HFD组通过口服葡萄糖耐量试验和胰岛素敏感性试验证实产生胰岛素抵抗后,过夜禁食12 h,给予STZ(27 mg/kg)1次性腹腔注射,对照组给予同等量生理盐水腹腔注射,3 d后随机血糖大于11.1 mmol/L者为2型糖尿病模型成功。将造模成功的24只糖尿病大鼠随机分为2组:12只为糖尿病模型组(diabetes mellitus,DM组),12只为PDTC治疗组(PDTC组)。PDTC治疗组给予PDTC(50 mg/kg)腹腔注射,每天1次,连续注射1周,DM组和NC组大鼠给予同等量生理盐水腹腔注射。治疗1周后,过夜禁食12 h,留取血液标本,用于检测血糖及其它生化指标,断头处死各组大鼠,速取出心脏,冷生理盐水冲洗,滤纸吸干水分,取部分左心室组织固定于3%戊二醛中,用于电镜检测;部分组织于10%中性甲醛中固定后,行HE、免疫组化染色;部分组织经70%乙醇固定后,用于流式细胞仪检测;剩余组织置于液氮中冷冻保存备用。
3.2 血液生化指标测定 采用快速血糖仪检测血糖水平,血脂水平按照试剂盒方法测定。
3.3 心脏组织中氧化应激生化指标的测定 取出液氮中保存的左心室组织,于冰上制备组织匀浆,低温离心机3 000 r/min离心15 min,留取上清,严格按照试剂盒说明分别测定MDA的含量、SOD和GSHPx的活性。
3.4 心肌细胞凋亡细胞百分率检测 将经70%乙醇固定后的心肌组织,用搓网法制备成单细胞悬液,经碘化丙啶(propidium iodide,PI)于4℃染色30 min后,流式细胞仪测定凋亡细胞百分率。
3.5 电镜观察心脏超微结构 经3%戊二醛固定的心肌组织,制备电镜超薄切片,用透射电镜观察心脏的超微结构。
3.6 心脏组织形态学观察 取甲醛固定后的各组大鼠心脏组织,分别进行石蜡包埋、切片、HE染色及免疫组化等处理后,光镜观察心脏形态学变化及iNOS和NT的表达。
4 统计学处理
数据用SPSS 13.0软件包处理,计量资料以均数±标准差(±s)表示,组间差异比较采用单因素方差分析。
结 果
1 血液各项生化指标检测
糖尿病组大鼠各项血脂均明显高于正常对照组(P<0.05)。PDTC组大鼠除甘油三酯水平明显降低外,总胆固醇、低密度脂蛋白和游离脂肪酸均与糖尿病组无显著差异,见表1。
表1 各组间生化指标比较Table 1.Comparison of biochemical parameters among the three groups(±s.n=12)
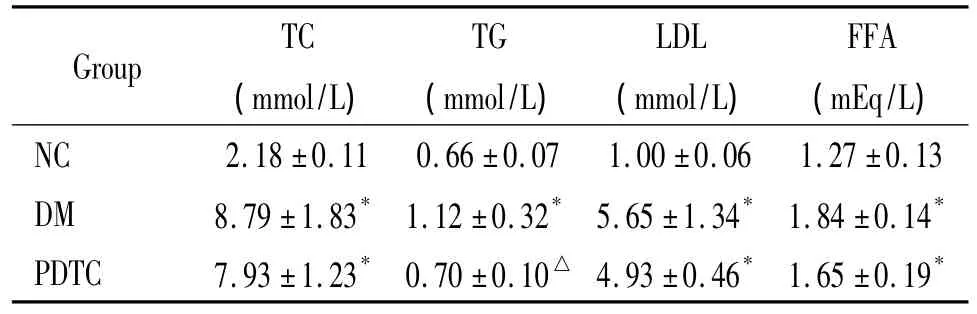
表1 各组间生化指标比较Table 1.Comparison of biochemical parameters among the three groups(±s.n=12)
*P <0.05 vs NC group;△P <0.05 vs DM group.NC:normal control group;DM:diabetes mellitus group;TC:total cholesterol;TG:triglycerides;LDL:low-density lipoprotein;FFA:free fatty acids.
Group TC(mmol/L)TG(mmol/L)LDL(mmol/L)FFA(mEq/L)NC 2.18 ±0.11 0.66 ±0.07 1.00 ±0.06 1.27 ±0.13 DM 8.79 ±1.83* 1.12 ±0.32* 5.65 ±1.34* 1.84 ±0.14*PDTC 7.93 ±1.23* 0.70 ±0.10△ 4.93 ±0.46* 1.65 ±0.19*
2 血糖水平
糖尿病组大鼠空腹血糖为(26.55±2.90)mmol/L,比正常对照组[(5.58 ±0.43)mmol/L]明显增高,显著差异(P<0.01)。PDTC治疗组空腹血糖为(11.55±2.89)mmol/L,比糖尿病组明显降低 (P <0.01),见图 1。
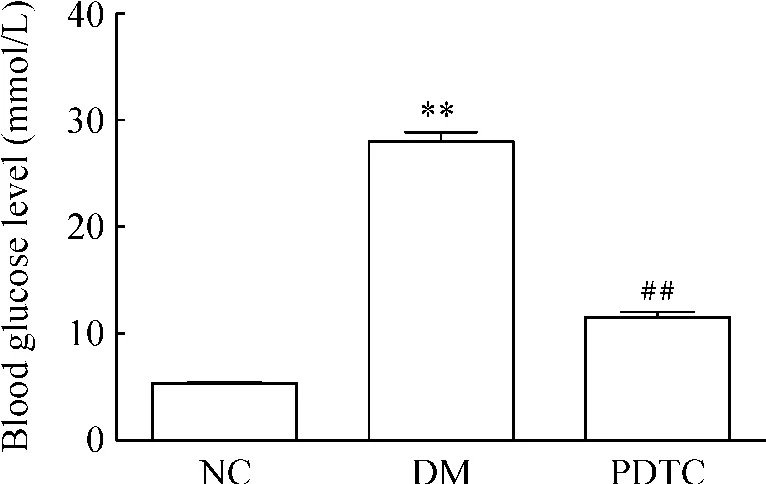
Figure 1.Blood glucose level in various groups.±s.n=12.**P <0.01 vs NC group;##P <0.01 vs DM group.图1 各组大鼠血糖水平
3 心肌组织中SOD、GSH-Px活性和MDA含量
糖尿病组SOD和GSH-Px活性明显低于正常对照组(P<0.01),PDTC治疗后SOD和GSH-Px活性较糖尿病组明显升高(P<0.01或P<0.05);糖尿病组MDA含量明显高于正常对照组(P<0.01),PDTC治疗后MDA含量较糖尿病组明显降低(P <0.01),见表 2。
表2 各组大鼠心肌组织MDA含量、SOD和GSH-Px活性比较Table 2.Camparison of MDA content,SOD and GSH -Px activity in cardiac tissues in each group(±s.n=12)
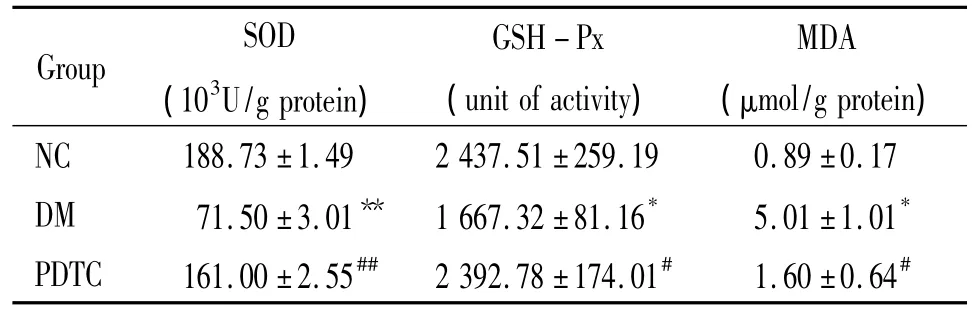
表2 各组大鼠心肌组织MDA含量、SOD和GSH-Px活性比较Table 2.Camparison of MDA content,SOD and GSH -Px activity in cardiac tissues in each group(±s.n=12)
*P <0.05,**P <0.01 vs NC group;#P <0.05,##P <0.01 vs DM group.SOD:superoxide dismutase;GSH - Px:glutathione peroxidase;MDA:malondialdehyde.
Group SOD(103U/g protein)GSH-Px(unit of activity)MDA(μmol/g protein)NC 188.73 ±1.49 2 437.51 ±259.19 0.89 ±0.17 DM 71.50 ±3.01** 1 667.32 ±81.16* 5.01 ±1.01*PDTC 161.00 ±2.55## 2 392.78 ±174.01# 1.60 ±0.64#
4 心肌细胞凋亡百分率
糖尿病组大鼠心肌细胞凋亡百分率明显高于正常对照组(P<0.01);PDTC治疗1周后凋亡率明显低于糖尿病组(P<0.05),见表3。
表3 各组大鼠心肌细胞凋亡百分率Table 3.The apoptotic rate of cardiac cells in each group(%.±s.n=12)
**P <0.01 vs NC group;#P <0.05 vs DM group.
NC 18.75 ±3.47 DM 25.88 ±1.63**PDTC 20.99 ±4.01#
5 心肌超微结构改变
透射电镜观察心肌超微结构显示,正常对照组:肌节对位整齐,线粒体结构完好;糖尿病组:部分肌节错位,线粒体有嵴和膜的损伤,线粒体髓样化,内质网扩张,糖原颗粒堆积,有脂滴;PDTC治疗组:肌节对位基本整齐,线粒体内只见很少数嵴溶解,肌浆网扩张有改善,见图2。
6 心肌病理形态改变及免疫组化结果
经HE染色光镜下观察发现,糖尿病组心肌纤维排列紊乱,心肌细胞变性坏死,心肌细胞间有脂肪细胞、炎症细胞浸润;PDTC治疗组大鼠心肌损伤较糖尿病组明显减轻。免疫组化结果显示,iNOS和NT阳性表达信号呈棕黄色,糖尿病组大鼠心肌iNOS和NT染色明显强于正常对照组;PDTC治疗组iNOS和NT染色明显弱于糖尿病组,见图3。
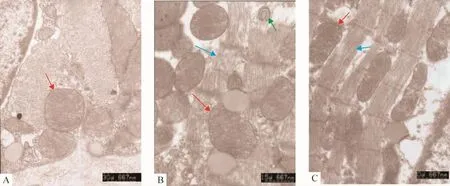
Figure 2.The ultrastructural changes of cardiac cells in each group(×15 000).A:NC group;B:DM group;C:PDTC group.Red arrows show mitochondria,blue arrows show the cardiac muscle rods and green arrow shows mitochondrial damage.图2 各组心肌细胞超微结构变化
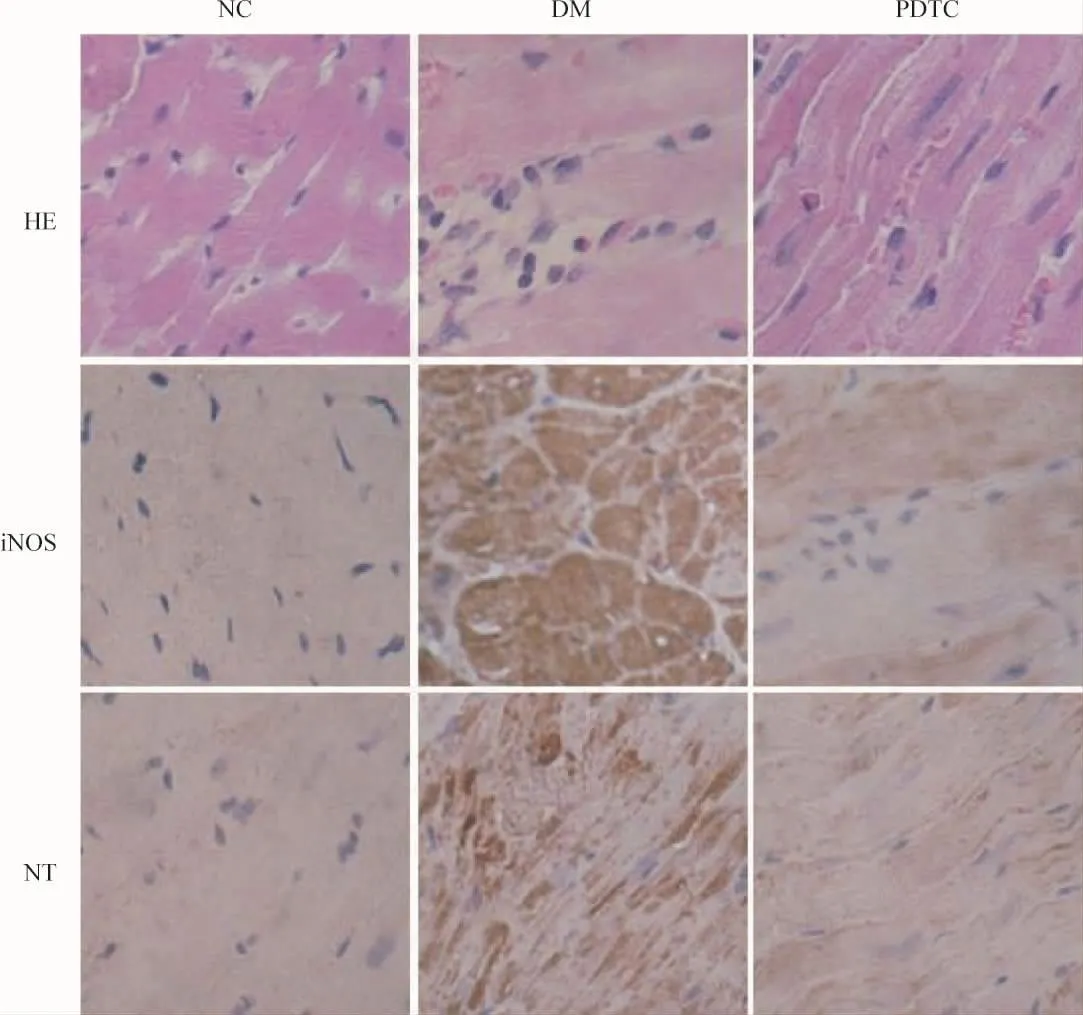
Figure 3.Thc morphological changes and immunohistochemistry results of heart tissues in the three groups(×400).图3 各组大鼠心肌HE及免疫组化染色结果
讨 论
氧化应激(oxidative stress)是由于自由基与抗氧化系统失衡,使得机体促氧化能力高于抗氧化能力而造成的。已有研究发现,无论是1型还是2型糖尿病,都存在明显的氧化应激现象[3]。氧化应激已经被认为是糖尿病各种并发症的共同发病途径[4]。
心肌中线粒体含量丰富,约占心肌面积的50%,线粒体功能发生轻微的变化就能引起心肌细胞的巨大变化[5]。在糖尿病状态下,线粒体既是ROS过度产生的部位也是ROS作用的靶点,并形成正反馈。当自由基产生过多,超过抗氧化酶的清除能力时,终将导致线粒体通透性改变及其功能紊乱,影响心肌收缩和舒张功能,促进糖尿病心肌病的发生[6,7]。高血糖可使细胞内ROS生成增多,引起NF-κB活化。NF-κB活化后能调控其下游一系列基因如前炎症性细胞因子肿瘤坏死因子α(TNF-α)、iNOS等的表达。iNOS表达增多,诱导产生大量的NO,活化的炎细胞释放超氧阴离子()。NO可与迅速结合生成氧化作用更强的过氧亚硝基阴离子(ONOO-),ONOO-可使蛋白质酪氨酸残基或游离酪氨酸发生硝基化反应,形成最终产物NT。蛋白质硝基化后能诱导酶活性丧失、细胞坏死和凋亡[8,9]。抗氧化剂可以抑制ROS的产生,减少DNA的氧化损伤,降低脂质过氧化,改善体内抗氧化防御体系,防止氧化应激引起的疾病或并发症的发生[10]。
本研究发现,糖尿组大鼠心肌中MDA明显高于正常对照组,SOD和GSH-Px活性显著低于正常对照组;糖尿病组心肌iNOS、NT表达均明显高于正常对照组。这些结果表明,糖尿病大鼠心肌处于氧化和抗氧化失衡状态,于是导致线粒体损伤、细胞凋亡增加。
PDTC为二硫氨基酸酯,因其分子含有巯基(thiol)结构,具有抗氧化及金属螯合作用。已有研究表明,PDTC可降低糖尿病大鼠血糖[11]。我们的研究结果也证明,PDTC可明显降低糖尿病大鼠的血糖水平,其机制与PDTC能抑制肝糖异生和促进肝糖原合成有关[12]。PDTC还是一种高效的NF-κB抑制剂,可有效抑制氧化应激所致的NF-κB活化,减少多种炎症介质的生成[13]。因此推测,PDTC可能还可通过抗氧化作用防止或减轻糖尿病心肌病的发生。我们的研究证实,经PDTC治疗后,糖尿病大鼠心肌组织MDA明显下降,SOD、GSH-Px活性显著升高,iNOS和NT表达明显减少,心肌病变明显减轻。本研究为抗氧化剂在预防糖尿病并发症发生发展方面提供了实验依据。
[1]Aydemir-Koksoy A,Bilginoglua A,Sariahmetoglu M,et al.Antioxidant treatment protects diabetic rats from cardiac dysfunction by preserving contractile protein targets of oxidative stress[J].J Nutr Biochem,2010,21(9):827 -833.
[2]Reed MJ,Meszaros K,Entes LJ,et al.A new rat model of type 2 diabetes:the fat-fed,streptozotocin-treated rat[J].Metabolism,2000,49(11):1390 -1394.
[3]Simmons RA.Developmental origins of diabetes:The role of oxidative stress[J].Free Radic Biol Med,2006,40(6):917-922.
[4]Giacco F,Brownlee M.Oxidative stress and diabetic complications[J].Circ Res,2010,107(9):1058 -1070.
[5]Morin D,Pires F,Plin C,et a1.Role of the permeability transition pore in cytochrome C release from mitochondria during ischemia - reperfusion in rat liver[J].Biochem Pharmacol,2004,68(10):2065 -2073.
[6]Nishikawa T,Edelstein D,Du XL,et a1.Normalizing mitochondrial superoxide production blocks three pathways of hyperglycaemic damage[J]. Nature,2000,404(6779):787-790.
[7]Pieoni L,Quagliaro L,Ceriello A.Oxidative stress in diabetes[J].Clin Chem Lab Med,2003,41(9):1144 -1149.
[8]Virág L,Szabó E,Gergely P,et al.Peroxynitrite - induced cytotoxicity:mechanism and opportunities for intervention[J].Toxicol Lett,2003,140 -141:113 -124.
[9]Drel VR,Pacher P,Stevens MJ,et al.Aldose reductase inhibition counteracts nitrosative stress and poly(ADP-ribose)polymerase activation in diabetic rat kidney and high-glucose-exposed human mesangial cells[J].Free Radic Biol Med,2006,40(8):1454-1465.
[10]Montanari D,Yin H,Dobrzynski E,et al.Kallikrein gene delivery improves serum glucose and profiles and cardiac function in streptozotocin - induced diabetic rats[J].Diabetes,2005,54(5):1573 -1580.
[11]Stosic-Grujicic SD,Miljkovic DM,Cvetkovi ID,et al.Immunosuppressive and anti-inflammatory action of antioxidants in rat autoimmune diabetes[J].J Autoimmun,2004,22(4):267-276.
[12]张利众,赵瑞景,刘建坤,等.吡咯烷二硫代氨基甲酸酯对2型糖尿病大鼠肝糖原合成的影响[J].中国病理生理杂志,2010,26(12):2442 -2446.
[13]Lee FT,Cao Z,Long DM,et al.Interactions between angiotensin II and NF-κB dependent pathways in modulating macrophage infiltration in experimental diabetic nephropathy[J].J Am Soc Nephrol,2004,15(8):2139 -2151.

