PSMA对LNCaP细胞生长、迁移及ERK蛋白活性的影响*
郭正辉, 黄 海, 杜 涛, 许可慰, 曹 亿, 陈杰青,董 文, 姚友生, 林天歆, 谢文练, 江 春, 韩金利, 黄 健△
(中山大学孙逸仙纪念医院1泌尿外科,2产科实验室,广东广州510120)
前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)是存在于前列腺细胞膜的一种Ⅱ型跨膜蛋白。1987年Horoszewicz等[1]报道在前列腺细胞上的PSMA具有很高的组织特异性,且在激素难治和发生转移的前列腺癌患者中不像前列腺特异性抗原(prostate-specific antigen,PSA)表达减弱,反而会增加。而近年来发现PSMA不仅是前列腺癌高特异性的瘤标,而且有着受体、营养摄取、信号转导、细胞迁移等多方面功能[2]。丝裂原活化蛋白激酶/胞外信号调节激酶(mitogen-activated protein kinases/extracellular signal-regulated protein kinases,MAPK/ERK)途径是 MAPK信号系统中最重要一条通路,它通过Ras/Raf/MEK/ERK级联反应从胞外受体调节转录因子,从而调控基因表达[3]。近年来的研究显示ERK途径的激活与前列腺癌恶化、进展密切相关。PD98059能和ERK上游信号MEK选择性结合,直接阻断ERK蛋白的磷酸化过程,是可逆的、胞膜通透的抑制剂。在本研究中,我们利用前期实验[4]通过RNAi技术获得的沉默PSMA表达的LNCaP细胞作为实验对象,在一般外环境及ERK磷酸化受抑制的情况下,探讨PSMA与LNCaP细胞内ERK蛋白的活性及细胞生长、迁移的关系。
材料和方法
1 材料
PSMA基因被沉默的前列腺癌LNCaP细胞株(实验组)、转染对任何基因无干扰作用siRNA的LNCaP细胞株(空转组)、未经处理的LNCaP细胞株(对照组),由本课题组培养并提供[8];RPMI-1640培养基、胎牛血清(Hyclone);0.25%胰酶(吉玛公司);MTT试剂盒(碧云天公司);Transwell板(Corning);蛋白提取试剂盒(含RIPA、PSMF,碧云天);兔抗人磷酸化ERK1/2多克隆抗体(北京博奥森);兔抗人PSMA单克隆抗体(Abcam,ab76104);3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate hydoxygenase,GADPH)内参照抗体(Santa Gruz);辣根过氧化物酶(peroxidase horseradish,HRP)标记羊抗兔抗体(ICL);PD98059(Merck);BCA法蛋白定量试剂盒(上海申能博采);柯达黑白胶片;增强化学发光(enhanced chemiluminescence,ECL)试剂盒(Thermo)、超敏ECL试剂盒(Millipore);免疫组化染色试剂盒、浓缩型DAB试剂盒(中杉金桥);其它试剂均为进口和国产分析纯,实验仪器均由中山大学孙逸仙纪念医院医学研究中心提供。
2 方法
2.1 细胞培养与镜下观察 实验组、对照组、空转组细胞于含100 mL/L FBS,100 g/L青霉素,1×105U/L链霉素的RPMI-1640培养基中培养,置于37℃、50%CO2培养箱培养,细胞每3-4 d换液,80%融合后1∶4传代,每天观察记录。PD98059溶于甲醇中(0.7 g/L),分装备用。
2.2 3组细胞MAPK通路ERK蛋白活性检测
①Western blotting 对照组、空转组、实验组3组细胞按3×106个细胞种于6孔板中,细胞贴壁后予无血清RPMI-1640培养基换液。24 h后,一部分细胞予同样无血清培养基换液,另一部分细胞予含25 μmol/L PD98059的无血清培养基更换,全部细胞再于培养箱中孵育30 min,即用蛋白提取试剂盒提取细胞总蛋白:吸除培养基,冰上RIPA按70 μL/well,PMSF按RIPA的1/100加入,冰上裂解30 min。刮取裂解细胞于4℃、14 000 r/min离心30min,取上清为细胞总蛋白。BCA法蛋白定量,分别按50 μg/well和30 μg/well于12%SDS-PAGE行3组细胞PSMA和磷酸化ERK蛋白分离,转于PVDF膜上,剪取目的条带,5%脱脂奶封闭3h,孵PSMA(1∶1 000)Ⅰ抗、p- ERK(1∶300)Ⅰ抗和 GAPDH(1∶10 000)过夜,第 2 d孵HRP标记Ⅱ抗(1∶1 000)1 h,暗室中加入发光液,其中PSMA使用超敏ECL发光液;p-ERK使用ECL发光液。黑白胶片曝光。
②细胞免疫化学 3组细胞于24孔板中种板,约5×104/well,贴壁后予无血清RPMI-1640培养基换液。24 h后,一般培养基及抑制磷酸化ERK蛋白的外环境处理同Western blotting,全部细胞孵育30 min后,用4%多聚甲醛固定30 min,每孔加1滴0.3%Triton,破裂细胞膜,室温下孵育15 min,每孔加1滴过氧化物酶阻断液,阻断内源性过氧化物酶活性,室温孵育10 min。而后每孔加1滴p-ERK多克隆抗体(1∶200),设立空白对照复孔滴加PBS,4℃过夜。第2 d 37℃复温45 min,每孔加1滴生物素化Ⅱ抗,室温孵育15 min。每孔滴加辣根酶标记链霉卵白素工作液50 μL,37℃孵育15 min,滴加2滴新鲜配制DAB溶液,并在镜下观察确定显色时间。自来水冲洗,苏木素染核,自来水冲洗泛蓝,吸除上清液,镜下观察。每孔随机选取5个高倍视野(10×20)。确定细胞阳/阴性染色较为主观,因此选取1个较为浅染的细胞为标准细胞,浓于标准细胞为阳性细胞,浅于标准细胞为阴性细胞,并对3组细胞p-ERK的表达进行统计学分析。
2.3 3组细胞生长、迁移能力检测
①MTT检测3组细胞的增殖能力 分别取对数生长期的实验组、对照组和空转组细胞,吸去培养基,每瓶细胞用0.25%胰酶1 mL消化60 s,后用含10%FBS的RPMI-1640培养基终止消化,吸管轻轻吹打20次,移入无菌离心管,1 000 r/min离心5 min,分别用含10%FBS的RPMI-1640培养基和加入PD98059 25 μmol/L的上述培养基重悬离心后细胞,通过细胞计数板人工计数,以2 000/well接种于96孔板,每孔体积200 μL,每组设4个复孔,种板后置于37℃、5%CO2培养箱培养,每4 d予相应的培养基换液1次。到检测时点取出需检测的培养板,往每个培养孔中加入5 g/L MTT 20 μL,继续于37℃、5%CO2培养箱培养4 h后取出,吸净培养孔中液体,每孔加入150 μL的DMSO,置于摇床上匀速摇5 min,在分光光度计上测各组细胞的A492值,每12 h测定1 块 96 孔板,分别于 12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h 8 个时点检测,复孔检测结果取均值并绘制生长曲线。
②Transwell迁移实验 分别取对数生长期的实验组、对照组和空转组细胞,实验前予无血清RPMI-1640培养基处理,24 h后吸去培养液,每瓶细胞加入0.25%胰酶1 mL消化60 s,后用含10%FBS的RPMI-1640培养基1.5 mL终止消化,吸管轻轻吹打20次,移人无菌离心管,1 000 r/min离心5 min,弃掉离心后培养基,分别用含10%FBS的RPMI-1640培养基和加入PD98059 25 μmol/L的上述培养基重悬,通过细胞计数板人工计数,以100 μL培养基中含1×105个细胞接种于Transwell孔板上室,下室加入500 μL含40%FBS的 RPMI-1640培养基,种板后置于37℃、5%CO2培养箱培养18 h后,取出上室,弃掉其中培养基,用棉签拭净上室内表面细胞,浸泡于40 mL/L新鲜配置的多聚甲醛溶液中固定15 min,自然晾干后,浸泡于结晶紫中染色20 min,棉签蘸去上室细胞,在倒置显微镜下放大200倍计数取景框中移至微孔膜下层的细胞。平均每个小室计数10个视野。取平均值分析细胞的穿透能力。
3 统计学处理
结 果
1 MAPK通路ERK蛋白活性检测
1.1 Western blotting结果 由图1A看出一般培养基中,对照组和空转组细胞PSMA都有较强的表达,实验组因为PSMA基因受干扰表达下降;实验组p-ERK1/2的表达明显低于对照组和空转组。含PD98059培养基中3组细胞p-ERK蛋白均处于低水平。图1B为Western blotting实验结果通过软件Adobe Photoshop CS进行灰度分析、数据统计后绘制的条图。一般培养基中,实验组PSMA和p-ERK1/2表达低于对照组和空转组,均有显著差异(P<0.05);一般培养基中实验组与含PD98059培养基的3组细胞p-ERK1/2表达相似。
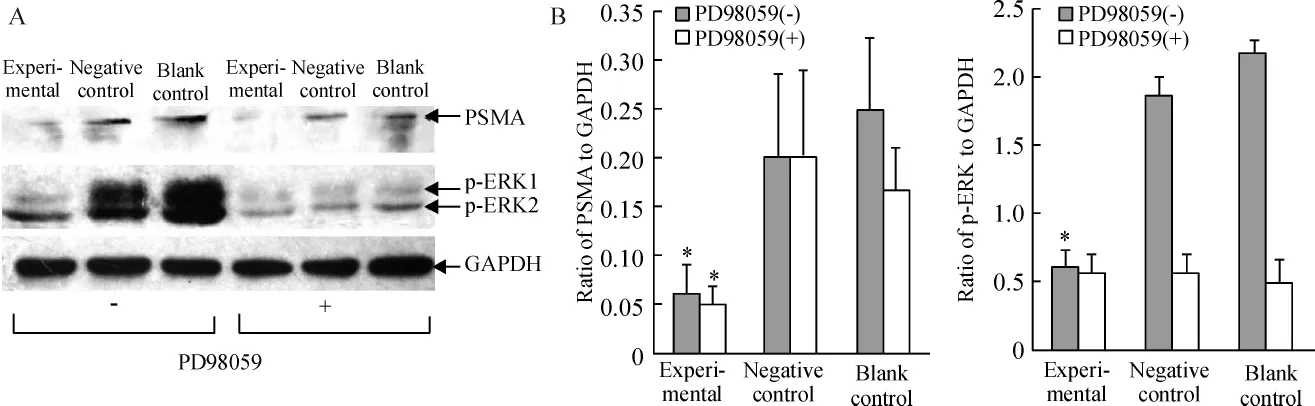
Figure 1.The expression of PSMA and phospho-ERK1/2 were evaluated by Western blotting.A:expression of PSMA in LNCaP cells from experimental group was attenuated because of its gene silienced by RNAi and expression of phospho-ERK1/2 also declined compared to blank control and negative control.In LNCaP cells treated with PD98059,an inhibitor of ERK phosphorylation,phospho-ERK1/2 were decreased in the three groups and expression of PSMA seemed no change.B:the bar charts showed the expression of PSMA and phospho-ERK1/2.±s.n=3.*P<0.05 vs blank and negative controls.图1 3组细胞及磷酸化ERK抑制状态下Western blotting检测结果
1.2 细胞免疫化学检测结果 图2为标准细胞以及各组中p-ERK1/2免疫化学和PBS阴性对照结果。一般培养基中,对照组和空转组染色较明显,实验组染色较弱。3组细胞阳性率的比较见表1,对照组和空转组相比无显著差异;实验组和对照组、空转组之间均有显著学异(P<0.01)。含PD98059培养基中,3组细胞染色均较浅,阳性细胞较少,组间无显著差异,且阳性率与一般培养基中的实验组相似。
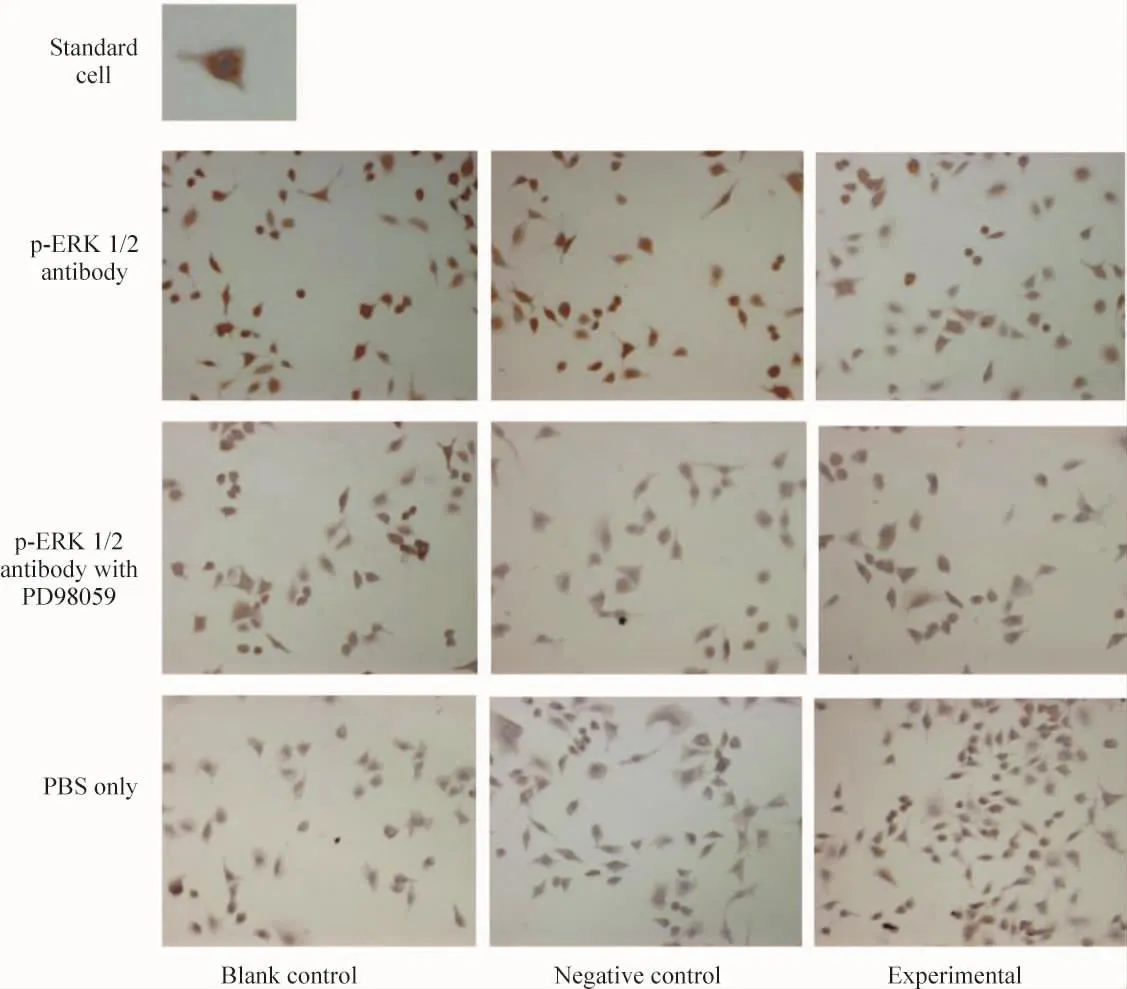
Figure 2.The phospho-ERK1/2 protein was tested by immuocytochemical method(×200).The images showed that without PD98059,the level of phospho-ERK1/2 in experimental group was lower than that in blank and negative controls.Treated with PD98059,the cells in all three groups expressed phospho-ERK1/2 protein at a low level and there was no obvious diffenrence among them.The cells noted as“positive”when their staining was darker than that of standard cells,and the others noted as“negative”.图2 免疫细胞化学检测3组细胞及PD98059抑制效应下磷酸化ERK1/2表达
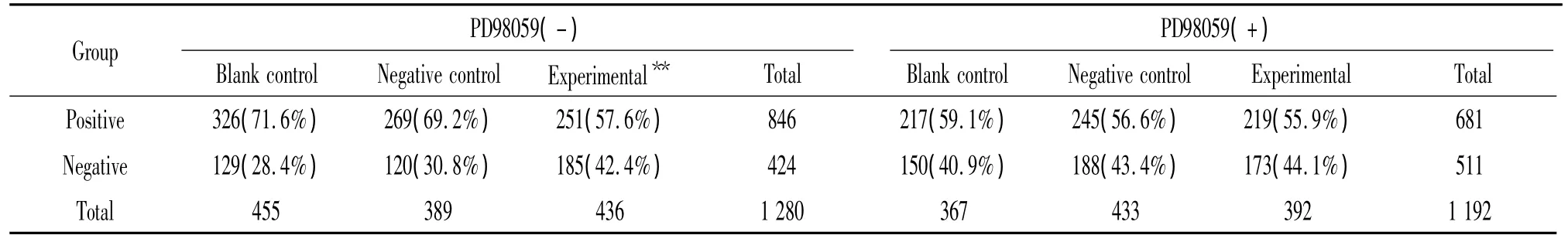
表1 3组细胞及PD98059抑制后磷酸化ERK1/2蛋白阳性率的比较Table 1.The counting of phospho-ERK1/2 positive cells in the three groups with or without PD98059 after immunochemical staining
表2 各组细胞及PD98059处理后Transwell迁移实验显示穿透细胞数Table 2.The quantities of migrated cells in the three groups with or without PD98059(±s.n=30)

表2 各组细胞及PD98059处理后Transwell迁移实验显示穿透细胞数Table 2.The quantities of migrated cells in the three groups with or without PD98059(±s.n=30)
*P <0.05 vs blank control and negative control.
PD98059(-)PD98059(+)Blank control Negative control Experimental 15.37 ±4.58 13.56 ±5.63 10.98 ±7.35 Blank control Negative control Experimental Cell number 40.68 ±6.39 34.33 ±5.82 12.39 ±6.52*
2 生长、迁移能力检测
2.1 MTT检测结果 结果见图3。一般培养基中,实验组的细胞增殖能力明显下降,种板后96 h未出现对数生长,而对照组和空转组分别在种板后48 h出现对数生长。48 h后实验组与对照组和空转组相比A492均有显著差异(P<0.05)。含PD98059培养基中,3组细胞生长速度普遍较低,48 h后对照组和空转组A492分别与一般培养基A492相比有显著差异。
2.2 Transwell结果 实验组的穿透细胞数较对照组及空转组明显减少。含PD98059培养基中,3组细胞穿透细胞数都较少,见图4A。在一般培养基中,实验组细胞的侵袭能力较对照组及空转组有下降,差异显著(P<0.05)。含PD98059培养基的3组细胞与一般培养基实验组穿透细胞数无明显差异,见图 4、表 2。
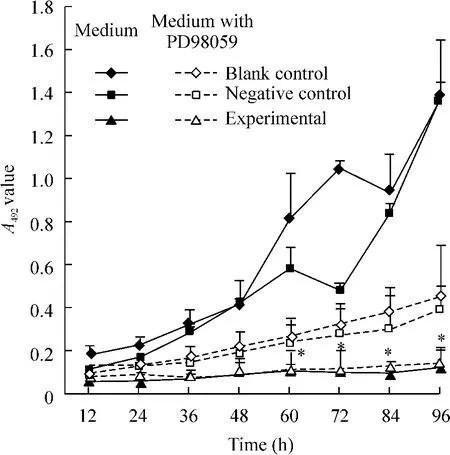
Figure 3.The growth curves of LNCaP cells in the three groups were evaluated by MTT(A492)with or without PD 98059.The blank and negative controls without PD 98059 got into log phase of growth in 48 h,while the cells in the experimental group was still at a low level of growth.±s.n=5.*P < 0.05 vs blank or negative control.图3 MTT检测3组细胞及在PD 98059环境中生长曲线结果
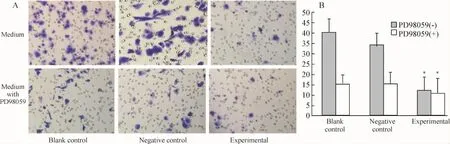
Figure 4.The Transwell assay showed the migration ability of LNCaP cells of the three groups(×200).A:in normal medium,the quantity of migrated cells in experimental group was much less than those in blank and negative control groups.Treated with PD98059,the number of migrated cells in three groups was significantly decreased.B:the bar chart showed the counting result of Transwell assay.±s.n=3.*P<0.05 vs blank contrd or negetive control.图4 3组细胞及PD98059处理后的Transwell迁移结果
讨 论
本研究对上述3组细胞在一般培养基及PD98059抑制效应下进行磷酸化ERK蛋白表达水平的检测及生长、迁移能力的初步评估。在一般培养基中,实验组磷酸化ERK蛋白水平相应地低于对照组和空转组,并有显著差异;实验组生长迁移能力也显著低于对照组和空转组。在含有PD98059对ERK激活有抑制效应的培养基中,磷酸化ERK蛋白水平均较低,生长迁移能力都较弱,且与一般培养基中实验组所表现出来的效应几乎一致。综上所述,一般培养基中实验组可能由于PSMA基因被沉默,细胞磷酸化ERK表达、生长迁移能力低于对照组和空转组,而用PD98059选择性抑制ERK蛋白磷酸化后,3组细胞磷酸化ERK表达、生长迁移能力都处于低水平,近似于一般培养基中实验组的效果。MAPK/ERK途径是哺乳动物中研究得最早、最深入的一条信号通路,是MAPK最重要的一条途径。MAPK参与细胞的多种生物学行为,包括基因的转录、细胞分化及增殖、细胞周期调控、维持细胞生存以及细胞恶性化等。目前许多研究[5-8]支持 MAPK/ERK途径的激活与前列腺癌生物学行为,恶化呈正相关。因此,我们推测PSMA可能是通过上调MAPK/ERK途径的活性,从而实现对LNCaP细胞生长、迁移的正性调节;抑制该通路磷酸化过程,PSMA的上调效应随之减弱或消失。
PSMA是一种Ⅱ型跨膜糖蛋白,由前列腺上皮细胞分泌,其氨基端位于细胞膜内,分子量约为100 kD,共含750个氨基酸,其中胞外段707个,跨膜段24个,胞内段19个。人PSMA基因全长62 035 bp,定位于染色体11p11-p12,包括19个外显子和18个内含子,其cDNA全长2 650 kb。PSMA在正常前列腺、良性前列腺增生和前列腺癌组织中均有表达,其中在前列腺癌组织中表达水平明显升高,并且与Gleason评分存在相关性,在转移性癌及非激素依赖型前列腺癌组织中表达水平更高[9]。PSMA在多种非前列腺恶性肿瘤脉管系统中也有一定表达,这些恶性肿瘤主要包括肾细胞癌、膀胱移行细胞癌、睾丸胚胎瘤、结肠腺癌、非小细胞肺癌等[10,11],而在前列腺外的其它正常组织,如膀胱、肾脏近端小管、肝脏、食管、近端小肠等,则处于较低水平的表达,其浓度相比在前列腺组织平均要低2-3个数量级[12,13]。
PSMA不仅具有多种蛋白酶活性,参与营养物质的摄取,而且参与跨膜信号转导和细胞的内化作用,故推断其可能是一多功能蛋白[14]。其蛋白酶活性主要为谷氨酸羧肽酶Ⅱ的活性。其它不同领域对PSMA的研究导致其命名有所不同:在中枢神经系统,参与脑神经递质N-乙酰天冬氨酰谷氨酸(NAAG)的代谢,被命名为N-乙酰化α-连接酸性二肽酶(NAALADase)[15];在近端小肠,能从多聚 γ 谷氨酸叶酸盐水解下末端谷氨酸,被命名为叶酸水解酶(FOLH)[16]。然而我们认识到PSMA的酶活性在2种底物中是相同的,都是水解末端谷氨酸,而谷氨酸的释放可能对激活细胞内转导通路起作用。由于PSMA的水解作用,游离出来的谷氨酸可以激活细胞膜上的谷氨酸受体[17],调节 K+、Ca2+通道改变静息电位,进一步导致Ca2+的持续内流[18]。内流Ca2+可能通过多种途径激活 Ras蛋白[19],随之级联激活Ras/Raf-1/MEK/ERK细胞转导通路,即 MAPK/ERK途径。由此,我们认为磷酸化ERK的激活可能是由于PSMA的水解活性,通过谷氨酸及Ca2+介导,激活ERK蛋白,产生生物学效应。本研究在一般培养基实验组的LNCaP细胞PSMA被沉默而表达下调,随之ERK蛋白活性降低,导致了生长、迁移能力的下降;受PD98059对ERK活化的抑制作用后,对照组、空转组的生长、迁移行为也在较低水平。
PSMA与前列腺癌的恶性程度存在一定相关性,说明研究PSMA在前列腺癌的生长迁移及前列腺癌发生机制中的作用具有重要意义。既往国内外研究者对PSMA的研究主要集中于其高特异性瘤标的临床应用上,对其潜在功能没有明确系统的研究,本研究显示PSMA可能有促进前列腺癌细胞生长、迁移能力的作用,并推测与MAPK/ERK途径被激活有关。目前国内外关于PSMA对前列腺癌发生发展的作用存在分歧[20-23],然而 Yao 等[24]指出存在差异的原因可能与细胞培养外环境的叶酸水平有关,低于或正常生理量叶酸情况下PSMA可能是由于其酶学活性导致对前列腺癌细胞的正性调节;远高于生理量的叶酸环境掩盖了其酶学活性可能会导致PSMA对前列腺癌负性调节的发生。虽然本研究使用的RPMI-1640培养基高于生理量,但可能由于实验前细胞的饥饿处理和换液间隔较长,使得叶酸水平下降,因此结果提示PSMA在LNCaP细胞生长、迁移呈正性调节作用,并指出可能与MAPK/ERK途径的活化有关。PSMA在前列腺癌中的作用及其调控机制尚待进一步阐明,本研究为更深入研究这一机制提供了一定的理论基础。
[1]Horoszewicz JS,Kawinski E,Murphy GP,et al.Monoclonal antibodies to a new antigenic marker in epithelial prostatic cells and serum of prostatic cancer patients[J].Anticancer Res,1987,7(5B):927 -935.
[2]Rajasekaran AK,Anilkumar G Christiansen JJ.Is prostate-specific membrane antigen a multifunctional protein?[J].Am J Physiol Cell Physiol,2005,288(5):C975 -C981.
[3]McCubrey JA,Steelman LS,Chappell WH,et al..Roles of the Raf/MEK/ERK pathway in cell growth,malignant transformation and drug resistance[J].Biochim Biophys Acta,2007,1773(8):1263-1284.
[4]郭正辉,黄 海,杜 涛,等.构建PSMA shRNA慢病毒载体转染293T细胞后PSMA mRNA和蛋白的表达变化[J].中国病理生理杂志,2008,24(10):1886 -1890.
[5]Hassan S,Dobner PR,Carraway RE.Involvement of MAP-kinase,PI3-kinase and EGF-receptor in the stimulatory effect of Neurotensin on DNA synthesis in PC3 cells[J].Regul Pept,2004,120(1 -3):155 -166.
[6]Ruscica M,Dozio E,Motta M,et al.Modulatory actions of neuropeptide Y on prostate cancer growth:role of MAP kinase/ERK 1/2 activation[J].Adv Exp Med Biol,2007,604(2):96 -100.
[7]Kinkade CW,Castillo-Martin M,Puzio-Kuter A,et al.Targeting AKT/mTOR and ERK MAPK signaling inhibits hormone-refractory prostate cancer in a preclinical mouse model[J].J Clin Invest,2008,118(9):3051 - 3064.
[8]叶定伟,李 慧,Priscilla Chauvin,等.有丝分裂激活蛋白激酶激活与前列腺癌的恶化进展[J].肿瘤防治杂志,2002 ,9(2):157 -159.
[9]Kawakami M,Nakayama J.Enhanced expression of prostate-specific membrane antigen gene in situ hybridization[J].Cancer Res,1997,57(12):2321 -2324.
[10]Liu H,Moy P,Kim S,et al.Monoclonal antibodies to the extracellular domain of prostate-specific membrane antigen also react with tumor vascular endothelium[J].Cancer Res,1997,57(17):3629 -3634.
[11]Chang SS,Reuter VE,Heston WD,et al.Five different anti- prostate-specific membrane antigen(PSMA)antibodies confirm PSMA expression in tumor-associated neovasculature[J].Cancer Res,1999,59(13):3192 -3198.
[12]Fair WR,Israeli RS,Heston WD.Prostate-specific membrane antigen[J].Prostate,1997,32(2):140 -148.
[13]Heston WD.Characterization and glutamyl preferring carboxypeptidase function of prostate specific membrane antigen:a novel folate hydrolase[J].Urology,1997,49(3A Suppl):104-112.
[14]O'Keefe DS,Bacich DJ,Heston WD.Comparative analysis of prostate-specific membrane antigen(PSMA)versus a prostate- specific membrane antigen - like gene[J].Prostate,2004,58(2):200 -210.
[15]Tiffany CW,Lapidus RG,Merion A,et al.Characterization of the enzymatic activity of PSM:comparison with brain NAALADase[J].Prostate,1999,39(1):28 -35.
[16]Pinto JT,Suffoleto BP,Berzin TM,et al.Prostate-specific membrane antigen:A novel folate hydrolase in human prostatic carcinoma cells[J].Clin Cancer Res,1996,2(9):1445-1451.
[17]Ghosh A,Heston WD.Tumor target prostate specific membrane antigen(PSMA)and its regulation in prostate cancer[J].J Cell Biochem,2004,91(3):528 -539.
[18]Shuba YM,Prevarskaya N,Lemonnier L,et al.Volume-regulated chloride conductance in the LNCaP human prostate cancer cell line[J].Am J Physiol Cell Physiol,2000,279(4):C1144 - C1154.
[19]Agell N,Bachs O,Rocamora N,et al.Modulation of the Ras/Raf/MEK/ERK pathway by Ca2+,and calmodulin[J].Cell Signal,2002,14(8):649 -654.
[20]Ghosh A,Wang X,Klein E,et al.Novel role of prostate-specific membrane antigen in suppressing prostate cancer invasiveness[J].Cancer Res,2005,65(3):727 - 731.
[21]Yao V,Bacich DJ.Prostate specific membrane antigen(PSMA)expression gives prostate cancer cells a growth advantage in a physiologically relevant folate environment in vitro[J].Prostate,2006,66(8):867 -875.
[22]Yao V,Parwani A,Maier C,et al.Moderate expression of prostate-specific membrane antigen,a tissue differentiation antigen and folate hydrolase,facilitates prostate carcinogenesis[J].Cancer Res,2008,68(21):9070 -9077.
[23]曹开源,张 甜,徐 霖,等.RNAi沉默PSMA基因对前列腺癌LNCaP细胞生物学行为的影响[J].中国病理生理杂志,2008,24(10):1877 -1881.
[24]Yao V,Berkman CE,Choi JK,et al.Expression of prostate-specific membrane antigen(PSMA),increases cell folate uptake and proliferation and suggests a novel role for PSMA in the uptake of the non-polyglutamated folate,folic acid[J].Prostate,2010,70(3):305 -316.

