转基因DT40细胞导入早期鸡胚后的分布及绿色荧光蛋白表达的研究
孙 鹏,赵 晨,燕 丽,靳文静,张文新,李赞东
(1.中国农业大学生物学院农业生物技术国家重点实验室,北京 100193;2.北京教育考试院,北京 100083)
随着重组DNA技术的迅猛发展,动物转基因技术的研究取得了一系列可喜的进展。这种基因转移技术为人类提供了从遗传上改变高等动物细胞的能力,并成为制备转基因动物和进行基因治疗的基础。把经基因改造的细胞移植到动物体内将可能为生产药用蛋白[1]或者进行基因治疗[2]提供一种更加经济的途径。但是,对于许多高等动物,特别是具有完善的免疫系统的脊椎动物,基因传递系统存在潜在的免疫刺激性,异源基因的表达容易引起宿主产生免疫应答,进而将降低异源基因表达产物的量甚至将其完全消除[1,3-5]。Mohammed等[1]将重组的人免疫球蛋白(rh IgG3)基因转入鸡法氏囊淋巴细胞系(DT40)后再将后者通过静脉注射到产蛋母鸡体内,在注射细胞6d后宿主鸡所产蛋中可通过ELISA检测到rh IgG3,该蛋白含量在注射12d后的蛋中达到最高峰,但在此之后骤然下降,这可能是宿主对 rh IgG3产生了免疫应答的结果。要解决这一问题,需要使宿主动物对异源蛋白形成免疫耐受。根据 Burnet提出的抗体产生克隆选择学说[6],有研究人员在鸡胚发育早期将异源蛋白注射到胚胎内,可以诱导出生后的鸡对此抗原的免疫耐受[7]。
禽类的胚胎发育模式与哺乳动物存在很大差异,前者的胚胎发育是在离开母体的密闭蛋壳内独立完成的,可以在不停止胚胎发育的情况下对其进行研究,这使得胚胎血管微注射外源物质的方法成为对禽类进行研究的一种重要手段[8-11]。本实验室曾在胚胎早期注射异种蛋白诱导鸡免疫耐受方面进行过一系列的研究[12],但在实验过程中发现,在胚胎发育过程中持续导入外源蛋白比较困难,一次性大剂量的接种外源蛋白可能会导致受体胚胎大量死亡。将携带异源基因的细胞导入早期发育的胚胎中,若导入细胞可以存活且目的基因能够正常持续表达,则可能解决这一问题。
本实验的目的是通过血管微注射法将表达异源蛋白的细胞导入早期鸡胚,研究供体细胞在鸡胚中的分布以及所携带的外源基因的表达情况,为胚胎期导入外源蛋白诱导免疫耐受的研究以及将转基因细胞移植到动物体内生产目的蛋白的研究提供科学依据和技术平台。
1 材料和方法
1.1 材料与设备
1.1.1 实验动物:本实验所用白莱航鸡(White Leghorn,Gallus domesticus)种蛋购自中国农业大学动物科技学院养鸡场。
1.1.2 细胞及载体:鸡法氏囊淋巴细胞系(DT40)由韩国首尔国立大学 Han Jae Yong教授赠送。pEGFP-N1载体由军事医学科学院范宝兴博士赠送。
1.1.3 主要试剂及材料:限制性内切酶Eco O109Ⅰ购自MBI公司;限制性内切酶Hin dⅢ购自NEB公司;DMEM/F-121∶1、双抗、胎牛血清(fetal bovine serum,FBS)、非必需氨基酸和丙酮酸钠均购自HyClone公司;G418购自Sigma公司;PCR预混液购自宝生物工程大连有限公司;胶回收试剂盒购自北京 Tiangen生物技术有限公司;Southern杂交膜(Amersham-XL尼龙膜)购自 GE公司;放射性同位素α-32p-dCTP购自中国同位素进出口公司;X光片购自Kodak公司;显影浓缩液及定影浓缩液购自乐凯公司;PCR引物的合成由上海英骏生物技术有限公司完成;一抗:小鼠抗绿色荧光蛋白(GFP)单克隆抗体购自MBL公司;生物素化羊抗小鼠IgG二抗试剂盒、联苯二胺(DAB)显色试剂盒及小鼠抗增殖细胞 核 抗 原 (proliferating cell nuclear antigen,PCNA)抗体购自武汉博士德生物技术有限公司。
1.1.4 主要设备:电击仪:Gene Pulser X CellTMElectroporation System(Bio-Rad USA);倒置荧光显微镜:IX71(Olympus Japan);纤维光源 (Nikon Japan);杂交炉(Bio-Rad USA);拉针仪:PN-40(Narishige Japan);切片机(Leica Germany)。
1.2 实验方法
1.2.1 DT40细胞的转染与筛选:将 DT40细胞悬浮培养于DMEM/F-12培养基(含10%胎牛血清,1%丙酮酸钠,1%非必需氨基酸,100U/m L青霉素,100μg/mL链霉素)中置于二氧化碳培养箱中培养(37.5℃,5%CO2)。收集对数期生长的DT40细胞约5×106个与60μg线性化pEGFP-N1载体于无血清的DMEM/F-12基础培养基中混匀后电击转染(550V,50μF)。电击后的DT40细胞用DMEM/F-12培养基培养 24h后添加 G418(终浓度为 1.5mg/m L)继续培养7 d,在此期间,每2d更换一次含G418的培养基。之后换为含终浓度为0.4mg/m L的G418培养基继续培养14d,在此期间,每2d更换一次含G418的培养基。收集细胞,将细胞按5~10个/孔的细胞密度接种于96孔细胞培养板,在终浓度为0.4mg/m L的G418培养基中继续培养,每日观察,21d后挑出由单个细胞形成的克隆,扩大培养,荧光显微镜镜检。选取将作为供体细胞的细胞株命名为DT40-GFP。
1.2.2 GFP基因的Southern blot检测:以 pEGFPN1载体序列(GenBank Accession No.U55762)设计探针引物,上游5'-GGACGGCGACGTAAACGGCCACAA-3',下游 5'-ACGAACTCCAGCAGGACCATG-3',目的片段为GFP基因内长度为618bp的一段序列。提取DT40-GFP细胞的基因组 DNA,取30μg基因组DNA用Hin dⅢ,37℃过夜消化。将消化后的基因组DNA通过0.7%的琼脂糖凝胶电泳分离,然后转移到尼龙杂交膜上。通过随机引物法将618bp的DNA探针用32P标记后,进行杂交,放射自显影。
1.2.3 鸡胚血管微注射 DT40-GFP细胞及荧光显微镜检测:种蛋表面以新洁尔灭溶液擦洗干净后置于孵化器中在38.5℃,相对湿度70%的条件下孵化,2h翻蛋一次,翻蛋角度为90°。将孵化65~70h(胚胎发育至17~18期[13])的种蛋取出,用酒精棉擦拭表面消毒后,通过纤维光源照蛋确定胚胎所处位置并做标记。在记号附近的蛋壳上用医用牙钻开一个直径约4mm的小窗。在实体显微镜下用外径为50~70μm的玻璃针将2μL含有约6×104个DT40-GFP细胞的PBS(pH 7.6)缓慢注射到鸡胚的前卵黄静脉中,注射后用 parafilm封闭开口,标记,共注射117个鸡胚。将处理后的胚胎放回孵化器继续孵化,在孵化后4~19 d,每天取4~5个活胚,用镊子将胚胎不同组织分开,置于玻璃平皿中,荧光显微镜下镜检,观察荧光细胞在胚胎中的分布情况。取4只新生小鸡,颈椎脱臼处死并解剖,取脑、心脏、卵黄囊膜、法氏囊等组织、器官,荧光显微镜下镜检,观察荧光细胞在小鸡各组织器官中的分布情况。
1.2.4 PCR检测:在荧光显微镜下收集含有荧光细胞的胚胎组织样品并提取基因组 DNA,方法同Taberlet and Bouvet的报道[14]。以 pEGFP-N1载体序列(GenBank Accession No.U55762)设计PCR引物:上游5'-TTCAAGGACGACGGCAACT-3',下游5'-TGGGTGCTCAGGTAGTGGTT-3'扩增GFP基因内部的一段314bp大小的DNA片段。PCR扩增条件为94℃ 5m in,94℃ 30s,54℃ 45s,72℃ 30s,35个循环,72℃延伸10m in结束,1.5%琼脂糖分析。
1.2.5 免疫组织化学检测 GFP的表达:分别取孵化5d和10d的注射了 DT40-GFP细胞的鸡胚组织,于10%中性缓冲福尔马林溶液中固定,常规脱水,石蜡包埋。取组织蜡块连续切片,厚度6μm,60℃烤片15m in,常规脱蜡至水,其余步骤严格按照生物素化羊抗小鼠IgG二抗试剂盒及DAB显色试剂盒说明书操作。一抗工作浓度为1:250,DAB显色后,切片于显微镜下检测。
2 结果
2.1 稳定整合 GFP基因的DT40细胞株(DT40-GFP)的获得与鉴定:电击转染后经G418筛选得到了多个DT40细胞株。经荧光显微镜检测,在其中选择GFP表达效果好,分裂周期较短的一株 DT40细胞(彩插3图1A、B)作为鸡胚血管微注射实验的供体细胞,命名为DT40-GFP。Southern blot结果表明(彩插3图1C),GFP基因整合到了 DT40-GFP细胞基因组中,且拷贝数为1。
2.2 DT40-GFP细胞在鸡胚中的分布及存活情况:在孵化4d(即注射后1d)至孵化19 d(出雏前)的胚胎中均可以检测到荧光细胞。DT40-GFP细胞在胚胎中分布比较广泛,在心脏(彩插4图2H)、肝脏(彩插4图2J)、脾脏(彩插4图2K)、肾脏(彩插4图2I)及肠(彩插4图2F)等内脏器官上数量较少,胚胎头部的荧光细胞数量较多,主要集中在脑部(彩插4图2A、B、C、L),在卵黄囊膜(彩插4图2G)和尿囊膜(彩插4图2D)上也相对较多。DT40-GFP细胞被导入胚胎后,细胞形状发生了较大变化(彩插4图2C、G)
2.3 DT40-GFP细胞在孵出小鸡体内的分布及存活情况:将四只注射DT40-GFP细胞的新生小鸡解剖后,在荧光显微镜下仔细观察小鸡的脑、心脏、卵黄囊膜、法氏囊及各内脏器官,均未检测到荧光细胞。
2.4 DT40-GFP细胞在鸡胚内的荧光检测统计:本实验共检测了67只注射了DT40-GFP细胞的鸡胚,在58只鸡胚中检测到了荧光细胞,占所检测样本的86.6%;共检测4只胚胎期导入 DT40-GFP细胞后孵出的小鸡,没有检测到荧光细胞,具体数据总结于表1。
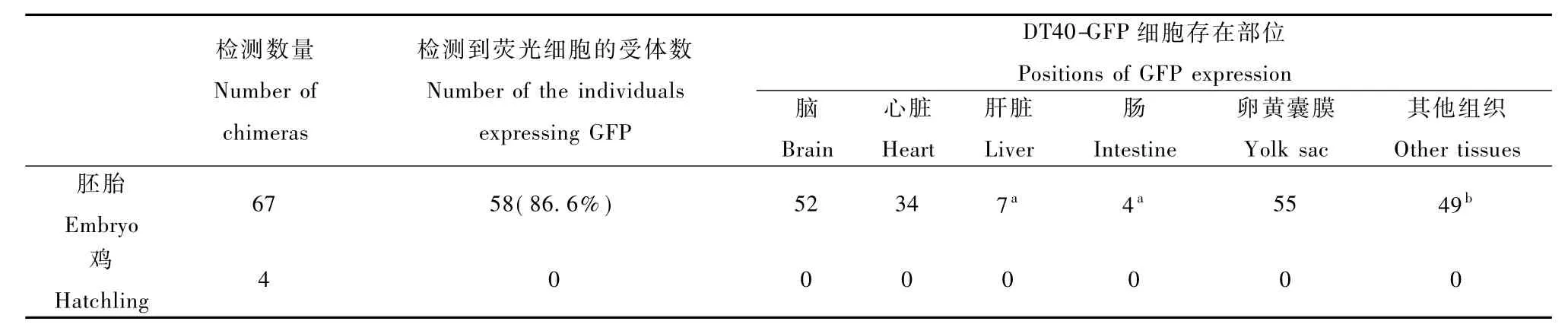
表1 DT40-GFP细胞在受体中的荧光检测结果Tab.1 Detection of DT40-GFP cells in recipients under fluorescence microscopy
2.5 体细胞转基因嵌合体鸡胚中 GFP基因的检测:取孵化5d的嵌合体鸡胚头部和身体部分分别提取基因组DNA,取孵化10d、15d嵌合体胚胎的脑和心脏分别提取基因组DNA,共得到基因组样品28份,通过PCR反应,全部能扩增出相应的DNA片段,而未注射的野生型胚胎基因组中没有扩增出相应DNA片段,部分样本的PCR扩增电泳结果见图3。
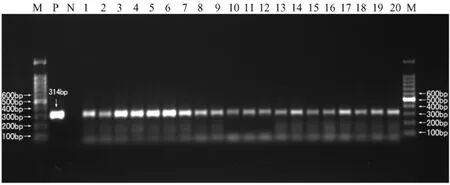
图3 PCR扩增注射DT40-GFP细胞受体组织基因组DNAFig.3 The PCR amplification of chimeric tissue genome DNA注:M.DNA marker;P.pEGFP-N1质粒(阳性对照);N.未注射鸡胚基因组样本(阴性对照);1~4.孵化5d嵌合体胚胎头部基因组样本;5~8.孵化5d嵌合体胚胎身体基因组样本;9~11.孵化10d嵌合体胚胎脑部基因组样本;12~14.孵化10d嵌合体胚胎心脏基因组样本;15~17.孵化15d嵌合体胚胎脑部基因组样本;18~20.孵化15d嵌合体胚胎心脏基因组样本Note:Lane M:DNA size markers;Lanes 1-4:The head of four 5-day somatic chimeric chicken respectively.Lanes 5~8:The body of four 5-day somatic chimeric chicken respectively.Lanes 9~11:The head of three 10-day somatic chimeric chicken embryo respectively.Lanes 12~14:The body of three 10-day somatic chimeric chicken embryo respectively.Lanes 15~17:The head of three 15-day somatic chimeric chicken embryo respectively.Lanes 9~11:The body of three 15-day somatic chimeric chicken embryo respectively.Genomic DNA of a nonmanipulated chicken embryo and plasm idDNA(pEGFP-N1)were used as negative(lane N)and positive(lane P)control,respectively
2.6 体细胞转基因嵌合体鸡胚中GFP的检测
通过免疫组化法,在鸡胚的头部、心脏、身体等部位检测到了GFP阳性细胞,而在阴性对照组中没有检测到阳性信号,证明在荧光显微镜下观察到的注射了DT40-GFP细胞的鸡胚中的荧光细胞的确表达了GFP,部分样本的免疫组化结果彩插3见图4。
3 讨论
3.1 胚胎血管微注射时期的选择
禽类胚胎的发育与哺乳动物差别很大,禽受精卵产出体外时胚胎通常已发育至第Ⅹ期,即胚盘期,相当于哺乳动物的囊胚期。有一些研究[15-16]采用了将其他来源的供体细胞注入胚盘下腔的方法制备嵌合体禽类,也有使用这种方法制备转基因嵌合体禽类[18-19]的报道。但经这种注射方法处理过的种蛋孵化率一般在20%~40%之间,得到后代的比例较低。本实验室尝试过在鸡胚处于胚盘期时注射供体细胞的方法,由于胚盘下腔的空间小,只能容纳少量的供体细胞,操作时针尖穿过胚盘下腔导致供体细胞流失的概率很大,并且发现在胚胎发育过程中大量供体细胞分散在胚外组织膜上,只有少量的供体细胞在胚体内部,不能满足本实验的要求。
在胚胎形成血管之后,此时,可以将外源细胞以血管微注射的方法导入胚胎中形成嵌合体[8-11,19-21]。在这一时期,可以将供体细胞直接导入到胚胎的循环系统中,使进入到胚体内的供体细胞的比例明显增加。但若在胚胎免疫系统开始建立之后再将表达外源蛋白的供体细胞导入,供体细胞就可能会被胚胎免疫排斥。本实验室前期在鸡胚胎期诱导免疫耐受的研究中发现:在胚胎发育65~70h阶段接种抗原后孵化的小鸡中表现出对这种蛋白抗原的耐受[22]。所以本实验选择了鸡胚孵化65~70h时通过血管微注射的方法导入供体细胞,以增加供体细胞在受体中存活的比例。
3.2 受体的阳性率
本实验采用血管微注射法将供体细胞直接导入胚胎,提高了含有GFP细胞的胚胎比例。在本实验中,含表达 GFP的DT40细胞的胚胎比例为86.6%(58/67),远高于2001年 Toba等[17]通过胚盘注射法将经基因修饰的DT40细胞导入鸡胚的实验以及2004年 Xi等[23]将转基因融合细胞注入胚盘的实验得到的嵌合胚胎阳性率,但低于我们之前以鸡胚成纤维细胞(CEFs)作为供体细胞得到的实验结果[24]。这可能是因为DT40细胞是经过改造且经长期体外培养的细胞系,已经不适于在胚胎体内长期生长所致。实验中可以持续观察到绿色荧光细胞,表明GFP基因均可以在导入受体后的DT40细胞中正常表达。
3.3 供体细胞在受体中的分布
供体细胞被导入鸡胚循环系统后,可随血液循环到达胚胎的各个部位,在胚体中分布广泛,尤其在循环系统末端的毛细血管附近分布最多。由表1,荧光细胞最多出现在胚胎的脑和卵黄囊膜中,分别在52个胚胎脑中和55个胚胎的卵黄囊膜中存在荧光细胞,其次是心脏,在34个胚胎的心脏中检测到荧光细胞。由于孵化5d的胚胎脑泡中水分比例非常大,经石蜡切片后脑泡部分呈空泡状,通过免疫组化无法检测到阳性细胞,但在脑泡附近的头部组织中可以检测到GFP阳性细胞。免疫组化结果与荧光检测结果及PCR结果一致。
3.4 荧光细胞在受体体内存活的时间
荧光显微镜观察结果表明,鸡胚发育早期导入的DT40-GFP不但可以在鸡胚内存活,而且其存活时间较长,可以持续到鸡胚发育末期。但DT40-GFP细胞数量并未随胚胎发育而增加,而是呈现出逐渐减少的趋势。以本实验的观察结果与我们之前导入携带GFP基因的鸡胚成纤维细胞(CEF-GFP)的实验结果[24]相比较,两实验导入胚胎的细胞数量均为6×104个/胚。在注射后第1d,即胚胎孵化第4d,两实验的胚胎中荧光细胞的数量基本相同。总体上看,在胚胎孵化至第9 d时,注射DT40-GFP细胞的胚胎中的荧光细胞数量少于注射CEF-GFP细胞的胚胎中的荧光细胞数。胚胎孵化至15d时,注射DT40-GFP细胞的胚胎中的荧光细胞数量远少于注射CEF-GFP细胞的胚胎中的荧光细胞数。
3.5 结论
本实验将稳定整合了一个拷贝绿色荧光蛋白基因的DT40细胞在鸡胚发育65~70h时通过血管微注射法导入鸡胚中,整合了外源基因的DT40细胞可以在胚胎中存活直至胚胎出雏之前,且外源基因能够持续表达。这一结果表明,可以通过此方法将外源基因导入到受体中,并使目的蛋白在受体胚胎中持续表达,可以为深入研究免疫耐受的机制提供一定的技术支持。
[1]Mohammed SM,Morrison S,W ims L,et al.Deposition of genetically engineered human antibodies into the egg yolk of hens[J].Immunotechnology,1998,4(2):115-125.
[2]Murray M,Kim D,Liu Y,et al.Transplantation of genetically modified cells contributes to repair and recovery from spinal injury[J].Brain Research Reviews,2002,40(1-3):292-300.
[3]Domenico CD,Villani GRD,Napoli DD,et al.Gene therapy for a mucopolysaccharidosis type I murine model with lentiviral-IDUA vector[J].Human Gene Therapy,2005,16(1):81-90.
[4]Schagen FHE,Ossevoort M, Toes REM, et al. Immune responses against adenoviral vectors and their transgene products: a review of strategies for evasion[J].Critical Reviews in Oncology and Hematology,2004,50(1):51-70.
[5]Jooss K,Yang Y,Fisher KJ,et al.Transduction of dendritic cells by DNA viral vectors directs the immune response to transgene products in muscle fibers[J].Journal of Virology,1998,72(5):4212-4223.
[6]Burnet FM.The clonal selection theory of acquired immunity[M].London:Cambridge University Press,1959.
[7]Stevens KM, Pietryk HC and Ciminera JK. Acquired immunological tolerance to protein antigen in chickens[J].British Journal of Experimental Pathology,1958,39(1):1-7.
[8]Naito M,Tajima A,Yasuda Y,et al.Production of germ line chimeric chickens,with high transmission rate of donor-derived gametes,produced by transfer of primordial germ cells[J].Molecular Reproduction and Development,1994,39(2):153-161.
[9]Li HC,Zhao L,Kagami H,et al.Identification of transferred chicken germ cells in quail gonad and semen by amplification of chicken-specific PCR products[J].The Journal of Poultry Science,2001,38(4):308-316.
[10]Naito M,Minematsu T,Harumi T,et al.Preferential m igration of transferred primordial germ cells to left germinal ridge of recipient embryos in chickens[J].The Journal of Poultry Science,2009,46(1):40-45.
[11]Naito M,Minematsu T,Harumi T,et al.Intense expression of GFP gene in gonads of chicken embryos by transfecting circulating primordial germ cells in vitro and in vivo[J].The Journal of Poultry Science,2007,44(4):416-425.
[12]Zhao C,Song C,Wang X,et al.Induction of immunological tolerance in chickens inoculated with xenogeneic antigens at an early stage of embryonic development[J].Developmental and Comparative Immunology,2006,30(4):431-440.
[13]Hamburger V and Hamilton HL.A series of normal stages in the development of the chick embryo[J].Journal of Morphology,1951,88(1):49-92.
[14]Taberlet P and Bouvet J.A single plucked feather as a source of DNA for bird genetic studies[J].The Auk,1991,108(4):959-960.
[15]Naito M,Watanabe M,Kinutani M,et al.Production of quailchick chimaeras by blastoderm cell transfer[J].British poultry science,1991,32(1):79-86.
[16]Petitte JN.Production of somatic and germ line chimeras in the chicken by transfer of early blastodermal cells [J].Development,1990,108(1):185-189.
[17]Toba M,Ebara F,Furuta H,et al.Introduction of DT40cells into chick embryos[J].Asian Journal of Andrology,2001,3(1):49-53.
[18]Zhu L,van de Lavoir MC,A lbanese J,et al.Production of human monoclonal antibody in eggs of chimeric chickens[J].Nature Biotechnology,2005,23(9):1159-1169.
[19]Naito M,Cryopreservation of avian germ line cells and subsequent production of viable offspring[J].The Journal of Poultry Science,2003,40(1):1-12.
[20]Tajima A,Barbato GF,Kuwana T,et al.Conservation of a genetically selected broiler line(42L) using cryopreserved circulating primordial germ cells(PGCs)isolated by filtration method[J].The Journal of Poultry Science,2003,40(1):53-61.
[21]Minematsu T,Tajima A,and Kanai Y.The migratory ability of gonadal germ cells in the domestic chicken[J].The Journal of Poultry Science,2004,41(3):178-185.
[22]Zhao C,Li Z,Song C,et al.Induction of immune-tolerance in chickens by injecting exogenous antigen into embryonic blood vessel during embryogenesis[C].Proceeding ofⅩⅫ World's Poultry Congress,2004,178.
[23]Xi Y,Nada Y,Soh T,et al.Green fluorescent protein genetransfected peafowl somatic cells participate in the development of chicken embryos[J].Journal of Experimental Zoology Part A,2004,301(2):139-149.
[24]Sun P,Zhao C,Yan L,et al.Expression of green fluorescent protein gene in somatic chimeric chickens produced by transplantation of transfected chicken embryonic fibroblasts[J].The Journal of Poultry Science,2009,46(4):363-369.

