芽孢杆菌在豆粕固态发酵中的应用研究
陈洁梅 熊 娟 常 磊 刘永萍 徐聪聪 余益耀
芽孢杆菌在豆粕固态发酵中的应用研究
陈洁梅 熊 娟 常 磊 刘永萍 徐聪聪 余益耀
研究利用芽孢杆菌对豆粕进行固态发酵试验,通过监测发酵前后的酸溶性蛋白(TCA-N)含量的变化来评价发酵的效果。菌株组合JM1+JM3正交实验后得到的最佳发酵工艺条件为:料水比为1:0.6,初始发酵温度为34℃,接种量为10%,菌种比(JM1:JM3)为1:1,灭菌时间为20 min,发酵时间为48 h。发酵后样品中粗蛋白含量从50.6%增加到54.1%,TCA-N含量从2.4%增加到38.8%,大豆肽含量从1.8%提高到29.5%,乳酸含量从0.7%增加到4.7%,游离氨基酸含量从5.57 mg/g增加到92.65 mg/g。SDS-PAGE电泳分析的结果表明,发酵后大豆抗原已经完全被分解,大分子蛋白质基本上都被降解成10 kD以下的小分子肽,各种主要抗营养因子的降解率达90%以上。
芽孢杆菌;固态发酵;豆粕;酸溶性蛋白;抗营养因子
豆粕(SBM)蛋白含量高,必需氨基酸丰富,是动物日粮中常用的植物蛋白质原料,具有适口性好、代谢能高的特点[1]。然而豆粕中不可避免地存在着多种抗营养因子,如胰蛋白酶抑制剂、植物凝集素和大豆抗原蛋白、植酸、脲酶等,这些抗营养因子不仅降低了饲料的营养价值和利用率,而且降低了畜禽生产性能,影响了豆粕在动物饲料特别是幼畜饲料中的应用[2]。
豆粕发酵是指利用微生物的发酵作用,将豆粕中的大分子蛋白质分解,生成大量动物容易吸收利用的小分子蛋白、小肽和游离氨基酸,同时去除原料豆粕中的抗营养因子,并积累其它一些有益代谢产物[3-4],从而获得一种具有多种功能的、低价位的、来源安全的优质改良蛋白质饲料。该方法现已成为国内外的研究热点[5-6]。本研究的主要目标是通过微生物对原料豆粕的发酵,降低蛋白质的分子量,提高动物对豆粕蛋白质的利用率,代替部分鱼粉,减少养殖业对动物性蛋白质原料的依赖,降低养殖业的生产成本,提高饲料的安全性。
芽孢杆菌具有较强的蛋白酶活性,是豆粕发酵中应用最广的一类微生物菌株[7]。本研究利用若干芽孢杆菌菌株对原料豆粕进行发酵实验,优化发酵条件,通过对发酵前后的多项指标的测定和对比,科学评价发酵豆粕的营养价值,为发酵豆粕的应用提供依据。
1 材料与方法
1.1 原料与培养基
豆粕:由肇庆市益信农业发展有限公司提供;
营养琼脂斜面培养基:牛肉膏3 g/l、蛋白胨10 g/l、NaCl 5 g/l、琼脂粉 20 g/l,pH 值 7.4±0.2;
液体种子培养基:牛肉膏3 g/l、蛋白胨10 g/l、NaCl 5 g/l,pH 值 7.3±0.2;
固态发酵培养基:豆粕装瓶量50 g/500 ml,料水比 1:0.5,121 ℃灭菌 20 min。
1.2 菌种
4株高产蛋白酶的芽孢杆菌,编号分别为JM1、JM2、JM3、JM4(均为本课题组分离筛选并保藏的菌株)。
1.3 豆粕固态发酵
分别从经活化的斜面刮取2环菌苔到液体种子培养基,于180 r/min,33℃摇床培养24 h后,以10%接种量接种于发酵培养基中。振摇混匀后于33℃恒温箱中静置培养48 h,发酵过程中每10 h振摇发酵培养基一次,使豆粕和菌体充分混匀。发酵结束后测定发酵豆粕的酸溶性蛋白(TCA-N)含量。
1.4 酸溶性蛋白溶液的提取及测定
按NY/T 1205—2006提取豆粕水溶性蛋白。取10 ml水溶性蛋白提取液加入10 ml 15%TCA溶液,振荡摇匀后静置10 min后,4 000 r/min离心10 min,上清液即为酸溶性蛋白提取液。酸溶性蛋白含量用半微量凯氏定氮法测定,用TCA-N来表示。
1.5 不同菌株发酵能力的比较
为比较不同菌株的发酵能力,分别将保存的4株芽孢杆菌菌株两两组合发酵得到6个组合:JM1-JM2、JM1-JM3、JM1-JM4、JM2-JM3、JM2-JM4、JM3-JM4,加上 4 个单菌发酵:JM1、JM2、JM3、JM4 共 10 个处理(处理组编号分别为:1.JM1;2.JM2;3.JM3;4.JM4;5.JM1+JM2;6.JM1+JM3;7.JM1+JM4;8.JM2+JM3;9.JM2+JM4;10.JM3+JM4)。发酵效果以TCA-N含量为指标,从中筛选出最佳的发酵单菌株或菌株组合。
1.6 豆粕发酵条件优化(见表1)
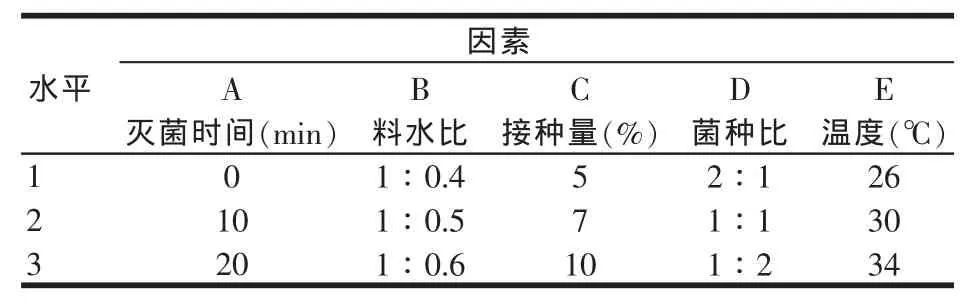
表1 正交实验设计
以TCA-N含量为指标,通过正交实验优化发酵条件。发酵实验选择了L18(35)正交设计,研究不同的灭菌时间、料水比、接种量、菌种比、初始发酵温度等5个因素对豆粕发酵的影响。
1.7 发酵豆粕SDS-PAGE凝胶电泳分析
称取烘干过60目筛的发酵前和发酵后豆粕各1.000 0 g,加入0.03 mol/l Tris-HCl(pH值为8.8)缓冲溶液20 ml,于室温下150 r/min摇床浸提0.5 h,调节pH值至8.2以上,继续摇床1 h后,10 000 r/min离心5 min,取上清液稀释适当倍数后进行SDSPAGE电泳,根据电泳图谱分析大分子蛋白及大豆抗原蛋白的降解情况[8]。
1.8 乳酸含量
首先对0.1 mol/l的NaOH溶液进行标定。取发酵前后的豆粕各10.0 g,加蒸馏水90 ml,置摇床120 r/min摇床30 min,离心,取10 ml上清,如上清颜色较深,加入一定倍数的无CO2蒸馏水进行稀释。滴2滴1%酚酞指示剂,用标准NaOH溶液进行滴定,滴定至淡粉红色,到终点记录消耗标准NaOH的体积,重复3次,取平均值。计算公式:
式中:N(NaOH)——标定后标准NaOH的浓度(mol/l);
V(NaOH)——滴定时消耗标准NaOH液的体积(ml)。
1.9 其他主要测定方法
粗蛋白含量参照GB/T 5009.5—2003测定;脲酶活性参照GB/T 8622—2006测定;凝集素效价参照大豆凝集素的测定法[9];植酸含量参照GB/T 5009.153—2003测定;脂肪氧化酶含量参照张小侠等[10]的方法测定。
1.10 游离氨基酸含量分析
测定发酵前后酸溶性蛋白提取液中游离氨基酸的含量的变化,提取液用三蒸水进行洗涤和适当倍数的浓缩,最后用pH值为2.2缓冲液定容,于氨基酸自动分析仪测定。检测条件:色谱柱为日立855-350型;反应柱温为134℃,分析时间为110 min;标准氨基酸浓度为100 μmol/l;进样量为20 μl。分析方法参照JY/T 0194—1996 和 GB/T 5009.124—2003。
2 结果与分析
2.1 不同菌株发酵能力的比较
发酵能力以(TCA-N)%表示,结果见图1。从图1可以看出,10个单菌及菌株组合发酵中,TCA-N含量最高的为编号6的组合,因此选择菌株组合JM1+JM3作为发酵菌株。

图1 各菌种处理的TCA-N含量的比较
2.2 优化发酵条件
以JM1+JM3为发酵菌株,通过正交试验L18(35),优化豆粕的最佳发酵条件,结果见表2。由于灭菌10 min(A2)和20 min(A3)在其他条件相同的情况下结果非常接近,考虑这是实验误差所致,经多次验证,表明灭菌20 min的结果明显优于灭菌10 min的结果,因此发酵最佳工艺条件组合选为A3B3C3D2E3,即灭菌时间为20 min、料水比为1:0.6、接种量为10%、菌种比为1:1、初始发酵温度为34℃。由表3方差分析可以看出料水比、初始发酵温度对TCA-N含量的影响极其显著,灭菌时间的影响显著,而接种量和菌种比对结果影响并不大,5个因素对发酵豆粕TCA-N含量的影响力大小依次为:料水比>初始发酵温度>灭菌时间>接种量>菌种比。
2.3 发酵时间的选择

表2 正交实验结果
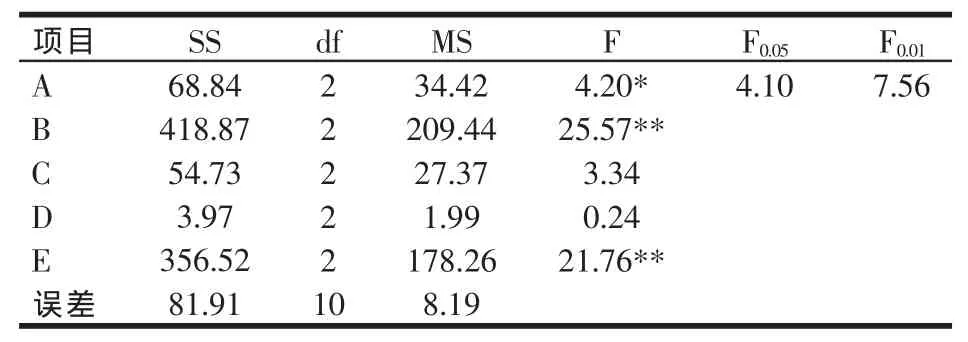
表3 方差分析
利用JM1+JM3菌株混合接种于固体发酵培养基在最优发酵条件下发酵,每隔8 h取样一次,测TCAN含量,得到发酵时间曲线如图2所示。为了缩短生产周期及避免物料损失过多,选择48 h作为最佳发酵时间。

图2 最优条件下发酵过程中TCA-N含量的变化
从图2中可以看出,在48 h时TCA-N含量达到38.8%。
2.4 SDS-PAGE电泳

图3 发酵前后豆粕SDS-PAGE电泳图谱
通过SDS-PAGE电泳分析,比较发酵前后豆粕中蛋白质分子量的变化及大豆抗原蛋白的降解情况。结果见图3,由图3可见,原豆粕中的主要大豆抗原蛋白质亚基明显,条带清晰,而发酵后样品大豆抗原已经完全降解,其他大分子蛋白也基本上降解为10 kD以下的小分子量蛋白或多肽。
2.5 游离氨基酸含量分析(见表4、图4)
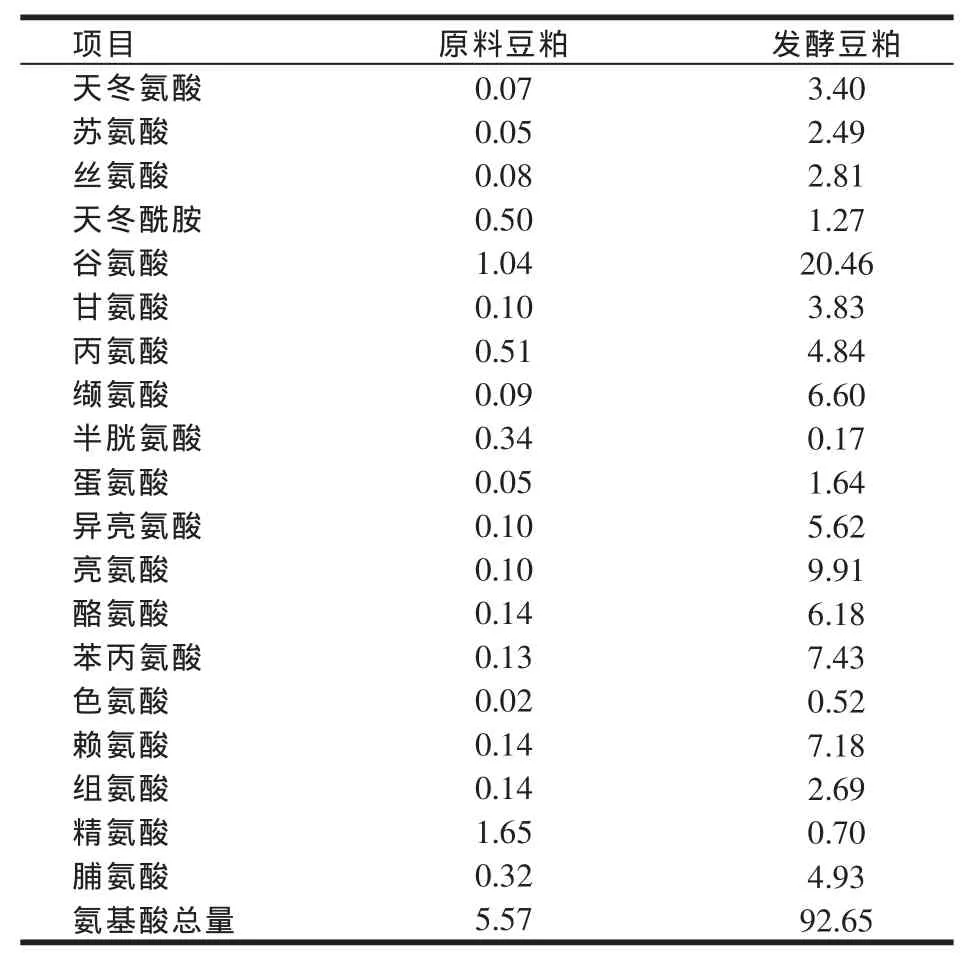
表4 发酵前后豆粕中各游离氨基酸含量的变化(mg/g)
游离氨基酸测定含量和图谱见表4和图4。由表4可知,游离氨基酸总含量由发酵前的5.57 mg/g提高到发酵后的92.65 mg/g。除半胱氨酸和精氨酸外其他各种氨基酸含量均有显著提高。
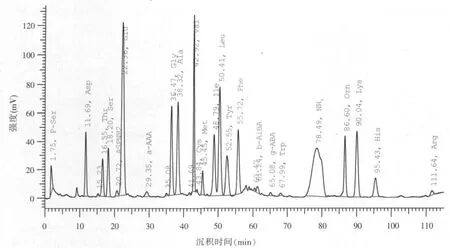
图4 发酵后豆粕游离氨基酸含量图谱(A570nm)
2.6 发酵前后抗营养因子含量
发酵前后豆粕中抗营养因子含量变化如表5所示。结果表明,发酵后豆粕中的抗营养因子大部分被降解,其中脲酶降解了90.0%、植酸降解了41.0%、脂肪氧化酶完全被降解、凝集素降解了93.8%。由于在豆粕中脲酶的失活与胰蛋白酶抑制剂降解密切相关,故本研究把脲酶作为检测豆粕中胰蛋白酶抑制剂的间接衡量指标。
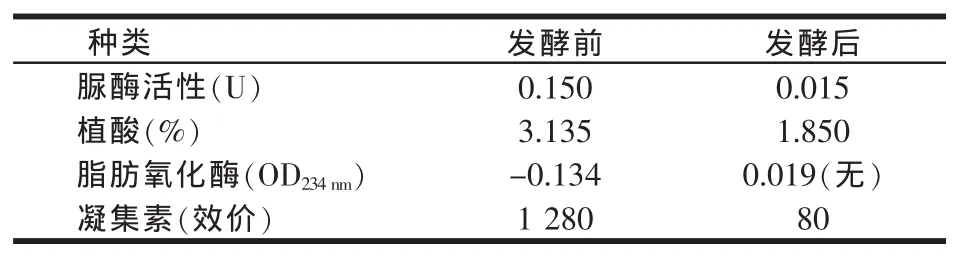
表5 发酵前后抗营养因子含量
2.7 发酵前后营养成分分析
在最佳发酵条件下,利用JM1+JM3菌株组合发酵豆粕后,测定发酵前后的各营养成分含量变化,结果见表6。由表6可知样品粗蛋白含量由发酵前的50.6%增加到54.1%,TCA-N含量由 2.4%增加到38.8%,游离氨基酸含量由5.57 mg/g提高到92.65 mg/g,大豆肽含量由1.8%提高到29.5%,乳酸含量由0.7%增加到4.7%。

表6 豆粕发酵前后成分比较
3 结论
本研究通过对比4株高产蛋白酶芽孢杆菌的单菌发酵和混合菌株发酵,结果表明JM1+JM3组合的发酵效果最佳。通过正交实验优化得到发酵豆粕的条件,发酵后样品中粗蛋白含量从50.6%增加到54.1%,TCA-N含量从2.4%增加到38.8%,大豆肽含量从1.8%提高到29.5%,乳酸含量从0.7%增加到4.7%,游离氨基酸含量从5.57 mg/g增加到92.65 mg/g。SDSPAGE电泳分析的结果表明,发酵后大豆抗原已经被完全分解,大分子蛋白质基本上都被降解成了10 kD以下的小分子蛋白,各种主要抗营养因子的降解率达90%以上。本研究中豆粕发酵后各项指标均达到发酵豆粕行业评判标准[11]。
上述研究表明,芽孢杆菌固态发酵豆粕可以显著的提高饲料蛋白的营养水平,经过微生物发酵的豆粕制品对畜禽健康十分有益[12-13],饲料中添加大豆肽降低了豆粕中抗营养因子对仔猪肠道绒毛结构的破坏作用并且大大提高了饲料蛋白消化吸收率,从而促进了幼龄畜禽的健康生长[14-15]。相信这些优势会使得发酵豆粕成为具有更广阔生产价值和开发前景的优质蛋白源,在将来规模化养殖业中发挥重要作用。
[1] 刘唤明,邓楚津.发酵法生产大豆肽的研究[J].饲料工业,2006,27(19):4-5.
[2] 肖玲,龚月生.热处理对豆粕品质的影响[J].粮食与饲料工业,2000(4):23-25.
[3] 刘超.可利用氨基酸饲料新技术[M].北京:中国农业出版社,2004:159.
[4] H.J.Lee.Health functional peptides from soybean foods[J].Korea Soybean Digest,1998,15:16-22.
[5] Ferrini G,Borda E,Martinez-Puig D,et al.Soy oligopeptides in the weaning pig nutrition[J].Feed international,2005,26(3):14-18.
[6] 杨旭,蔡国林,曹钰,等.固态发酵提高豆粕蛋白含量的条件优化研究[J].中国酿造,2008,05:17-20.
[7] J.L.Kiers,A.E.A.Van laeken,et al.In vitro digestibility of Bacillus fermented soya bean[J].International Journal of Food Microbiology,2000,60:163-169.
[8] Jacoba M S,Catriona M M,Haimen H J,et al.The Effect of pH on Heat Denaturation and Gel Forming Properties of Soy Protein[J].Journal Biotechnology,2000,79(5):223-230.
[9] 徐晓峰,朱才.大豆凝血素的测定[J].生物技术,1996,6(5):44-46.
[10] 张小侠,孙骊,王淑丽,等.大豆脂肪氧化酶抑制方法研究[J].武汉食品工业学院学报,1997,4:5-8.
[11] 葛向阳.发酵豆粕评判标准、测定程序和鉴别方法[J].蛋白源饲料新研究,2010,02:16-17.
[12] 何玉华,严昌国.豆粕中抗营养因子及其钝化方法[J].吉林农业科技学院学报,2009,18(1):20-22.
[13] 蔡国林,杨旭,曹钰,等.微生物发酵对豆粕营养价值的影响[J].中国油脂,2008,33(10):21-23.
[14] 方俊,李伟民.小肽在猪营养中的研究及应用[J].中国饲料,2003(22):20-21.
[15] 李绍章,梁运祥,葛向阳.大豆蛋白发酵降解多肽在养殖中的应用[J].饲料广角,2004(7):36-39.
S816.6
A
1001-991X(2011)09-0015-04
陈洁梅,暨南大学生命科学技术学院生物工程学系,副教授,510632,广东省广州市天河区黄埔大道西601号。
熊娟、常磊、刘永萍、徐聪聪,单位及通讯地址同第一作者。
余益耀,肇庆市益信农业发展有限公司。
2011-02-28
广东省部产学研结合项目[2010B090400379]
(编辑:刘 占,laramie_liu@yahoo.com)

