胰腺实性假乳头状瘤的CT诊断
福建中医药大学附属第二人民医院影像科(福建 福州 350000)
林增如 董 铿 郑春红
胰腺实性假乳头状瘤(Solid-psedopapillary Tumor of pancreas,SPTP)是少见的良性或低度恶性肿瘤,组织来源不清,约占胰腺所有肿瘤的0.13-2.7%[1]。目前,国内文献对其影像表现报道不多,本文回顾性分析10例实性假乳头状瘤的CT表现及特征,旨在提高对胰腺实性假乳头状瘤的诊断准确率。
资料和方法
1.1 一般资料 回顾性分析我院2008年7月至2010年9月经手术病理证实的胰腺SPTP 10例,其中女性9例,男性1例,年龄15-33岁,平均年龄28岁。其中8例因体检发现“胰腺占位”,2例因中上腹部闷痛就诊。患者均无胰腺炎病史,也无长期饮酒、吸烟史。术前检查血清癌胚抗原(CEA)和肿瘤相关抗原(CA199,CA125)等肿瘤标记物均为阴性。
1.2 扫描方法 采用日本东芝公司64排CT机。扫描条件:电压:120kVp,电流150mAs,层厚5mm,所有病例均行平扫和增强扫描。动脉期延迟时间25s,平衡期120s,经肘静脉利用高压注射器注入浓度为300mg/ml碘海醇80ml,流率3.5ml/s。
结 果
2.1 肿瘤的部位、大小和形态 肿瘤均为单发,发生于胰头部8例,胰尾部2例。肿瘤最大径约1.8-8cm,平均5.1cm。9例呈类圆形或椭圆形,1例呈分叶状改变;8例可见完整包膜,2例未见明显包膜,边界欠清,病理结果示肿瘤为低度恶性,瘤细胞未见浸润周围胰腺组织。
2.2 肿瘤的CT表现 10例肿瘤均行CT平扫和增强扫描,可分为实性和囊性结构两部分。以囊性结构为主的肿瘤1例,表现为病灶大部分为囊变区,实性部分呈附壁结节。实性结构和囊性结构相仿者9例,表现为病灶内的囊性成分或实性成分大致相当,囊性成分呈片状与实性成分相间分布。囊变区以包膜下和边缘分布为主。平扫时,囊性结构表现为低密度灶,其密度高于水,但明显低于肌肉组织,增强后囊性结构不强化。平扫时,实性结构表现为等或稍低密度灶,增强后实性结构强化,但强化程度低于正常胰腺组织。实性结构动脉期CT值约40-50HU,平衡期CT值约58-68HU。
2.3 肿瘤的其他表现 所有病例胰腺均无明显萎缩。2例肿瘤边缘和中央可见条状和结节状钙化,8例无胆管及胰管扩张,2例胰管轻度扩张。
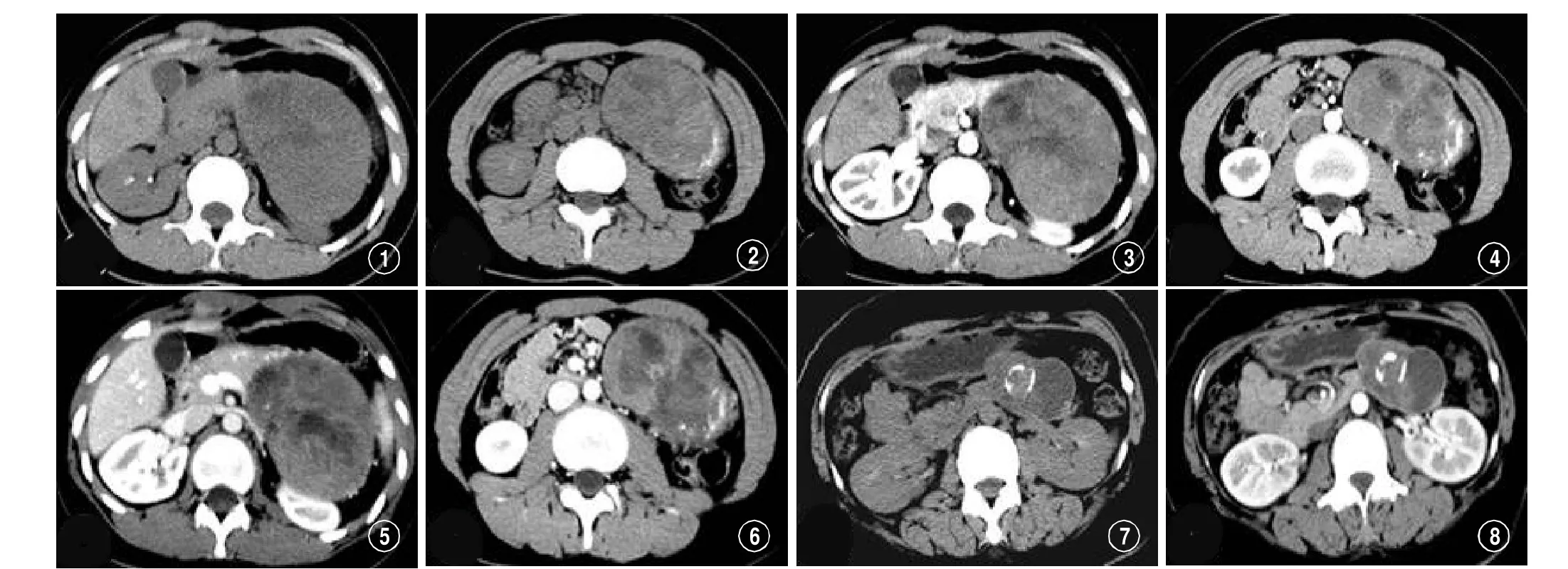

胰腺实性假乳头状瘤多期CT增强扫描图像。图1-6患者女性,20岁。CT平扫(图1、2)显示病灶位于胰尾部,边缘见条状钙化,动脉期(图3、4)见病灶轻度强化,平衡期(图5、6)病灶强化程度增加,胰管未见扩张。图7~9患者女性,33岁。CT平扫(图7)显示病灶位于胰尾部,内见点条状钙化,病灶以囊性成分为主,增强后动脉期(图8)见实性成分轻度强化,平衡期(图9)实性成分强化程度增加,胰管未见扩张。
讨 论
胰腺实性假乳头状瘤是一种较少见的低度恶性肿瘤。1996年WHO认为实性假乳头状瘤在概念上更贴切,更能充分描述其代表的肿瘤的主要特征,并较少同其他肿瘤混淆,才正式命名为胰腺实性假乳头状瘤,并将SPTP新分类为生物学行为未定或交界性恶性潜能的肿瘤[2-3]。肿瘤好发于女性,男性少见,本组病例中9例为女性,实验室检查,血尿淀粉酶均正常,CA199、CA125、CEA等肿瘤标志物阴性,与文献[4]报道基本一致。大约10%-15%的SPTP出现局部浸润和转移,表现为周围组织的侵犯和肝、淋巴结、腹膜和网膜等部位转移。SPTP预后较好,多数肿瘤能被完整切除治愈,仅5%局部复发,极少数有淋巴结、肝脏、腹膜转移。即使发生转移经合理治疗后,大多患者仍可长期生存。
SPTP大体标本常为圆形或类圆形囊实性肿物,一般较大,外有较厚纤维包膜,多完整,切面多有出血、坏死而致的不同程度囊变。SPTP的组织学表现较一致。肿瘤多有较厚纤维性包膜,内由实性区、假乳头区及两者的过渡区以不同比例混合而成。实性区在纤细的纤维血管束周围肿瘤细胞排列成片状、索状,瘤细胞一致,中等大小,圆形或卵圆形。假乳头区肿瘤细胞以纤细的纤维血管为轴心形成分支状假乳头,其表现细胞呈复层排列,远离血管周围细胞产生退行性变,并表现为不同程度的坏死、出血、囊性变。实性区与假乳头区之间肿瘤细胞围绕血管形成假菊形团排列。免疫组化检查多数肿瘤细胞AACT、NSE、Vimentin呈弥漫阳性,尚有少数表达S-100等指标。
SPTP病理成分不同,影像学表现亦各异。肿瘤实性区由较为一致瘤细胞构成,呈片块状或巢状排列,CT表现为相对均匀的实性成分。实性区因退变、出血、坏死可出现微囊,CT表现为小囊变灶。假乳头状区肿瘤细胞排列成片状、索条状或围绕血管及坏死区呈放射状、假乳头状排列为重要的病理学特征,CT表现为不均匀囊实性区。实性与假乳头之间过度区由肿瘤组织围绕血管形成假菊形团,离血管较远的区域易发生坏死,CT表现为完全囊性区[5-6]。众多学者认为SPTP有延迟强化特点,即实性成分随时间逐渐强化,这是因为实性与假乳头之间过度区形成假菊形团,相对较少的肿瘤细胞呈网状排列,之间形成血窦,因此CT表现出类似海绵状血管瘤的延迟强化特点[7]。本组病例中实性成分动脉期仅轻度强化,而平衡期强化程度增加,而囊性成分未见明显强化,基本符合文献报道。
总结10例SPTP患者影像学表现,并结合文献回顾,SPTP诊断依据如下:(1)年轻女性,无黄疸,血、尿淀粉酶正常,CA199、CA125,CEA等肿瘤标志物亦正常。(2)SPTP可发生于胰腺任何部位。国内宰守峰[8]等综合国内154例SPTP报道认为肿瘤多发生于胰尾部和胰头部,本组10例病例中,胰头部8例,胰尾部2例,与报道基本一致。瘤体通常单发、较大,直径多在5cm以上,呈椭圆形或圆形,巨大者可呈分叶状;瘤体常突出胰腺轮廓之外,位于胰腺边缘,向腹腔内或腹膜后生长。本组10例病例,9例突出胰腺轮廓之外,1例局限于胰腺内。一般无胰管和胆总管扩张。(3)肿瘤多为囊实性,密度不均,实性结构呈延迟强化表现,强化程度较正常胰腺低;肿瘤实性成分或包膜内可出现钙化,有文献报道钙化率达30%,多呈点状和条状,位于肿瘤边缘。本组有2例患者瘤体边缘及内部见斑点状及条状钙化。钙化和胆固醇沉积仅提示肿瘤生长缓慢和生长时间较长,并无特异性。(4)肿瘤因包膜及假包膜形成,一般边界清晰。据文献报道包膜完整与否是判断肿瘤的良性或低度恶性的重要依据。本组2例肿瘤未见明显包膜,术前提示低度恶性,与术后病理相吻合。
SPTP是一种低度恶性胰腺肿瘤,手术治愈率高,影像学表现与胰腺其他肿瘤特别是其他良性肿瘤或低度恶性肿瘤重叠较多,须注意与其进行鉴别诊断。(1)胰腺癌:多见于老年男性,恶性程度高,钙化少见,由于肿瘤组织乏血供,容易坏死,边缘模糊,与正常胰腺分界不清,坏死区多不规则,早期即可引起胰胆管扩张,侵犯邻近的组织和血管,增强后肿瘤强化不明显。(2)胰腺囊腺瘤或囊腺癌[9]:多见于中老年女性,肿块呈圆形或分叶状改变,可见多房水样密度,增强后多个强化的分隔和内部实性结节是其典型影像表现。(3)胰腺假性囊肿:常有胰腺炎病史,多呈圆形或类圆形,无分叶改变,少有分隔,囊壁薄且无结节。(4)胰岛细胞瘤:SPTP在影像上主要须与无功能性胰岛细胞瘤相鉴别,无功能胰岛细胞瘤增强后动脉期强化程度明显高于SPTP,也常见囊性变、出血和钙化,其囊实性分区分布,不同于SPTP混合分布,主要由于无功能胰岛细胞瘤缺乏SPTP中常见的假乳头排列。
总之,当年轻女性,无黄疸,临床相关肿瘤标志物阴性,而CT表现为胰腺囊实性肿物,增强后实性成分呈延迟强化时,高度提示胰腺实性假乳头状瘤。
1.林瑞新,宫路路,房学东,等. 胰腺实性假乳头状瘤临床分析[J].肝胆胰外科杂志,2008,20(1):54-55.
2.Choi JY, Kim MJ, Kim JH, et al.Solid pseudopapillary tumor of the pancreas: typical and atypical manifestations[J].AJR,2006,187(2):178-186.
3.陈杰.外分泌胰腺肿瘤组织学分型(1996),WHO肿瘤国际组织学新分类(编译)[J].诊断病理学杂志,2001,6:29-36.
4.Adsay NV, HastehF, Cheng JD, et al.Squamous-lined cysts of the pancreas:lymphoepithelial cysts, dermoid cysts (teratomas ), and accessorysplenic epidermoid cysts[J]. Semin Diagn Pathol, 2004,17:56-65.
5.苏宇征,孙斌,薛蕴菁,等.胰腺实性假乳头状瘤的CT和MRI诊断[J].中国CT和MRI杂志,2010,8(2):37-40.
6.谢淑飞,梁长虹,张忠林,等. 胰腺实性假乳头状瘤CT和MRI诊断[J].中国医学影像技术,2006, 22(5):751-753.
7.Cantisani V, Mortele KJ, Levy A, et al. MR imaging features of solid pseudopapillary tumor of the pancreas in adult and pediatric patients[J].AJ R, 2003,181(2):395-401.
8.宰守峰,郭树平,赵娟. 国内154例胰腺实性假乳头状瘤的临床特点[J]. 中国医药指南,2009, 7(10):46-48.
9.阴建兵,花明学,雷贯非.胰腺囊腺癌一例[J].罕少疾病杂志,2003,10(3):42.

