探针熔解分析法快速检测结核分枝杆菌链霉素耐药突变*
张向东,张 婷,牛建军,温慧欣,胡思玉,李庆阁
20世纪80年代后期,由于贫困、艾滋病、人口流动和耐药等因素,结核病发病率和死亡率在全球范围内出现快速回升,成为与艾滋病并列的全球性危害最严重的传染病。结核分枝杆菌耐药情况严重,耐药率高达46%,给结核病的预防和治疗带来严峻挑战[1-3]。
抗结核药物是结核病化学治疗的基础,而结核病的化学治疗是人类控制结核病的主要手段。链霉素发现于20世纪40年代,是最早出现的有效抗结核药物[4],也是治疗结核病的一线药物之一。链霉素是一种氨基环醇糖苷类抗生素,主要作用于结核分枝杆菌的核糖体,与结核分枝杆菌的核糖体30S亚单位结合,诱导遗传密码的错配,抑制mRNA翻译的开始,干扰翻译过程中的校对,从而抑制蛋白质的合成[5]。链霉素经常单独给药,因此其耐药性发展较快。结核分枝杆菌耐链霉素的主要分子机制是编码小亚基的S12蛋白的rpsL基因和编码16S核糖体RNA的rrs基因突变,从而抑制药物结合核糖体的能力,造成对链霉素耐药[6]。
结核分枝杆菌链霉素耐药性的检测对于控制耐药性结核分枝杆菌的传播以及控制结核病有极其重要的意义。目前临床上采用的耐药检测方法可分为表型检测和基因型检测两类[7-8],并以前者为主。然而表型检测因为各种原因,如耗时、设备昂贵、有放射性危害或干扰因素多等,难以形成快速高效的筛查手段。相对而言,基因检测更为直接,目前已经使用的基因分析方法有单链构象多态性分析法(SSCP),限制性片段长度多态性分析法(RFLP),DNA测序法,线性探针杂交法,RNA/RNA错配分析法,以及DNA阵列(芯片)检测等[9-10]。这些方法虽然检出率和通量高低不同,但共同缺点是需要进行PCR后处理,不仅影响了检测效率,易引起扩增产物污染,而且增加了操作难度,提高了对实验室的要求。
实时PCR技术将扩增和检测两步骤合一,具有快速、特异、灵敏、定量等优点,已在病原微生物检测和突变检测领域得到广泛应用,近年来在结核菌耐药检测上的应用也引起人们极大兴趣[11-13]。本研究利用厦门致善生物科技有限公司的结核分枝杆菌链霉素耐药突变实时PCR检测试剂盒(探针熔解分析法)对结核分枝杆菌基因组中链霉素耐药相关突变位点进行检测。
1 材料与方法
1.1 菌株来源及处理
1.1.1 菌株来源
1.1.1.1 临床分离株 从2006年6月至2009年12月分别从厦门市疾病预防控制中心、厦门市第一医院、漳州市疾病预防控制中心收集,合计906份。将收集的结核分枝杆菌临床分离株采用酸性改良罗氏培养基及Biomerieux BacT/AL ERT 3D 60培养系统进行分离和培养。
1.1.1.2 野生型标本 结核分枝杆菌 H37RV标准株来源于国家结核病参比实验室。
1.1.1.3 标准菌株盘 特异性实验所用的包含37株非结核分枝杆菌的标准盘,由中国药品生物制品检定所提供。
1.1.2 菌株处理 PCR扩增模板用试剂盒提供的提取液制备。具体如下:固体培养基上生长的结核分枝杆菌,用接种环收集细菌并悬于300μL提取液中。液体培养基中生长的结核分枝杆菌取1mL,10 000r/min离心15min,丢弃上清并在300μL提取液中重悬细菌。封口膜封口,99℃加热20min,然后14 000r/min离心10min,转移上清到新1.5 mL离心管。上清即为PCR扩增模板,模板浓度经紫外定量,要求结核杆菌含量不低于103拷贝/μL。使用前保存于-20℃。
1.2 实验仪器 用 T3 Thermocycler(Biometra,Germany)普通 PCR仪和 Bio-Rad CFX96(Bio-Rad,USA)实时PCR仪检测。
1.3 试剂盒评价 结核分枝杆菌链霉素耐药突变实时PCR检测试剂盒(探针熔解分析法)由厦门致善生物科技有限公司提供。该试剂盒采用探针熔解分析法检测rpsL和rrs基因突变,试剂盒包括提取体系(细菌DNA提取液)、扩增体系(PCR反应混合液和酶)和对照体系(阳性对照品和阴性对照品)。检测流程包括PCR扩增和熔解分析两步骤,可以单独在实时 PCR仪器上一步完成,也可以先在普通PCR仪上进行扩增,再移至实时 PCR上进行熔解分析。反应程序为95℃5min;95℃10s,70℃20s(每个循环下降 1℃),75℃20s,循环 10次;95℃10s,60℃20s(检测荧光),75℃20s,循环30次,荧光通道选用 FAM和 TET;熔解分析程序:40~80℃,每度进行FAM和 TET荧光采集。其检测原理是野生型基因具有特定的熔点,基因突变导致探针结合能力下降,熔点会下降3~10℃不等,根据熔点变化即可判断突变的有无。
链霉素耐药突变检测分两管在双色实时PCR仪器进行。一管检测rpsL43、rpsL88密码子基因突变,另一管检测rrs513~517位点和rrs905~908位点基因突变,PCR体系按照试剂盒说明书配制,25μL检测体系含 20μL PCR反应液和 5μL模板DNA。
1.3.1 特异性考察 用中国药品生物制品检定所提供的37株非结核分枝杆菌考察该试剂盒的分析特异性。
1.3.2 灵敏度考察 将纯化的标准株基因组DNA以10倍梯度从105拷贝/μL稀释到100拷贝/μL作为扩增模板,考察该试剂盒的分析灵敏度。
1.4 标本检测 将不同来源的906株结核患者临床分离株用该试剂盒进行检测,所有检测为突变的标本、疑似为杂合的标本、与药敏结果不符的标本均测序验证。测序由北京六合华大基因科技股份有限公司完成。
2 结 果
2.1 体系分析特异性考察 经验证,37份非结核分枝杆菌中只有1份非结核分枝杆菌在rrs513环区有非特异信号,为胃分枝杆菌,但在其它3个位点均无信号,故不影响检测,如图1。

图1 试剂盒分析特异性考察图中阳性对照及空白对照用实线表示,37株非结核分枝杆菌用虚线表示Fig.1 Results of the analytical specificity testThe solid line represented wild type control and nontemplate control,while the dashed line represented 37 standard non tuberculosis mycobacterium strains
2.2 体系分析灵敏度考察 经验证,该试剂盒可以检测出5~50copies H37Rv每反应,且各浓度梯度的Tm值均一性良好。
2.3 标本检测结果 共检测了906份结核分枝杆菌培养标本,其中103份标本发生突变,突变比例为11.37%,有18份标本存在杂合信号,17份标本存在不同程度的无信号现象。实时检测结果具体总结如表1。
在4个检测区域中,rpsL43位点的突变率最高,占到突变总数的77.67%;rrs513区域和rpsL88位点突变率次之,rrs905区域的突变率最低,占突变总数比例分别为10.68%、10.68%和0.97%。所得结果与文献中所报道的相符[14-15]。
18份存在杂合信号的标本在实时结果中体现为在野生峰的左侧突变位置有小峰,或者野生峰的左侧往上偏,甚至峰值偏低1℃左右。出现这几种情况的峰型后,将该标本出现杂合信号的相应区域进行测序验证,杂合测序结果如图2。
17份标本在不同区域的实时结果没有信号,且均做过重复实验,具体原因可能为:1)标本中不存在结核分枝杆菌基因组DNA,从而无法扩增得到目的片段;2)标本中存在较高浓度的抑制剂,产生的目的片段量大大减少甚至完全没有;3)人为操作误差或仪器误差等。
2.4 测序验证 103份突变标本的测序结果与使用结核分枝杆菌链霉素耐药突变检测试剂盒所得结果符合率为100%。具体测序结果及其对应Tm值如表 2。另外,rpsL43、rpsL88、rrs513和rrs905 4个位点的野生Tm值分别为 59℃、67℃、65℃和62℃。表中比率为该种突变类型占突变总数的百分比。
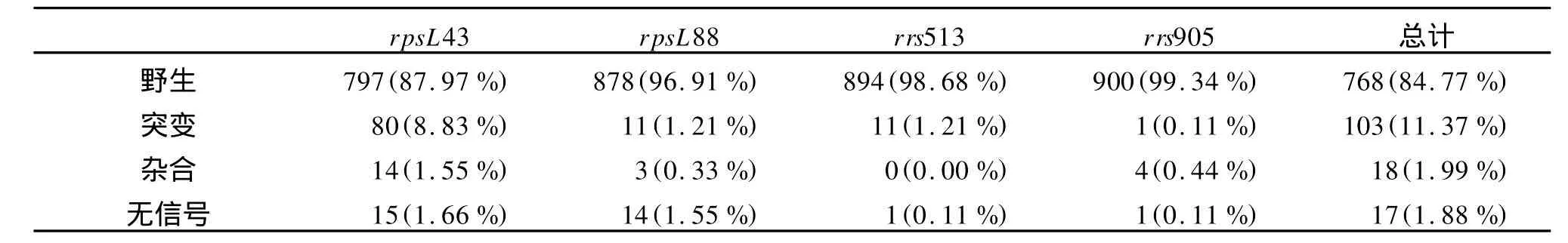
表1 结核分枝杆菌临床分离株探针熔解分析法检测结果Table 1 Results ofMycobacterium tuberculosisclinical isolates by using PMA
18份杂合标本的测序结果中,4份标本为杂合,如图2,rpsL43位点野生型序列为AAG,同时不同程度杂合了rpsL43位点序列为AGG的扩增产物,说明在野生型菌株DNA模板中存在突变为AGG的菌株DNA模板。11份标本测序只得到纯合结果,可能是因为测序的检测灵敏度低于此检测体系的灵敏度,从而无法得到杂合结果。2份标本在探针覆盖区均为野生序列,但是在探针左边非覆盖区的第一个碱基由C突变为 T,此即为熔解峰异常的原因,但之前文献中并未报道过此位点与链霉素耐药的相关性,并且这3份标本均无药敏结果,因此无法判断这3份标本耐药与否。在链霉素耐药相关位点,用此检测体系得到的结果与测序结果的一致性达到100%。

表2 突变标本测序结果Table 2 Sequencing results of mutant isolates
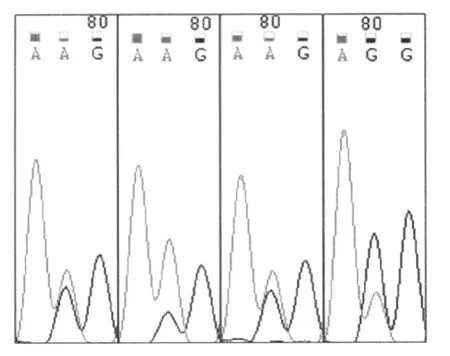
图2 4份杂合标本测序结果Fig.2 Sequencing results of the four heterozygous isolates
2.5 药敏结果对照 在上述908份标本中,37份标本有药物敏感试验结果,具体对照情况如表3。在这37份标本中,实时检测为突变的药敏结果均为耐药,但有9份标本实时检测为野生而药敏结果也为耐药。这种情况是可能出现的,因为在链霉素耐药菌株中,只有75%左右的菌株会发生基因突变,约25%的菌株基因型为野生,一方面可能是在目前报道的链霉素相关突变位点之外的区域存在未被发现的突变;另一方面可能并不是基因突变而导致耐药,而可能与细胞膜的通透性有关[16-17]。由于目前只检测了37份有药敏结果的标本,药敏结果为耐药的标本只有16份,因此突变检出率并不能真正反应此检测方法的临床灵敏度。
为更好地评价探针熔解分析法,将37份有药敏结果的标本均进行测序验证。4个检测区域采用3个片段进行测序:rpsL43和rpsL88使用一对测序引物扩增并测序,rrs512采用一对测序引物扩增并测序,rrs905采用一对测序引物扩增并测序。具体测序结果如表4。
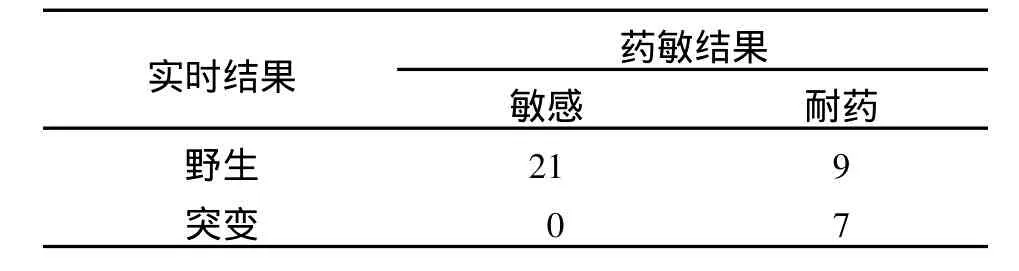
表3 实时结果与药敏结果对照(份)Table 3 Comparison of drug susceptibility results

表4 有药敏结果的37份标本测序结果Table 4 Sequencing results of 37 samples
用探针熔解分析法检测出的7份突变标本测序均为突变,与药敏结果一致。其中,rpsL43位点4份突变标本均由AAG突变为AGG,rpsL88位点1份突变标本由AAG突变为AGG,rrs513位点2份突变标本分别为514A→C和517C→T。与药敏结果不符的9份耐药标本实时检测均为野生,经测序验证,这9份标本的4个检测区域均为野生型,证实了探针熔解分析法的准确性,同时也提示耐药机制可能为这4个区域以外的基因突变或者是其它的耐药机制如细胞膜通透性改变。
另外,这37份标本均为2008年初分离、培养及提取的,且经过多次实验,冻融次数较多,加上基因组较容易断裂,导致此批标本降解情况严重,因此会有部分标本无法扩增成功,琼脂糖凝胶电泳后并无产物条带,无法进行测序分析。而由于测序的3个片段采用不同的3对引物扩增,其扩增效率并不相同,rpsL片段的扩增效率较rrs513和rrs905这两个片段的扩增效率高,37份标本rpsL片段的测序结果均正常,而rrs513和rrs905片段分别有16份和10份标本无目的条带。
总之,所有有测序结果的标本或片段的测序结果均与探针熔解分析法检测所得结果一致,验证了探针熔解分析法的实用性。但有药敏结果的标本数只有37份,探针熔解分析法仍需更多有药敏结果的标本验证,以体现此方法的可靠性。
3 讨 论
由于结核分枝杆菌生长缓慢,经增菌培养再做药物敏感性试验一般需要4~6周,因此,对耐药结核病患者的治疗不能及时提供有效的指导,难以满足临床的需要,迫切需要快速检测结核杆菌耐药性的实验方法。近年来逐渐发展了一些基于分子水平的检测基因突变的方法,如单链构象多态性分析法(SSCP),限制性片段长度多态性分析法(RFLP),DNA测序法,线性探针杂交法等,相比于培养方法更为快速,在一定程度上提高了检出率和通量,但是均需要进行PCR后处理,不仅影响了检测效率,易引起扩增产物污染,而且增加了操作难度,提高了对实验室的要求。相比之下,实时荧光PCR技术有着显著的优点。首先,具有实时扩增实时检测的优势,大大节省检测时间。本实验的单个样品的检测时间只需2 h;没有PCR后处理的步骤,减少了污染的机会;同时还具有多重 PCR高效、快捷、简便、经济等优点,可以同时对结核分枝杆菌链霉素耐药多个相关基因突变同时进行检测,特别适用于大批量筛查。
大多数菌株链霉素耐药的产生是由于核糖体蛋白S12编码基因(rpsL)和16S核糖体 RNA编码基因(rrs)突变所致,70%以上的基因突变发生在rpsL43位点。本文所考察试剂盒针对rpsL43、rpsL88、rrs513~517和rrs905~908四个区域进行检测,可以检测到在这四个区域发生突变的全部菌株,但是对于未检测出突变的并不能肯定该菌株对于链霉素为敏感。
本研究应用探针熔解分析法,筛查了906份结核分枝杆菌菌株。从检测结果可以看出,有11.73%的标本存在基因突变,在四个检测区域中,rpsL43位点的突变率最高,占到突变总数的77.67%;rrs513区域和rpsL88位点突变率次之,rrs905区域的突变率最低,占突变总数比例分别为10.68%、10.68%和0.97%。37份有药敏结果的标本中,药敏为敏感的标本用本研究所采用的方法所得结果均为野生型,说明本研究所采用的方法有很高的特异性。而药敏为耐药的16份标本仅检测到7份突变,另外有9份标本实时检测为野生,而且经测序确认,该检测体系中的4个位点均未发生突变,可能是在这4个位点以外的基因上发生突变或者是其它的耐药机制如细胞膜通透性改变。而由于目前只检测了37份有药敏结果的标本,药敏结果为耐药的标本只有16份,因此突变检出率并不能真正反应此检测体系的临床灵敏度。
总之,本研究所采用的检测体系与药敏结果以及测序结果的一致性较好,检测覆盖范围广,并且操作简便,检测快速,符合临床的需要,虽然受限于其自身耐药突变的特点而无法检出所有的耐药结核分枝杆菌,但对于快速筛查结核分枝杆菌链霉素耐药突变以及制定相应治疗方案、从而降低耐药菌株在人群中的传播具有十分积极的意义,有望成为适合于临床使用的诊断方法。
[1]李拯民.艾滋病和结核病[J].临床肺科杂志,2005,10(2):134-136.
[2]王超,朱中元.抗结核病药物的研究进展[J].中国热带医学,2008,8(4):673-675.
[3]王甦民.应重视结核病的实验诊断[J].中华医学检验杂志,2005,28(8):769-770.
[4]李志忠,高全金.链霉素在当今抗结核中的地位[J].中国误诊学杂志,2002,2(1):62-63.
[5]Johnson R.Drug resistance inMycobacterium tuberculosis[J].Curr Issues Mol Biol,2006,8(2):97-111.
[6]张晨钰,梁建琴.结核分枝杆菌耐药分子机制的研究进展[J].中国误诊学杂志,2006,6(17):3303-3305.
[7]Harris G.Comparison of three isolation systems for the culture of mycobacteria from respiratory and non-respiratory samples[J].J Clin Pathol,2000,53(8):615-618.
[8]Heifets L.Rapid automated methods(BACTEC System)in clinical mycobacteriology[J].Semin Respir Infect,1986,1(4):242-249.
[9]Mokrousov I.Multicenter evaluation of reverse line blot assay for detection of drug resistance inMycobacterium tuberculosisclinical isolates[J].J MicrobiolMethods,2004,57(3):323-335.
[10]Wu X.Detection of streptomycin resistance inMycobacterium tuberculosisclinical isolates using four molecular methods in China[J].Yi Chuan Xue Bao,2006,33(7):655-663.
[11]El-Hajj H.Detection of rifampin resistance inMycobacterium tuberculosisin a single tube with molecular beacons[J].J Clin Microbiol,2001,39(11):4131-4137.
[12]Garcia V.New real-time PCR able to detect in a single tube multiple rifampin resistance mutations and high-level isoniazid resistance mutations inMycobacterium tuberculosis[J].J Clin Microbiol,2002,40(3):988-995.
[13]Torres M.Use of real-time PCR and fluorimetry for rapid detection of rifampin and isoniazid resistance-associated mutations inMycobacterium tuberculosis[J].J Clin Microbiol,2000,38(9):3194-3199.
[14]WU X,LU Y,ZHANGJ,et al.Detection of streptomycin resistance inMycobacterium tuberculosisclinical isolates using four molecular methods in China[J].Acta Genetica Sinica,2006,33(7):655-663.
[15]Tatjana T,Inta J,Anda N,et al.Characterisation ofrpsL,rrsandembBmutations associated with streptomycin and ethambutol resistance inMycobacterium tuberculosis[J].Research in Microbiology,2004,155:830-834.
[16]Rabia J,Elizabeth M S,Gail E L,et al.Drug resistance inMycobacterium tuberculosis[J].Curr Issues Mol Biol,2006,8:97-112.
[17]Ram D,Pushpa G,Pushpendra S,et al.Association of mutations inrpsLgene with high degree of streptomycin resistance in clinical isolates ofMycobacterium tuberculosisin India[J].Indian J Med Res,2009,129:108-110.

