H9亚型禽流感病毒RT-LAMP可视化检测方法的建立*
彭 宜,谢芝勋,刘加波,庞耀珊,邓显文,谢志勤,谢丽基,范 晴
禽流感(Avian Influenza,AI)是由正黏病毒科流感病毒属A型流感病毒引起的一种禽类(家禽和野禽)传染病[1]。根据禽流感病毒(AIV)的致病性强弱,禽流感可分为高致病性禽流感、低致病性禽流感和无致病性禽流感[2-3]。高致病性禽流感是由H5亚型和 H7亚型病禽流感毒引起的,以全身感染、高发病率和高死亡率为特征。H9亚型禽流感虽属于低致病性禽流感,但可造成蛋鸡的产蛋量严重下降,肉鸡和青年鸡的复合型呼吸道疾病和死淘率升高,给我国的养禽业造成了严重的经济损失。近年来内地和香港陆续出现的 H9N2亚型AIV跨越宿主屏障直接感染人的事件,更是给人类的健康带来了巨大威胁[4-5]。因此迫切需要建立 H9亚型禽流感病毒的快速检测技术,为我国 H9亚型禽流感的防控提供技术支撑。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是由 Notomi等[6]于2000年建立的一种新型核酸扩增技术,其原理是通过识别靶序列上8个特异区域的引物和一种具有链置换活性的Bst DNA聚合酶,在等温条件下进行自动循环的链置换核酸扩增反应,反应中会产生大量肉眼可见的白色沉淀。该技术具有特异性高、操作简便、反应迅速、成本低廉等优点,目前在一些病原微生物的检测中开始被广泛运用[7]。本研究根据LAMP原理,优化相关反应条件,建立了适合基层的H9亚型禽流感病毒逆转录环介导等温扩增(RT-LAMP)快速检测方法。
1 材料与方法
1.1 毒株 H3、H9亚型AIV由本实验室分离鉴定,H5N2、H7N2亚型禽流感病毒 RNA为美国宾夕法尼亚州立大学禽病诊断研究室惠赠;新城疫病毒(NDV)F48、传染性支气管炎病毒(IBV)M41、传染性喉气管炎病毒(IL TV)北京株及鸡毒霉形体(MG)S6由本实验室保存提供。
1.2 试剂 Bst DNA聚合酶(大片段)、MgSO4、Betaine购自New England Biolabs公司。AMV反转录酶、EcoRⅠ、EcoRⅤ、dNTP购自 TaKaRa公司。SPF鸡胚购自北京梅里亚公司。SYBR Green I荧光染料购自北京Solarbio公司。RNA提取试剂 TRIzol LS Reagent购自Invitrogen公司。
1.3 引物的设计与合成 下载 GenBank中 H9亚型AIV的 HA基因序列,利用Lasergene软件进行多序列比对,在保守区运用在线软件 Primer Explorer V4设计LAMP引物。引物包括外引物、内引物和环引物,其中 F3和B3为外引物,FIP(F1c+GAATTC+F2)和BIP(B1c+GA TATC+B2)为内引物,LF和LB为环引物。F1c、F2和B1c、B2之间分别为EcoRⅠ和EcoRⅤ酶切位点,引物由上海Invitrogen公司合成。引物序列见表1。
1.4 RNA抽提 参照 TRIzol LS Reagent使用说明书和文献[8]进行病毒 RNA抽提,-70℃保存备用。
1.5 RT-LAMP反应条件的优化 对反应体系在如下范围内进行优化:MgSO4(0.6~9mmol/L)、Betaine(0.2~1.9mmol/L)、Bst DNA PoLymerase(4~14U)、dNTP(0.6~1.6mmol/L)。将温度按59℃、60℃、61℃、62℃、63℃、64℃依次递增,多次重复试验后确定最佳退火温度。

表1 RT-LAMP引物序列Table 1 Sequences of RT-LAMP primers
1.6 特异性和灵敏度检验 利用优化好的 RTLAMP反应体系,以 H3、H5、H7、H9亚型 AIV 及NDV 、IBV、IL TV、MG核酸为待检样品进行检测,检验RT-LAMP方法的特异性。将制备的H9亚型禽流感病毒RNA按10倍递增稀释,并使用Beckman UV-800紫外分光光度计测定稀释后各个梯度的 RNA 浓度 ,分别为 1 ng、100 pg、10 pg、1 pg、0.1 pg、0.01pg、1fg。对各浓度 RNA 用 RT-LAMP方法进行检测,并用一步RT-PCR方法同时进行扩增。1.5%琼脂糖凝胶电泳观察结果确定该方法的灵敏度。
1.7 临床样品检测 利用建立的 H9亚型禽流感病毒RT-LAMP方法对本实验室分离的6株H9亚型AIV进行扩增,验证RT-LAMP方法的可靠性。1.8 RT-LAMP产物酶切鉴定 RT-LAMP反应结束后,采用限制性内切酶EcoRⅠ和EcoRⅤ进行酶切鉴定,酶切体系如下:RT-LAMP产物6μL、10×buffer 2μL、EcoR Ⅰ2μL、EcoR Ⅴ2μL、去离子水8μL,37℃作用过夜。酶切产物用1.5%琼脂糖凝胶进行电泳。
1.9 RT-LAMP反应结果的可视化观察
1.9.1 比浊法 RT-LAMP反应结束后直接观察管内溶液浑浊度,随后采取离心的方法(8 000r/min,3min)使生成的焦磷酸镁悬浊液形成白色沉淀,通过观察反应管底部的白色沉淀来判定结果。1.9.2 荧光法 RT-LAMP反应结束后加入25×SYBR Green I染料1μL,充分混匀后观察溶液颜色变化,并将溶液置于365nm紫外光下观察有无荧光产生。
2 结 果
2.1 RT-LAMP反应条件的优化 通过对各反应条件优化后,最终确定各组份的终浓度为 F3、B3引物各 0.2μmol/L,FIP、BIP 引物各 1.6μmol/L,LF和LB引物各 0.8μmol/L,Mg2+7mmol/L,dNTP 0.8 mmol/L,Betaine 1 mmol/L,Bst DNA PoLymerase 8U,AMV 5U,去离子水3.5μL,反应总体系为25μL。置63℃水浴锅中,反应45min,80℃作用5min终止反应。
2.2 特异性检验 如图1所示,只有 H9亚型AIV样品为阳性结果,H3、H5、H7亚型AIV及NDV 、IBV、IL TV、MG均没有特征性梯形条带出现。
2.3 灵敏度检验 如图2、图3所示,该方法对 H9亚型AIV RNA的最小检测限为0.01pg,灵敏度是一步法RT-PCR方法的1000倍。
2.4 临床样品检测如图4所示,临床分离的6株H9亚型AIV均出现特征性梯形条带,与预期结果相符。

图1 RT-LAMP方法检测 H9亚型AIV的特异性Fig.1 Specificity of RT-LAMPassay for detection of H9 subtype AIVM:100bp DNA Ladder;1:Blank control;2-9:IBV,IL TV,MG,NDV,H3 subtype AIV,H5 subtype AIV,H7 subtype AIV,H9 subtype AIV,respectively

图2 RT-LAMP灵敏度试验结果Fig.2 The results of RT-LAMP sensitivity testM:100bp DNA Ladder;1:Blank control;2-8:Different concentration of H9 subtype AIV RNA(1ng,100pg,10pg,1pg,0.1pg,0.01pg,1fg/tube,respectively)
2.5 RT-LAMP产物酶切鉴定 扩增产物通过EcoRⅠ、EcoRⅤ酶切后,出现与预期大小相符的两条主带及少量大小不同的条带,如图5所示。
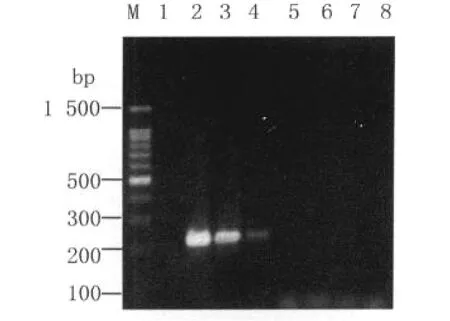
图3 RT-PCR灵敏度试验结果Fig.3 The results of RT-PCR sensitivity testM:100bp DNA Ladder;1:Blank control;2-8:Different concentration of H9 subtype AIV RNA(1ng,100pg,10pg,1pg,0.1pg,0.01pg,1fg/tube,respectively)

图4 广西分离株 H9亚型AIV RT-LAMP扩增结果Fig.4 The results of RT-LAMP for detection of H9 subtype AIV isolated in GuangxiM:100bp DNA Ladder;1:Blank control;2-7:Products of RT-LAMP forH9 subtype AIV isolated in Guangxi

图5 RT-LAMP产物的酶切鉴定Fig.5 Products digested byEcoRIandEcoRVM:100bp DNA Ladder;1:Blank control;2:Products digested byEcoRI andEcoRV
2.6 RT-LAMP反应结果的可视化观察
2.6.1 比浊法 RT-LAMP反应中会生成白色焦磷酸镁沉淀悬浮在溶液中,经离心后在管底可见白色沉淀,阴性对照管则无沉淀产生,如图6A所示。
2.6.2 荧光法 RT-LAMP反应结束后在产物中加入25×SYBR Green I染料,肉眼可见阳性管溶液迅速变绿,阴性对照管溶液为较浅的桔红色,如图6B所示;在紫外光下阳性管溶液发出明亮荧光,阴性对照管溶液没有荧光,如图6C所示。

图6 RT-LAMP结果可视化观察Fig.6 Visual inspection of the results of RT-LAMPA:Results of RT-LAMP confirmed by white sediment;B:Results of RT-LAMP under daylight after adding SYBR GreenⅠ;C:Results of RT-LAMP under UV light after adding SYBR GreenⅠ;1:Positive reaction;2:Negative reaction
3 讨 论
LAMP技术是一种简便、快速、灵敏、成本低廉的新型核酸扩增技术。该技术利用Bst DNA聚合酶在60~65℃具有核酸双链解链功能和瀑布式核酸扩增功能,在等温条件下即可进行核酸的变性和扩增,不需要特殊的仪器设备,仅在水浴锅中就可完成扩增反应[9]。LAMP技术在目的基因保守区设计了针对8个特异区域的6条引物,使扩增反应具有很高的特异性,在内引物之间增加两条环引物提高了扩增效率,缩短了反应时间。LAMP反应结果的观察方法非常简便,在反应过程中焦磷酸根离子会与Mg2+结合产生大量的副产物焦磷酸镁,使反应液变浑浊,离心后可见白色沉淀,另外极高的扩增效率使得反应液中有大量的双链核酸,所以反应结束后向反应液中加入荧光染料,反应液会变成翠绿色,在紫外线下可见较强的绿色荧光,如没有扩增反应则反应液加染料后为桔红色,在紫外线下也无绿色荧光[10-11]。由于LAMP反应的扩增效率很高,在少量cDNA存在的条件下就可进行核酸的大量扩增,所以只需要在LAMP反应体系中加入反转录酶,就可以完成 RNA的检测(RT-LAMP)。RTLAMP技术具有特异性强、仪器设备简单、结果便于观察的特点,应用前景广阔。
本研究建立的 H9亚型禽流感病毒RT-LAMP检测方法能特异的检测 H9亚型AIV,并且表现较高的灵敏度,RNA的最小检测限为0.01pg,是常规RT-PCR的1000倍。整个反应只需要在水浴锅中50min即可完成。由于RT-LAMP反应具有较高的灵敏度,反应试剂、反应器材及环境易因受到微量RNA模板污染而导致假阳性结果的出现,另外RTLAMP反应扩增效率极高,打开反应管时,反应产物易形成气溶胶而污染周围环境,所以不仅配制反应体系时要注意操作防止RNA模板污染试剂,而且应将配制反应体系的区域与观察反应结果的区域进行严格分区,防止假阳性结果的出现。本研究对RT-LAMP反应体系进行了优化,扩增效率极高,反应过程中产生大量的焦磷酸镁,反应结束后对比阴性样品反应液明显可见阳性样品反应液变浑浊,离心后在反应管底部可见白色沉淀,既实现了 RTLAMP反应结果的可视化观察,也避免了打开反应管盖而造成环境的污染。
近年来,H9亚型禽流感病毒不仅能感染禽类给养禽业造成巨大经济损失,而且能突破宿主屏障直接感染人,演变为人类健康的严重威胁。本研究建立的H9亚型禽流感病毒RT-LAMP检测方法尤其适合在基层兽医站和养殖场进行快速检测,对指导我国H9亚型禽流感的防控具有重要意义。
[1]甘孟侯.禽流感[M].北京:北京农业大学出版社,2002:74-78.
[2]Alexander DJ.A review of avian influenza in different bird species[J].Vet Microbiol,2000,74:3-13.
[3]Edwards S.OIE laboratory standards for avian influenza[J].Dev Bio(Basel),2006,124:159-162.
[4]郭元吉,吴昆昱,董婕,等.流感病毒A/广州/333/99(H9N2)毒株基因组特性的研究[J].中华实验和临床病毒学杂志,2002,14:209-212.
[5]Peiris M,Yuen KY,Leung CW,et al.Human infection with influenza H9N2[J].Lancet,1999,354:916-917.
[6]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):e63.
[7]汪一帆,郭潮潭.环介导等温扩增技术及在感染病诊断中的应用[J].中国卫生检验杂志,2008,18(9):1933-1935.
[8]Lee MS,Chang PC,Shien J H,et al.Identification and subtyping of avian influenza viruses by reverse transcription-PCR[J].J Virol Methods,2001,97:13-22.
[9]Tomita N,Mori Y,Kanda H,et al.Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products[J].Nature Protocal,2008,3(5):877-882.
[10]Poon L LM,Leung C SW,Chan KH,et al.Detection of human influenza A viruses by loop-mediated isothermal amplification[J].J Clin Microbiol,2005,43:427-430.
[11]Mori Y,Nagamine K,Tomita N,et al.Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J].Biochem Biophys Res Commun,2001,289:150-154.

