兰索拉唑在胃溃疡患者及健康人体内的药动学研究Δ
潘桂玲,韩 强,张永文
(徐州医学院附属医院药剂科,徐州市 221002)
兰索拉唑在胃溃疡患者及健康人体内的药动学研究Δ
潘桂玲*,韩 强#,张永文
(徐州医学院附属医院药剂科,徐州市 221002)
目的:比较兰索拉唑在胃溃疡患者及健康人体内药动学行为的差异。方法:12名男性受试者(健康者和胃溃疡患者各6名),静脉滴注300mg·L-1兰索拉唑注射液250mL后于不同时间点取血并分离血浆,采用高效液相色谱-二极管阵列检测器(HPLC-DAD)法检测血浆中兰索拉唑的浓度,以DAS2.0软件计算药动学参数。结果:健康者与胃溃疡患者静脉给予兰索拉唑后,人体内药动学参数分别为:t1/2(2.369±1.51)、(2.835±0.99)h,tmax(0.332±0.09)、(0.277±0.05)h,CL(19.882±8.19)、(14.460±7.79)L·h-1,cmax(1092.09±169.69)、(910.76±69.91)ng·mL-1,AUC0~6.5(1475.98±590.23)、(2278.73±567.92)ng·h·mL-1,MRT0~6.5(1.633±0.44)、(1.833±0.42)h。结论:兰索拉唑在胃溃疡患者体内的药动学过程较健康者发生了显著变化。
兰索拉唑;胃溃疡;体内;药动学
兰索拉唑(Lansoprazole)系继奥美拉唑(Omeprazole)之后由武田公司开发的全球第2个质子泵抑制剂类抗溃疡药[1],对基础胃酸和所有刺激物所致的胃酸分泌均有明显的抑制作用,其抑制作用明显优于H2受体阻滞药[2]。单用兰索拉唑对幽门螺杆菌虽无根除作用,但与抗生素联合应用可明显提高幽门螺杆菌的根除率[3~5]。虽有报道兰索拉唑高效液相色谱(HPLC)测定方法及其在健康人体内药动学的研究[6~8],但尚未见在胃溃疡患者体内的研究。本试验对兰索拉唑在胃溃疡患者及健康人体内药动学进行研究,并采用HPLC法测定兰索拉唑在人体内的血药浓度,采用DAS软件拟合了兰索拉唑在胃溃疡和正常人体内的药动学参数,为兰索拉唑在临床上正确使用提供了依据。
1 材料
1.1 仪器
Shimadzu LC-10A高效液相色谱仪,包括SCL-10Avp系统控制器、SPD-M20A二极管阵列检测器、LC-10ADvp两元泵、SIL-20A自动进样器、FCV-10Alvp四元低压梯度洗脱系统、DGU-20As在线脱气机、Lcsolution色谱数据工作站(日本岛津公司);AE240电子天平(十万分之一,瑞士Mettler Toledo公司);5417R台式高速冷冻离心机(德国Eppendorf公司);Di-rect-QTMS超纯水机(美国Millipore公司)。
1.2 试药
注射用兰索拉唑(江苏奥赛康药业有限公司,批号:090510,规格:30mg);兰索拉唑对照品(扬州市三药制药有限公司,批号:20080605,纯度:99.5%);内标:奥美拉唑对照品(江苏奥赛康药业有限公司,批号:YE0908005,纯度:99.5%);甲醇为色谱纯,乙腈、无水碳酸钠(Na2CO3)均为分析纯,水为三次蒸馏水。
2 方法与结果
2.1 色谱条件
色谱柱:Kromasil C18(150mm×4.6mm,5μm);流动相:甲醇-水(54∶46);流速:1.0mL·min-1;柱温:35℃;检测波长:284nm。
2.2 受试者选择
12名男性受试者(6名健康者、6名胃溃疡患者),体重55~70kg,年龄23~35岁。经体检证明肝肾功能正常,心电图正常。试验前2周及试验期间未服用其他任何药物。所有受试者均签署知情同意书,且本试验方案经本院医学伦理委员会审批通过。
2.3 试验方案
将胃溃疡组及健康组男性,静脉滴注300mg·L-1兰索拉唑注射液250mL,于给药后0、0.083、0.17、0.25、0.33、0.5(滴注结束)、0.75、1、1.25、1.5、2、2.5、3.5、4.5、6.6h时各采集血2mL于肝素化试管中,置低速离心机内,在3000r·min-1、15min条件下分离出血浆,-20℃冷冻保存待测。
2.4 试验溶液的制备
2.4.1 兰索拉唑注射液。取0.9%氯化钠注射液250mL,加入注射用拉索拉唑75mg,配置成浓度为300mg·L-1的兰索拉唑注射液。
2.4.2 兰索拉唑对照品溶液。准确称取兰索拉唑对照品5mg,用甲醇溶解并定容至5mL,临用前用甲醇稀释成为50、100、200、500、1000、1600、2000ng·mL-1的系列对照品溶液,置4℃避光保存。
2.4.3 内标溶液。准确称取奥美拉唑对照品1mg,用甲醇溶解并定容至100mL,即得浓度为10000ng·mL-1的奥美拉唑内标溶液,置4℃避光保存。
2.4.4 NaCO3溶液:称取无水NaCO3固体约1g,置于100mL容量瓶内,加入超纯水至刻度,摇匀,即得浓度约为0.1mol·L-1的NaCO3溶液。
2.5 血浆样品处理
取血浆0.5mL,加入内标溶液(10000ng·mL-1奥美拉唑)50μL,涡旋35s混匀。加入NaCO3溶液200μL,涡旋30s,再加入乙腈2mL,涡旋2min,于3000r·min-1离心15min,弃去蛋白沉淀层,取上清液,45℃水浴N2流吹干。残渣用流动相200μL溶解,涡旋2min,于14000r·min-1离心10min,取上清液20μL进样分析。
2.6 数据处理
药动学参数的估算按中国药理学会推荐的药动学程序“DAS2.0”对药-时数据进行自动拟合,根据赤池信息准则(AIC)进行房室模型判别,参数AUC0~t、AUC0~∞,t1/2,MRT0~t、MRT0~∞、tmax、CL、V、cmax等分别作方差分析及双侧t检验。
2.7 方法学考察
2.7.1 线性关系考察及定量下限。精密量取不同浓度的兰索拉唑对照品溶液50μL,加入空白血浆0.45mL,制备成50、100、200、500、1000、2000ng·mL-1的系统标准血浆及100、500、1600ng·mL-1的质控血浆。按“2.5”项下自“加入内标溶液(10000ng·mL-1奥美拉唑)50μL”起操作,每种浓度做3份样品,记录色谱图及兰索拉唑峰面积(As)及内标奥美拉唑峰面积(Ar)。以兰索拉唑对奥美拉唑峰面积比值(As/Ar,Y)的平均值对兰索拉唑血药浓度(c)作线性回归,得标准曲线方程:Y=0.0016c+0.0181。结果表明,兰索拉唑血药浓度在50~2000ng·mL-1范围内,其峰面积与内标奥美拉唑峰面积的比值和兰索拉唑浓度之间呈现良好的线性关系(r=0.9994)。定量下限为50ng·mL-1(n=5,RSD=3.35%,RE=4.26%)。
2.7.2 专属性考察。在本试验所采用的色谱条件下,兰索拉唑出峰时间在7.0min左右,奥美拉唑出峰时间在9.5min左右。兰索拉唑峰形良好,无杂峰干扰测定,基线平稳。表明本方法具有较高的专属性,能准确测定血浆中的兰索拉唑的浓度,灵敏度较高。色谱图见图1。

图1 高效液相色谱图A.空白血浆;B.空白血浆+5000ng·mL-1兰索拉唑;C.空白血浆+1000ng·mL-1兰索拉唑+内标(10000ng·mL-1奥美拉唑)溶液;D.某健康受试者静脉滴注兰索拉唑30mg 0.33h后的血浆样品+内标溶液;1.兰索拉唑;2.奥美拉唑Fig1 HPLC chromatogramsA.blank plasma;B.blank plasma+5000ng·mL-1lansoprazole;C.blank plasma+1000ng·mL-1lansoprazole+internal standard(10000ng·mL-1omeprazole solution);D.plasma sample in healthy volunteer A 0.33h after intravenous injection of lansoprazole 30mg+internal standard;1.lansoprazole;2.omeprazole
2.7.3 回收率试验。精密量取不同浓度的兰索拉唑对照品溶液50μL,加入内标溶液50μL,再加入流动相100μL,涡旋混匀,配成含兰索拉唑浓度分别为50、100、1600ng·mL-1的溶液,每种浓度各做2份样品,精密吸取20μL上清液进样分析。记录色谱图,测定兰索拉唑与内标奥美拉唑的色谱峰面积(As与Ar)。精密量取不同浓度的兰索拉唑对照品溶液50μL,加入空白血浆0.45mL,配成含兰索拉唑浓度分别为50、100、1600ng·mL-1的血浆对照品溶液,每种浓度各做2份样品,每份按“2.5”项下自“加入内标溶液(10000ng·mL-1奥美拉唑)50μL”起操作,记录色谱图,测定兰索拉唑与内标奥美拉唑的色谱峰面积(As1与Ar1)。对上述As1、Ar1与As、Ar按As1/As×100%计算,即为兰索拉唑的绝对回收率,结果兰索拉唑高、中、低浓度回收率均≥70%。另将“绝对回收率试验”中得到的As1、Ar1代入标准曲线方程,按测得浓度/标示浓度×100%计算浓度,即得各浓度血浆样品测定方法的相对回收率,结果兰索拉唑高、中、低浓度相对回收率均≥80%。回收率试验结果见表1。
2.7.4 精密度试验。精密量取不同浓度的兰索拉唑对照品溶液50μL,加入空白血浆0.45mL,制备成含兰索拉唑50、100、1600ng·mL-1的血浆样品。按“2.5”项下自“加入内标溶液(10000ng·mL-1奥美拉唑)50μL”起操作,在日内和日间(连续3d)对每种浓度各做5份样品并测定,记录色谱图,得兰索拉唑峰面积(As)对奥美拉唑峰面积(Ar),用标准曲线计算兰索拉唑的浓度。求得日内和日间RSD,结果见表1。
表1 回收率及精密度试验结果(±s/ng·mL-1)Tab1 Results of recovery and precision test(s±s/ng·mL-1)
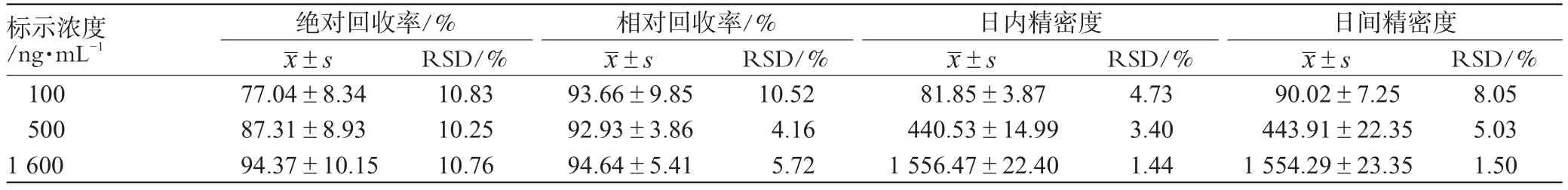
表1 回收率及精密度试验结果(±s/ng·mL-1)Tab1 Results of recovery and precision test(s±s/ng·mL-1)
2.7.5 稳定性考察。(1)血浆样品处理后室温放置稳定性:精密量取兰索拉唑对照品溶液50μL,加入空白血浆0.45mL,制备成100、500、1600ng·mL-1的血浆各2份,按“2.5”项下自“加入内标溶液(10000ng·mL-1奥美拉唑)50μL”起至“于14000r·min-1离心10min”止操作后,每2份一组在室温下分别放置0、12、24h。取上清液20μL进样分析。结果表明,按试验方法处理后兰索拉唑血浆样品在室温下是稳定的。(2)血浆样品冻存稳定性:精密量取兰索拉唑对照溶液50μL,加入空白血浆0.45mL,制备成100、500、1600ng·mL-1的血浆各6份,每2份一组在-20℃下分别放置0、15、30d后按“2.5”项下“加入内标溶液(10000ng·mL-1奥美拉唑)50μL”起操作。结果表明,血浆中兰索拉唑在-20℃下冻存30d是稳定的。(3)血浆样品冻融稳定性:精密量取兰索拉唑对照溶液50μL,加入空白血浆0.45mL,制备成100、500、1600ng·mL-1的血浆各6份,每2份一组在-20℃下反复冻融,3d内测定3次,按“2.5”项下“加入内标溶液(10000ng·mL-1奥美拉唑)50μL”起操作。结果表明,血浆中兰索拉唑在-20℃下反复冻融是稳定的。血浆中兰索拉唑的稳定性考察结果见表2。
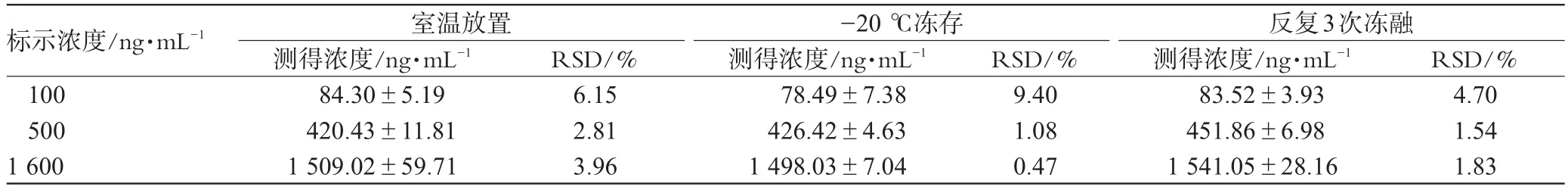
表2 血浆中兰索拉唑的稳定性考察结果(n=2)Tab2 Results of stability test of lansoprazole in plasma(n=2)
2.8 兰索拉唑在胃溃疡患者及健康人体内的药动学研究
将兰索拉唑注射液(300mg·L-1)250mL经静脉滴注于胃溃疡患者及健康人体内,按“2.3”项下采血方案进行试验,血浆样本处理方法按“2.5”项下进行,血药浓度按照“2.7.1”项下标准曲线进行计算,结果见表3;兰索拉唑平均药-时曲线见图2。根据AIC进行房室模型判别,结果表明兰索拉唑在胃溃疡患者及健康人体内药动学行为均符合二房室模型,故采用DAS2.0软件按二房室模型进行拟合,求得胃溃疡患者及健康人静脉滴注兰索拉唑后的主要药动学参数,结果见表4。
由表4可见,分析时间内兰索拉唑在胃溃疡患者体内AUC明显升高(P<0.05),兰索拉唑在胃溃疡患者体内平均滞留时间延长、代谢速度减慢、血浆清除减慢(MRT0~t、t1/2、tmax、CL及cmax和健康组比较P均<0.05),提示胃溃疡病理状态影响兰索拉唑的药动学行为。
3 讨论
本试验发现,兰索拉唑在胃溃疡患者体内过程发生了显著变化,其体内AUC0~6.5明显增加、体内平均滞留时间显著延长、达峰时间提前、血浆消除半衰期显著增大、血浆清除率显著减小,推测可能是在胃溃疡病理状态下体内肝药酶体系发生了改变,导致兰索拉唑代谢减慢,需进一步研究阐述。
本试验使用HPLC法测定兰索拉唑人体血浆药物浓度,分析方法的灵敏度、选择性、精密度和定量分析线性关系均良好,符合生物样品分析测定要求。应用本试验所使用的分离、检测方法测定胃溃疡患者和健康人静脉滴注兰索拉唑后的血药浓度,计算其主要药动学参数,阐明了兰索拉唑在体内的经时过程,进行了兰索拉唑在胃溃疡患者和健康人体内药动学研究,为临床药物浓度监测和药物正确使用提供了试验依据,从而提高了用药安全性。
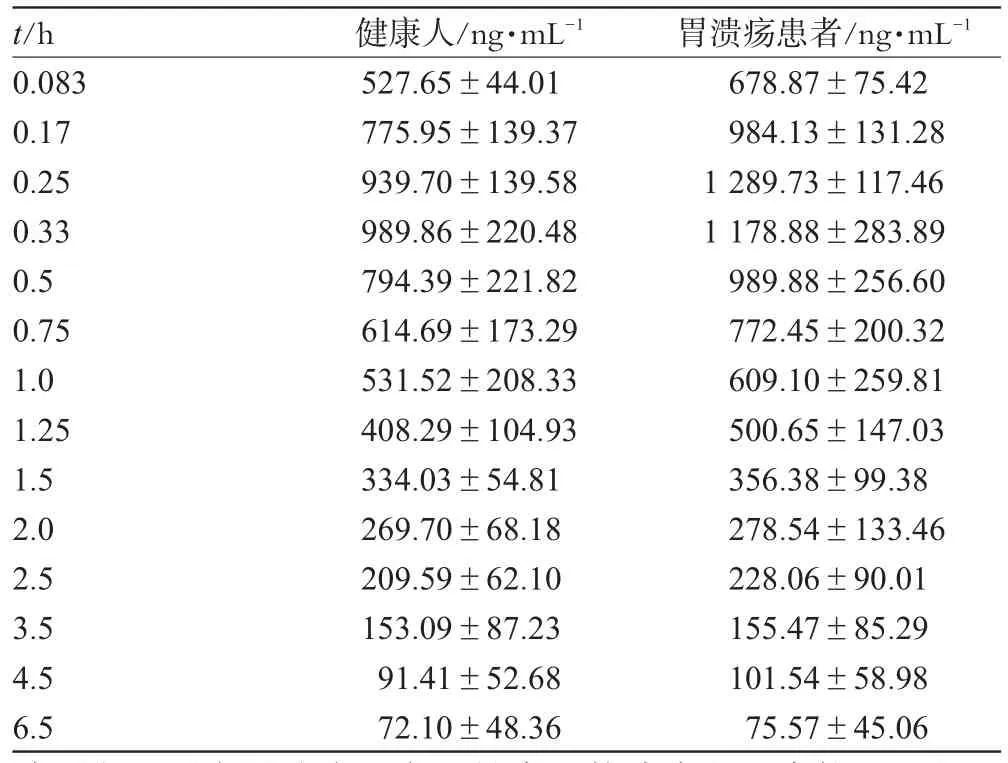
表3 胃溃疡患者及健康人静脉滴注兰索拉唑后不同时间点血浆中的药物浓度(n=6)Tab3 Plasma concentration at different time of lansoprazole in gastric ulcer patients and healthy volunteers with intravenous administration(n=6)
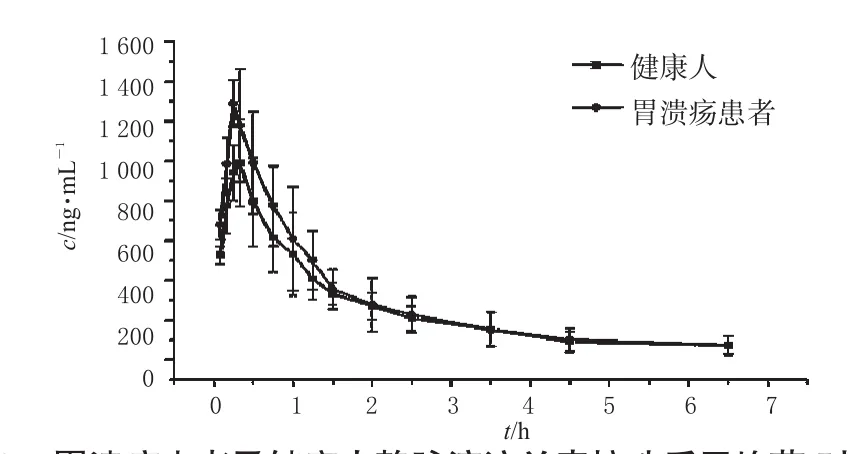
图2 胃溃疡患者及健康人静脉滴注兰索拉唑后平均药-时曲线Fig2 Mean plasma concentration-time curves of lansoprazole in gastric ulcer patients and healthy volunteers with intravenous administration
表4 胃溃疡患者及健康人静脉滴注兰索拉唑后药动学参数(±s ,n=6)Tab4 Pharmacokinetic parameters of lansoprazole in gastric ulcer patients and healthy volunteers with intravenous administratio(n±s ,n=6)
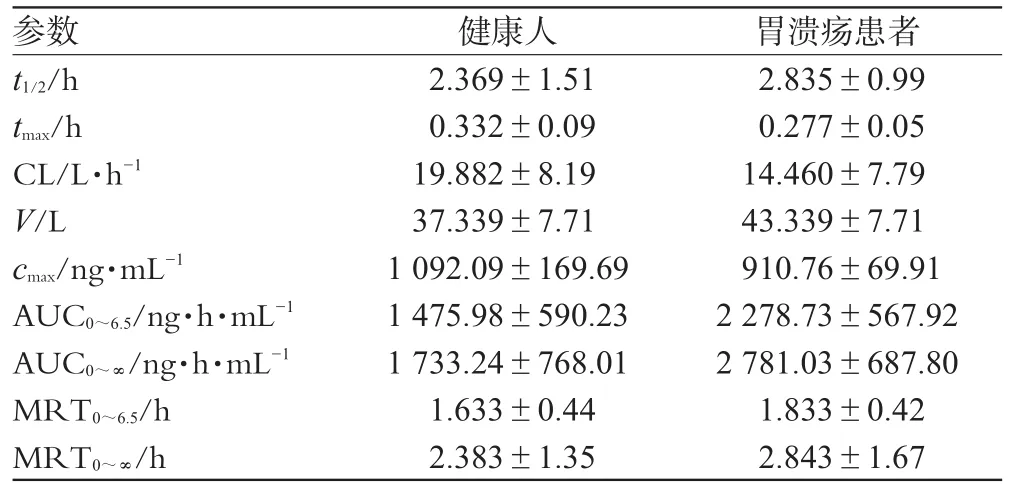
表4 胃溃疡患者及健康人静脉滴注兰索拉唑后药动学参数(±s ,n=6)Tab4 Pharmacokinetic parameters of lansoprazole in gastric ulcer patients and healthy volunteers with intravenous administratio(n±s ,n=6)
参数t1/2/h tmax/h CL/L·h-1 V/L cmax/ng·mL-1 AUC0~6.5/ng·h·mL-1 AUC0~∞/ng·h·mL-1 MRT0~6.5/h MRT0~∞/h健康人2.369±1.510.332±0.0919.882±8.1937.339±7.711092.09±169.691475.98±590.231733.24±768.011.633±0.442.383±1.35胃溃疡患者2.835±0.990.277±0.0514.460±7.7943.339±7.71910.76±69.912278.73±567.922781.03±687.801.833±0.422.843±1.67
[1]Dugger HA,Carlson JD,Henderson W,et al.Quamruzaman.Bioequivalence evaluation of lansoprazole 30-mg capsules in healthy volunteers[J].Eur J Pharm Biopharm,2001,51(2):153.
[2] Baietto L,D'Avolio A,De Rosa FG,et al.Development and validation of a simultaneous extraction procedure for HPLC-MS quantification of daptomycin,amikacin,gentamicin,and rifampicin in human plasma[J].Anal Bioanal Chem,2010,396(2):791.
[3] Miura M,Tada H,Suzuki T.Simultaneous determination of lansoprazole enantiomers and their metabolites in plasma by liquid chromatography with solid-phase extraction[J].J Chromatogr B,2004,804(5):389.
[4] 赵 旭,霍艳双,毕开顺,等.兰索拉唑片的人体药动学和生物等效性研究[J].中国现代应用药学杂志,2009,26(9):742.
[5] Mainz D,Borner K,Koeppe P,et al.Pharmacokinetics of lansoprazole,amoxicillin and clarithromycin after simultaneous and single administration[J].J Antimicrob Chemother,2002,50(5):699.
[6] Bharathi DV,Hotha KK,Jagadeesh B,et al.Simultaneous estimation of four proton pump inhibitors-lansoprazole,omeprazole,pantoprazole and rabeprazole:development of a novel generic HPLC-UV method and its application to clinical pharmacokinetic study[J].Biomed Chromatogr,2009,23(9):732.
[7] 浦锡娟,何 峰.HPLC法测定注射用兰索拉唑中主药及有关物质的含量[J].中国药房,2007,18(13):1013.
[8] 郑志昌,徐春丽.反相高效液相色谱法同时测定血浆中奥美拉唑和兰索拉唑[J].贵阳医学院学报,2007,32(3):261.
Pharmacokinetic Study of Lansoprazole in Gastric Ulcer Patients and Healthy Volunteers
PAN Gui-ling,HAN Qiang,ZHANG Yong-wen
(Dept.of Pharmacy,The Affiliated Hospital of Xuzhou Medical College,Xuzhou 221002,China)
OBJECTIVE:To compare the differences of pharmacokinetic profiles of lansoprazole between gastric ulcer patients and healthy volunteers in vivo.METHODS:12male subjects(6gastric ulcer patients and 6healthy volunteers)were given Lansoprazole injection 250mL via intravenous drip,and then the blood samples were collected at different time points.The concentration of lansoprazole was determined by HPLC-DAD.The pharmacokinetic parameters were analyzed using DAS2.0software.RESULTS:The pharmacokinetic parameters of lansoprazole in healthy volunteers vs.gastric ulcer patients after intravenous administration were as follows:t1/2(2.369±1.51)h vs.(2.835±0.99)h,tmax(0.332±0.09)h vs.(0.277±0.05)h,CL(19.882±8.19)L·h-1vs.(14.460±7.79)L·h-1,cmax(1092.09±169.69)μg·L-1vs.(910.76±69.91)ng·mL-1,AUC0~6.5(1475.98±590.23)ng·h·mL-1vs.(2278.73±567.92)ng·h·mL-1,MRT0~6.5(1.633±0.44)h vs.(1.833±0.42)h.CONCLUSION:The pharmacokinetic profiles of lansoprazole in gastric ulcer patients have changed compared with healthy volunteers.
Lansoprazole;Gastric ulcer;In vivo;Pharmacokinetic
R978.1+3;R969.2
A
1001-0408(2011)18-1665-04
Δ江苏省临床药学研究奥赛康基金(P200806)
*副主任药师。研究方向:医院药学。电话:0516-85802060
#通讯作者:副主任药师。研究方向:临床药学。电话:0516-85802195。E-mail:hanqiang1144@163.com
2010-06-11
2010-11-29)

