从人源大容量天然抗体库中筛选到抗禽流感病毒 H5N1单链抗体*
孙丽娜,于 礼,张 黎 ,李 川 ,李德新 ,梁米芳
抗体库的种类可分为免疫抗体库和非免疫抗体库,免疫抗体库技术是指从经过抗原免疫的动物血液淋巴细胞中分离针对抗原的抗体基因的技术;非免疫抗体库包括天然大容量抗体库和合成抗体库,它是一种不经过免疫就能获得针对某种抗原的基因工程抗体的技术[1]。最早建立的天然库以两个正常人外周血淋巴细胞为材料,初步筛选出针对三种不同抗原的抗体[2]。对于一些自身免疫原引起的疾病(如癌症、自身免疫疾病和心血管疾病)以及快速获得突发新发传染病治疗或诊断用抗体的应急储备库,非免疫抗体库尤其是天然抗体库技术显示了良好的应用前景[3]。
禽流感病毒是一种球形或杆状、有包膜的单股负链 RNA病毒,属于正黏病毒科流感病毒属A型流感病毒,其基因组分为8个节段。病毒囊膜表面的跨膜糖蛋白血凝素蛋白(HA)和神经氨酸酶蛋白(NA)是流感病毒的主要免疫原性抗原。HA识别靶细胞表面受体并与受体相结合,具有与宿主细胞膜融合活性,能够诱导机体产生保护性中和抗体[4-5]。有研究表明人源及人源化中和性抗禽流感病毒 H5N1单克隆抗体对小鼠有良好保护和治疗效果[6-7]。因而,从人源大容量天然抗体库中利用高通量的筛选策略在短时间内获得抗禽流感病毒H5N1人源单抗,对于新发传染病的紧急预防和治疗是十分必要和可行的。本研究利用人源大容量天然抗体库,采用噬菌体表面展示技术,以 H5N1禽流感病毒安徽株 HA为抗原,最终得到了5株针对HA的噬菌体抗体基因,为高致病性禽流感病毒H5N1的预防和治疗带来了希望。
1 材料与方法
1.1 材料 人源大容量天然抗体库 HAL4/7由德国布伦瑞克大学生物技术研究所构建[8],该抗体库库来源于44个健康人淋巴细胞,容量为5×109,抗体库筛选时投入2个分开构建并用高效噬菌体Hyperphage包装的抗体库子库[9],分别为5×1012HAL4库即为VL kappa型和5×1012HAL7库,即为VL lambda型(重链为 VH1,VH2,VH3,VH4,V H5,VH6混合分别与kappa和lambda轻链库混合构建)。携带人源 Fc段的表达载体 pCMV-hIgG1-Fc-XP由德国布伦瑞克大学生物技术研究所构建并惠赠[10]。MDCK细胞及293T细胞来自美国细胞培养中心(A TCC)。禽流感病毒 A/Anhui/1/2005(H5N1)及人流感病毒 A/Hubeihs/53/2005(H1N1)和A/Yunnan/1145/2005(H3N2)感染MDCK细胞后制成病毒抗原片以及昆虫-杆状病毒重组表达的禽流感血凝素蛋白 HA(A/Anhui/1/2005)抗原片均由中国疾病预防控制中心病毒病预防控制所提供并保存,详见参考文献[11]。
1.2 方法
1.2.1 噬菌体抗体库的富集筛选 富集筛选方法基本按文献[12]进行,具体如下:用 1×PBS(p H 7.2)的溶液包被纯化的 HA 抗原(2μg/孔),每孔150μl,4℃过夜;次日用 4%的BSA蛋白溶液于37℃封闭 2 h,弃封闭液;每孔加入 150μL噬菌体抗体库,37℃孵育2 h,弃去未结合的噬菌体,用1×PBST(1×PBS,0.5%Tween 20,p H 7.2)充分洗去未吸附的噬菌体10~30遍;每孔加入 150μL Gly-HCl(p H2.2)的洗脱液,室温震荡洗涤 10 min。加入适量的2 mol/L Tris,以中和洗脱下来的噬菌体;将洗脱的噬菌体立即加入 5 mL新鲜制备的XLI-Blue菌液中(OD600=0.7),静置15~20min;37℃震荡培养1 h,立即取10μL涂2YT-GA(终浓度100μg/mL氨苄青霉素,20 mmol/L葡萄糖)平板,以计算产出量;其余涂2YT-GA平板,37℃过夜培养。次日将平板上长出的细菌刮下,取刮下的细菌加入到100 ml的2YT-GA液体培养基中使OD600=0.3,继续培养使 OD600=0.5,加入辅助噬菌体M13K07(滴度为 1012/mL)200μL,37℃静置 15~20 min,800 r/min振荡培养 1 h,加入卡那霉素(终浓度70μg/mL),30℃培养过夜。如此反复筛选3次。
1.2.2 scFv噬菌体抗体结合活性的phage-ELISA检测 挑取单个克隆到150μL 2YT-GA液体培养基的深孔板于 37℃培养过夜,第2d转接菌液10μL到150μL 2YT-GA液体培养基37℃培养2 h,加入 M13K07使MOI达到20∶1,37 ℃静置15 min,37℃800r/min摇1 h,补加1倍体积的2YTGA液体培养基,加入卡那霉素(终浓度70μg/mL)30℃过夜培养,培养液离心后得到的上清用来检测。用0.1mol/L NaHCO3(p H 9.6)的溶液包被HA抗原,125ng/孔,4℃过夜;4%脱脂奶封闭,37℃1 h,加入呈现的 scFv噬菌体抗体,37℃孵育1 h;加入酶标抗M 13二抗(美国 Sigma,1∶4 000稀释使用),37℃1 h;显色液显色,2 mol/L H2SO4终止反应,酶标仪检测吸光度A450值。
1.2.3 单链抗体 scFv基因序列分析 经过phage-ELISA特异性鉴定得到的针对 HA的阳性克隆进行测序,测序的结果用DNASTAR序列分析软件进行分析,然后用Mega3.0对序列进行 ClustalW分析,对相同的序列进行合并,对合并后的序列与V-Base基因库中的 IgG序列进行比较。
1.2.4 scFv-Fc抗体重组表达质粒的构建与表达
挑选phage-ELISA针对 HA特异性鉴定阳性克隆,经NcoI/N otI双酶切,克隆入携带人源 Fc段的表达载体 pCMV-hIgG1-Fc-XP[11],构建成 scFv-Fc融合抗体表达载体。采用LipofectamineTM 2 000试剂盒(美国,Invitrogen)转染293T细胞,操作方法略述如下:将 0.8~1μg重组质粒 DNA加入50μLOPTIMEMI 中,然 后 将 2 ~ 3μLLipofectamine试剂加入 50μL OPTIMEMI中,5min后两者混合均匀,室温放置20min。将混合好的含目的质粒及Lipofectamine的混合液轻轻加入到清洗过的细胞密度达到90%~95%单层293T细胞中,轻轻混匀后37℃,CO2培养箱中培养6h后,加入含10%小牛血清的DMEM完全培养基,转染后48h,收获细胞,用免疫荧光(IFA)检测。
1.2.5 ELISA检测scFv-Fc抗体与抗原的结合特异性 用0.1 mol/L NaHCO3(p H9.6)的溶液包被纯化 HA(A/Anhui/1/2005)和灭活 H5N1禽流感病毒颗粒(A/Anhui/1/2005),4℃过夜;4%脱脂奶封闭,37℃1 h,加入 scFv-Fc抗体表达上清,37℃孵育1 h,加入酶标抗人Fc二抗(美国 Sigma,1∶2 000稀释),37℃1 h;显色液显色,2 mol/L H2SO4终止反应,酶标仪检测吸光度 A450值。
1.2.6 间接免疫荧光(IFA)检测 scFv-Fc抗体与抗原的结合特异性 高致病性禽流感病毒 A/Anhui/1/2 005(H5N1)及人流感病毒A/Hubeihs/53/2005(H1N1)和A/Yunnan/1145/2005(H3N2)感染MDCK细胞后制成病毒抗原片;同时利用已构建的表达禽流感血凝素蛋白 HA(A/Ahui/1/2005)重组杆状病毒感染 Sf9细胞,4~5d后收获感染细胞制成重组 HA抗原片。加入scFv-Fc抗体表达上清,37℃温育 30 min,冲洗,加入FITC标记的抗 Fc抗体(美国 Sigma),37℃温育30 min,冲洗,晾干,显微镜下观察。
2 结 果
2.1 人源大容量天然抗体库的富集筛选 用纯化的 H5N1禽流感病毒 HA抗原(A/Anhui/1/2005)对天然人源抗体库进行了3轮富集筛选。针对HA抗原,第一、二、三轮筛选分别产出 3.2×103,5.5×104,2.4 ×105个克隆,见表1。

表1 3轮筛选的产出量比较Tab.1 Phage antibody output in three rounds of screening
在第三轮富集的基础上挑选 1 500个克隆,经phage-ELISA鉴定表明,针对 HA抗原得到82个阳性克隆,经测序表明这82个克隆分别属于5个不同的抗体序列,即为5个唯一序列的抗体克隆。
2.2 人源抗禽流感病毒 H5N1 scFv单链抗体的序列分析 用DNASTAR、Mega3.0序列分析软件进行分析处理,比较 Internet V-Base基因库中的IgG序列,上述82株特异性结合 H5N1禽流感病毒HA的人源scFv单克隆抗体中,分别属于5个不同的抗体序列,因此共发现5株带有不同的抗体轻重链可变区序列及其组合的抗体,其重链可变区分类在 IgG V H1和 VH3家族,其轻链可变区分类在IgG VL1和 VL6家族。这 82株抗体中,有 47株相同序列的克隆命名为 AVFluscFv01,其余19株、7株、5株、4株相同序列的克隆分别名为 AVFluscFv04,AVFluscFv02,AVFluscFv03,AVFluscFv05,这5株抗体在筛选中的分布如图 1,其轻重链可变区CDR3氨基酸序列见表2。
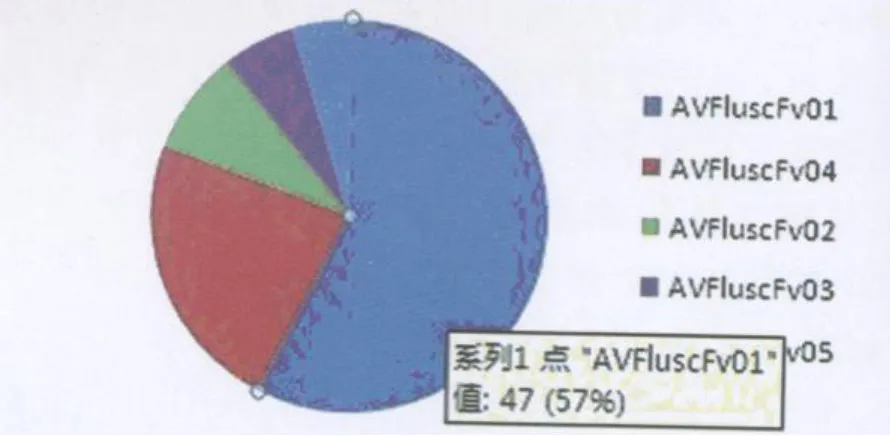
图1 5株单链抗体在筛选中的分布Fig.1 The distribution of the 5 scFv antibodies against HA(A/Anhui/1/2005)in screening

表2 抗禽流感病毒scFv抗体轻重链可变区CDR3氨基酸序列Tab.2 Amino acid sequences of variable regions CDR3 in the Hand L chains of H5N1 virus-specific scFvs
2.3 人源抗 H5N1禽流感病毒scFv-Fc抗体的表达 将5株针对 HA阳性的克隆,经NcoI/NotI双酶切,克隆入携带人源 Fc段的表达载体 pCMV-hIgG1-Fc-XP,转染 293T细胞,实现 scFv-Fc抗体的分泌型表达,分别命名为AVFluscFv/Fc01、AVFluscFv/Fc02、 AVFluscFv/Fc03、 AVFluscFv/Fc04、AVFluscFv/Fc05,分泌表达载体的模式图如图2所示。转染的293T细胞用FITC-抗人Fc抗体检测,观察到阳性荧光反应,表明 H5N1禽流感scFv-Fc抗体在293T细胞中得到完整表达,见图2。
2.4 人源抗 H5N1禽流感病毒scFv-Fc抗体的结合特性 (ELISA检测) 为了证明所获得的重组抗体以 scFv-Fc融合抗体形式分泌表达后也能对H5N1禽流感病毒颗粒(A/Anhui/1/2005)及其HA抗原有特异性结合,我们将scFv-Fc重组质粒转染293T细胞,收获的表达上清,并利用 ELISA进行检测。结果表明,最后获得 5株scFv-Fc抗体能够稳定而且特异性结合 H5N1禽流感病毒颗粒(A/Anhui/1/2005)及其 HA抗原,而与无关抗原BSA无交叉反应,结果见图3。
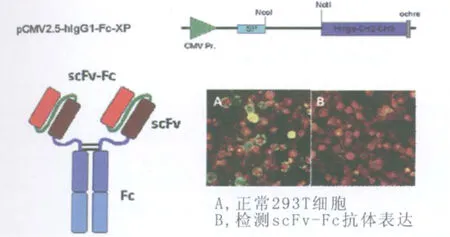
图2 免疫荧光检测人源抗 H5N1禽流感病毒 scFv-Fc抗体的表达Fig.2 IFA detecting expression of scFv-Fc antibodyagainst avian influenza A(H5N1)virusA:Using FITC conjugated anti-human Fc to detect the anti-H5N1 scFv-Fc antibody;B: Normal 293T cells

图3 ELISA检测人源抗 H5N1禽流感病毒scFv-Fc抗体的结合特性Fig.3 ELISA test detecting binding of 5 scFv-Fc antibodies with H5N1 virus and HA
2.5 人源抗 H5N1禽流感病毒 scFv-Fc抗体的结合特性 (IFA鉴定) 为了证实所获得的重组scFv-Fc融合抗体对禽流感病毒 H5N1的结合特异性,我们进一步通过间接免疫荧光试验(IFA)鉴定真核表达 scFv-Fc融合抗体的功能活性。结果表明,5株人源 scFv-Fc抗体(AVFluscFv/Fc01、AVFluscFv/Fc02、 AVFluscFv/Fc03、 AVFluscFv/Fc04、AVFluscFv/Fc05)与安徽株禽流感病毒 (A/Anhui/1/2005)及其重组 HA免疫荧光均为阳性,与甲1型人流感病毒A/Hubeihs/53/2005(H1N1)及甲3型人流感病毒 A/Yunnan/1145/2005(H3N2)免疫荧光均为阴性,如图3所示AVFluscFv/Fc01免疫荧光结果,其余4株抗体免疫荧光结果与AVFluscFv/Fc01相同。免疫荧光结果证明从抗体库筛选获得的阳性克隆均针对 H5N1禽流感病毒血凝素蛋白 HA,而与甲1型和甲3型人流感病毒无交叉反应的人源单抗。

图4 抗禽流感病毒 H5N1人源scFv-Fc抗体与禽流感病毒 H5N1及其重组 HA以及流感病毒 H1N1、H3N2的免疫荧光反应Fig.4 Immunofluorescence assay analysis of human scFv-Fc antibody binding activities to H5N1,H1N1 and H3N2 viruses and the recombinant expressed HA of the H5N1 virus
3 讨 论
本研究采用噬菌体表面展示技术,以 H5N1禽流感病毒安徽株HA为抗原,从人源大容量天然抗体库中筛选抗 HA的基因工程抗体。筛选中所投入抗体库为人源大容量天然抗体库,其构建参见文献[8],该抗体库来源于44个健康人淋巴细胞,容量为5×109,抗体库利用高效噬菌体 Hyperphage包装[9],大大提高了重组抗体在噬菌体表面展示的效率,进而提高了后续阳性克隆的筛选效率。本研究获得的82株特异性结合 H5N1禽流感病毒 HA的人源 scFv单克隆抗体中,分别属于 5个不同的抗体序列,即共发现5株带有不同的抗体轻重链可变区序列及其组合的抗体,其重链可变区分类在 IgG VH1和 VH3家族,其轻链可变区分类在 IgG VL1和VL6家族。
抗体在体内的作用是一个综合作用,一方面是通过和病毒的结合阻碍病毒的传播,另一方面,Fc段是抗体分子发挥功能的重要元件,包括抗体介导的细胞毒性作用和补体介导的细胞裂解作用。这些作用依靠全抗体分子中的Fc片段的存在,所以我们将5株人源单链抗体scFv基因克隆入携带人源Fc段的表达载体,实现scFv-Fc融合抗体的分泌型表达,短时间内完善了抗体功能及下游检测方面的需求。为了证实所获得的重组scFv-Fc融合抗体对禽流感病毒 H5N1的结合特异性,我们选择了较为典型 H1、H3、H5三种流感病毒株以及 H5亚型重组表达的血凝素 HA抗原与筛选获得的人源单抗进行免疫荧光检测,结果显示从抗体库筛选获得的5株人源单抗与禽流感病毒 H5N1及其 HA具有较好的特异性,而与甲1型和甲3型人流感病毒无交叉反应。
天然大容量抗体库,是一种不经过免疫就能获得针对某种抗原的基因工程抗体的技术[1],可以分离到针对自身抗原、无免疫原性或毒性抗原的抗体;抗体产生时间短,在库容量足够大的时候可以获得高亲和力抗体。本研究从人源大容量天然抗体库中利用高通量的筛选策略在短时间内成功获得了抗禽流感病毒 H5N1人源单抗,因此非免疫抗体库尤其是天然抗体库成为快速获得突发新发传染病治疗或诊断用抗体的应急储备库。目前我们已经获得了抗H5N1禽流感病毒scFv基因所对应的全抗体基因,体外的中和试验及其 HA抗原表位方面的鉴定也在进行当中。
[1]Lee CV,Liang WC,Dennis MS,et al.High-affinity human antibodies from phage-displayed synthetic Fab libraries with a single framework scaffold [J].J Mol Biol,2004,340(5):1073-1093.
[2]Aujame L,Geoffroy F,Sodoyer.High affinity human antibodies by phage display[J].Human Antibody,1997,8:155-168.
[3]de Haard HJ,Van Neer N,Reurs A,et al.A large non-immunized human Fab fragment phage library that permits rapid isolation and kinetic analysis of high affinity antibodies[J].J Biol Chem,1999,274:18218-18230.
[4]Wiley D C,Skehel J J.The structure and function of the hemagglutinin membrane glycoprotein of influenza virus[J].Annu Rev Biochem,1987,56:365-394.
[5]Skehel J J,Wiley D C.Receptor binding and membrane fusion in virus entry:the influenza hemagglutinin[J].Annu Rev Biochem,2000,69:531-569.
[6]Simmons P C,Bernasconi N L,Suguitan AL,et al.Prophylactic and therapeutic efficacy of human monoclonal antibodies against H5N1 influenza[J].Plos Med,2007,4(5):0928-0936.
[7]Hanson B J,Boon A C,Lim AP,et al.Passive immunoprophylaxis and therapy with humanized monoclonal antibody specific for influenza A H5 hemagglutinin in mice[J].Respir Res,2006,7:126-127.
[8]Hust M,Toleikis L,Du bel S.Antibody phage display.Handbook of therapeutic antibodies[M].Weinheim:Wiley-VCH,2007:45-68.
[9]Pelat T,Hust M,Laffly E,et al.A high affinity,human like antibody fragment(scFv)neutralising lethal factor(LF)of Bacillus anthracis by inhibiting the PA-LF complex formation[J].Antimicro Agents Chem,2007,51:2758-2764.
[10]Thomas Schirrmann,Konrad B S.Transient Production of scFv-Fc Fusion Proteins in Mammalian Cells.Antibody Engineering[M].2010,Part III,387-398.
[11]孙丽娜,刘琴芝,王敏,等.人源中和性抗高致病性禽流感病毒H5N1基因工程全抗体的研制 [J].病毒学报,2008,24(3):165-171.
[12]Hust M,Dübel S,Schirrmann T.Selection of recombinant antibodies from antibody gene libraries[J].Methods Mol Biol,2007,408:243-255.

