结核分枝杆菌蛋白 Hsp16.3的基因克隆以及表达*
田绿波,罗垲炜,陈肖潇,吕 冰,樊学军,张 洋,万康林
结核病是一种由于结核分枝杆菌感染而引起的慢性疾病。在发展中国家,由于多耐药结核菌株的出现和增多、艾滋病毒感染的传播以及人口流动性增强等因素的存在,结核病已经成为主要的传染病之一[1-2]。据世界卫生组织最新的调查报告显示,全球约有1/3即20亿人口患有结核病,每年新增病人约900万,年死亡人数近300万,死亡率已经超过了大部分癌症病人[2]。我国的情况也不容乐观,结核病人数仅次于印度,每年新增病人约130万,每年死亡人数约20万[3]。新型疫苗的开发、快速廉价并且可靠的诊断方法以及更有效的抗结核药物的研制等再度成为研究的热点。
Hspl6.3是由结核分枝杆菌(M.tuberculosis,MTB)hsp X基因(Rv2031C、acr)编码的蛋白,最初被认为是免疫显性抗原,后来被确认是一个重要的膜抗原,它的表达与MTB的休眠密切相关[4]。我们利用结核分枝杆菌标准株 H37Rv为模板,通过基因工程方法克隆表达了 Hsp16.3抗原,为下一步深入研究该蛋白的生物学、免疫学活性奠定了基础。
1 材料与方法
1.1 菌种和载体 结核分枝杆菌 H37Rv基因组DNA、大肠杆菌BL21(DE3)、表达载体pET30a均为本室保存。
1.2 试剂 限制性内切酶、T4 DNA连接酶、IPTG购自Takara公司。Taq酶、质粒提取试剂盒购自Tiangen公司。His-Tag纯化试剂盒购自 GE公司。
1.3 引物设计 根据3个抗原基因的序列设计了上下游引物,限制性内切酶分别为B glⅡ(A GATCT)和HindⅢ(AAGCTT),所有的引物均由上海生工公司合成。序列如下:
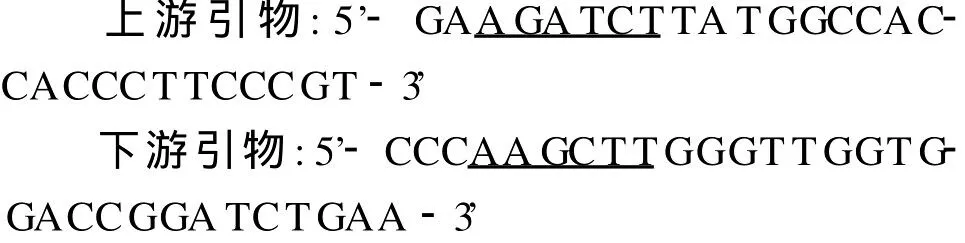
1.4 目的基因的扩增与克隆 以结核分枝杆菌H37Rv基因组DNA为模板扩增。反应条件:94℃10min,94℃lmin,57℃1min,72℃1min,反应 3O个循环,72℃10min。扩增产物经纯化试剂盒处理后,经内切酶双酶切(B glⅡ,HindIII),酶切后扩增产物经切胶回收与同样方式处理的表达质粒pET30a在 T4 DNA连接酶作用下连接,连接产物转化入大肠杆菌BL21(DE3)感受态细胞,挑选阳性重组子送北京天根公司测序。
1.5 目的蛋白的诱导表达 将测序验证正确的重组子接种于含50μg/mL卡那霉素的LB液体培养基中,待37℃振荡培养至OD600为0.6~0.8,加入β-硫代半乳糖苷(IPTG)至终浓度为1mmol/L,继续在37℃条件下振荡培养,诱导表达 3~4h收集菌体;
1.6 SDS-PAGE蛋白鉴定 利用上步得到的菌体沉淀,用 2×凝胶加样缓冲液 50μL悬浮,煮沸5min,取 10μL进行 12%聚丙烯酰胺凝胶电泳(SDS-PA GE)鉴定。
2 结 果
2.1 目的基因的扩增与克隆 pET30重组质粒的构建图,见图1。将挑选的阳性重组子送天根公司测序,对构建的重组质粒pET30a-Hsp16.3测序后,通过互联网登陆 GenBank(http://www.ncbi.nlm.nih.gov/)后,用BLAST将测序结果与结核分枝杆菌 H37Rv菌株上编码 Hsp16.3蛋白的基因序列进行比对,结果显示两者的序列相符率为99.9%,仅在第39位上的碱基 T突变为C;进一步的蛋白比对结果显示相符率为99%,仅为测序起始氨基酸处的M测得为L,可能是由于碱基突变引起的。
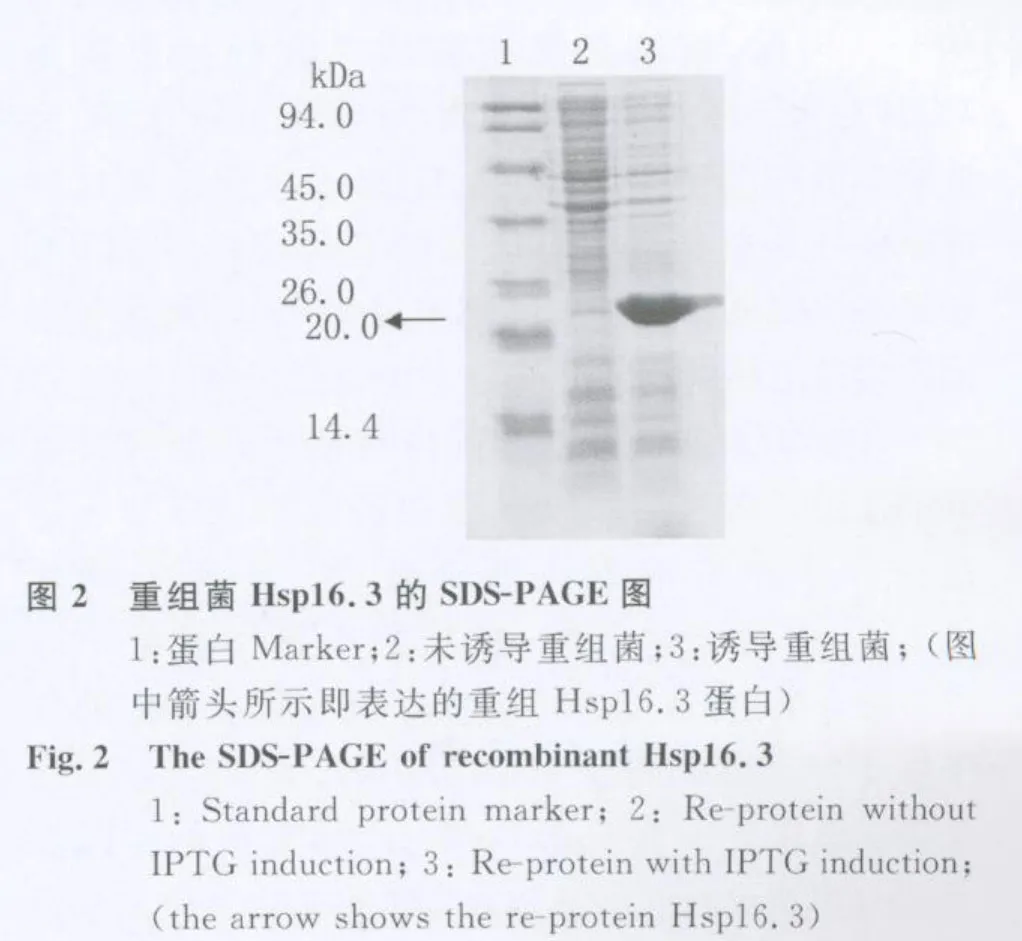
2.2 目的基因表达产物的SDS-PA GE检测 取重组菌诱导前后的表达产物进行SDS-PAGE,结果发现诱导的重组菌约在22kDa左右一明显表达蛋白带与目标大小相吻合,而未诱导菌无此条带,见图2。

3 讨 论
MTB与宿主之间的相互作用十分复杂[5],目前具体机制并不是很明确。据文献报道MTB进入机体后通过调节自身的基因表达去适应宿主的免疫反应,以保证MTB在机体内的存活和生长。Yuan等人将编码 Hsp16.3的质粒导入 H37Rv中,由于Hsp16.3的高效表达影响了重组菌的生长速率,尽管其对数期A650最大值低于对照组 H37Rv,但是维持该峰值达5d之久,且平台期生长速率降低缓慢,而对照组A650峰值维持时间短,下降快,在5d时仅为最大值的30%[6]。重组的 H37Rv细菌在平板中培养8~10w时只形成很小的克隆,但是这些克隆可以存活10w之久,说明Hsp16.3的有效表达可以大大提高结核分枝杆菌的生存能力[7]。
Hsp16.3能诱导特异性的免疫反应,具有人和鼠的 T淋巴细胞表位,是有效的亚单位疫苗的靶抗原[8]。Hsp16.3的p91-pll0多肽能部分活化结核菌素纯蛋白衍生物试验(PPD)阳性机体的外周血单核细胞和CD4阳性T淋巴细胞,诱导 Thl型细胞免疫应答,分泌干扰素,有效清除感染的MTB[9-10];同时CD8阳性 T淋巴细胞可以识别 Hsp16.3的p21-p29和p120-p128两个多肽表位,活化的 CD8阳性T淋巴诱导产生γ干扰素和α干扰素,通过表位穿孔素和粒细胞溶解素溶解感染了MTB的巨噬细胞。因此,对 Hsp16.3生物学特征的深入研究可以为结核新型疫苗的研究提供可靠依据[11-12],特别是对隐性感染者可能起到预防作用。现有的结核病疫苗可以有效抑制早期MTB的增殖,但是感染后期MTB又开始在肺部进行性生长,导致组织损伤或者死亡,人类的结核病病例大部分是这种复发性病例[13]。因此,新型结核病疫苗含有的抗原应是MTB在宿主体内长期存在时(休眠期或潜伏期)大量聚集的靶分子[14-15],例如 Hsp16.3,理论上这种抗原诱导的免疫反应可能抑制潜伏状态的MTB。如果将该抗原作为疫苗的靶抗原应用,可能会对潜伏性感染结核病的发生有一定的预防作用。
Hsp16.3蛋白对结核的疫苗或诊断研究有重要的作用。而对 Hsp16.3蛋白的成功克隆和表达是进一步研究的起点和突破口。本研究利用pET30a作为表达质粒,成功的构建了重组 Hsp 16.3融合蛋白,通过SDS-PAGE证实融合蛋白的分子量约为22kDa,符合 Hsp16.3分子量16.3kDa加上表达载体分子量5.4kDa的总和,蛋白的实际表达值与理论预测值相符。本实验的成功为进一步研究Hsp16.3的免疫学特性和结核疫苗奠定了基础。
[1]Sharma S K,Mohan A,Kadhiravan T.HIV-TB co-infection:epidemiology,diagnosis&management[J].Indian J Med Res,2005,121(4):550-567.
[2]WHO.Global Tuberculosis Control Surveillance,Plannning,Financing.WHO Report 2008,2008.
[3]全国结核病流行病学抽样调查技术指导组.第四次全国结核病流行病学抽样调查报告[J].中华结核和呼吸杂志,2002.25(2):3-7.
[4]Fu X,Liu C,Liu Y,et al.Small heat shock protein Hsp16.3 modulates its chaperone activity by adjusting the rate of oligomeric dissociation[J].Biochem Biophys Res Commun,2003.310(2):412-420.
[5]Florczyk MA,McCue LA,Purkayastha A,et al.A family of acr-coregulated Mycobacterium tuberculosis genes shares a common DNA motif and requires Rv3133c(dosR or devR)for expression[J].Infect Immun,2003.71(9):5332-5343.
[6]Yuan Y,Crane DD,Simpson RM,et al.The 16-kDa alpha-crystallin(Acr)protein of Mycobacterium tuberculosis is required for growth in macrophages[J].Proc Natl Acad Sci U S A,1998.95(16):9578-9583.
[7]Starck J,Kallenius G,Marklund BI,et al.Comparative proteome analysis ofMycobacterium tuberculosisgrown under aerobic and anaerobic conditions[J].Microbiology,2004.150(Pt 11):3821-3829.
[8]Fu X,Chang Z,Temperature-dependent subunit exchange and chaperone-like activities of Hsp16.3,a small heat shock protein fromMycobacterium tuberculosis[J].Biochem Biophys Res Commun,2004.316(2):291-299.
[9]Caccamo N,Meraviglia S,Mendola CL,et al,Characterization of HLA-DR-and TCR-binding residues of an immunodominant and genetically permissive peptide of the 16-kDa protein ofMycobacterium tuberculosis[J].Eur J Immunol,2004.34(8):2220-2229.
[10]Bösze S,Caccamo N,Majer Z,et al.In vitro T-cell immunogenicity of oligopeptides derived from the region 92-110 of the 16-kDa protein ofMycobacterium tuberculosis[J].Biopolymers,2004.76(6):467-476.
[11]Khera A,Singh R,Shakila H,et al,Elicitation of efficient,protective immune responses by using DNA vaccines against tuberculosis[J].Vaccine,2005.23(48-49):5655-5665.
[12]Demissie A,Leyten E,Abebe M,et al.Recognition of stagespecific mycobacterial antigens differentiates between acute and latent infections withMycobacterium tuberculosis[J].Clin Vaccine Immunol,2006.13(2):179-186.
[13]Hoft DF.Tuberculosis vaccine development:goals,immunological design,and evaluation[J].Lancet,2008,372(9633):164-175.
[14]Cardona PJ,Ausina V.Delayed-type hypersensitivity and caseous necrosis in tuberculous granuloma.New ideas for the design of a new vaccine against human tuberculosis[J].Med Clin(Barc),2000.115(13):503-509.
[15]Franco-Paredes C,Rouphael N,del Rio C,et al.Vaccination strategies to prevent tuberculosis in the new millennium:from BCG to new vaccine candidates[J].Int J Infect Dis,2006,10(2):93-102.

