口蹄疫病毒非结构蛋白3Dpol的研究进展*
孙静静,邵军军,常惠芸
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV)引起的偶蹄动物的一种急性、热性、高度接触性传染病。FMD是OIE规定的A类动物疫病之一,严重影响畜牧业的发展,对世界公共卫生存在着巨大影响,造成巨大的经济损失,素有“政治经济病”之称。FMD的致病原是小RNA病毒科,口蹄疫病毒属成员,于1897年首次确定。FMDV是正链RNA分子,长约8 500bp,包裹于由60个拷贝的4种病毒结构蛋白VP1-4构成的二十面体的衣壳中。FMDV不仅宿主广泛,传播速度快,变异性强,而且血清型多,有7个血清型O、A、C、Asia 1、SAT 1、SAT 2、SAT 3和70多个亚型,且各血清型间无交叉免疫,同一血清型内的不同亚型或分离株发生交叉免疫的程度均不相同,这种特性给口蹄疫的诊断和疫苗免疫带来极大的困难。
FMDV的3Dpol蛋白是RNA依赖的RNA聚合酶(RdRp),没有型特异性,在FMDV所有非结构蛋白中,3Dpol抗原性最好,ELISA检测方法的特异性、准确性和敏感性与检测结构蛋白的ELISA方法相当的,是区分是否接触过FMDV动物的重要指标。FMDV的复制也是由病毒编码的聚合酶3Dpol催化,但3Dpol蛋白酶的保真性很差,导致病毒复制的错误倾向率很高,每个核苷酸复制的错误配对率为10-3~10-5,这种低的复制保真性导致了后代快速突变,因此口蹄疫的防控比较困难。3Dpol是非结构蛋白,只是在病毒的复制过程中出现,病毒粒子成熟后仅仅有非常少量的3Dpol。本文综述了口蹄疫病毒基因组结构及3D基因,3Dpol蛋白的表位、结构、功能的国内外最新研究进展。
1 FMDV基因组结构
FMDV基因组为单股正链RNA,既是mRNA,又是负链RNA的模板,约有8 500个核苷酸(nts)组成,基因组的基本结构是:VPg-5′UTR(S-polyCIRES)-(L 蛋 白 )-结 构 蛋 白 P1(VP4-VP2-VP3-VP1)-非 结 构 蛋 白 (2A-2B-2C-3A-3B-3B-3B-3C-3D)-3′UTR-poly(A)。
VPg在病毒RNA开始复制时起重要作用,同时参与病毒装配,只有病毒RNA与VPg结合后,才能够被装入病毒。5′-UTR约含1 300个碱基。S片段由360个碱基组成,可形成一个长茎环结构(stem-loop)。S片断下游是约400bp的 Poly(C)序列。Poly(C)片段几乎全部由胞嘧啶组成,约占90%,仅有少量的U与A。IRES长约1 350bp,控制不依赖于帽子结构的FMDV RNA的翻译起始。下游3′-UTR序列可自身折叠成茎环结构,对病毒基因组的复制有重要作用,复制过程中3′-UTR可以结合病毒复制相关蛋白。3′-UTR下游是长度不一的poly(A)结构,Poly(A)尾与病毒的感染性有关,Poly(A)越长感染性越强。基因组的中部是一大的开放阅读框(ORF),编码一多聚蛋白。基因组的ORF分为4个区域,分别为L区、P1区、P2区、P3区。多聚蛋白的裂解过程是由三种蛋白酶:Lpro,2A和3C来完成的,多聚蛋白经3级裂解后,形成3~4种病毒结构蛋白(VP0或 VP4、VP2,VP3,VP1)和8~9种非结构蛋白(Lab、Lb、2A、2B、2C、3A、3B、3C和3D)。ORF的5′末端为 L区,长约600bp,主要编码N末端多聚蛋白Lab和Lb,两种蛋白作为酶能在L/P1连接处进行自我切割释放。L区的下游为P1区,P1区全长约2 200bp,编码FMDV的4种结构蛋白VP4、VP2、VP3和VP1,分别由85、218、220个和213个氨基酸组成。P1区的下游为P2区,约1 460bp,编码2A、2B和2C3种非结构蛋白,分别由16、154和318个氨基酸组成。P2区的下游为P3区,长约2 720bp,编码约908个氨基酸的聚合蛋白,该聚合蛋白含有3A、3个3B、3C和3Dpol6种多肽。
2 3Dpol抗原表位的研究
FMDV的免疫保护与中和抗体水平和亲和力有关,研究发现针对B细胞表位的合成肽免疫原性低,不能产生持久的保护水平的中和抗体。Collen等[2]的研究认为机体抗口蹄疫病毒是一种依赖T细胞的体液免疫应答反应,抗体的产生需要T细胞参与。迄今为止,除了在结构蛋白区发现部分T细胞表位外,越来越多的研究显示,T细胞表位主要分布在FMDV非结构蛋白(3ABC和3Dpol)上。国内外有关3Dpol蛋白T细胞表位的研究主要有:Collen[3]等在研究FMDV相关T细胞表位时发现,FMDV的非结构蛋白3Dpol具有刺激病毒感染牛外周血淋巴细胞增殖的能力,由此推测3Dpol上存在潜在的T淋巴细胞表位。Blanco等[4]发现,T细胞辅助表位区与B细胞表位区的串联可以协助B细胞产生特异性抗体,提高优势抗原表位区的免疫原性。García-Briones等[5]用 表 达 FMDV 非 结 构 蛋 白3Dpol的痘苗病毒免疫猪,即使在猪体内检测不到中和抗体的情况下也能得到部分保护,这些猪在受到FMDV攻击时出现典型临床症状缓慢,结果与上述Collen等的推测基本一致。另外利用针对3Dpol氨基酸序列人工化学合成的重叠肽段对FMDV感染猪的外周血淋巴细胞进行刺激,结果发现很多肽段都能够有效刺激淋巴细胞增殖,而且这些淋巴细胞能够大量分泌IFN-γ等Th1类细胞因子。这一方面在一定程度上解释了3Dpol蛋白能够在无中和抗体条件下给动物提供部分保护的现象;另一方面也使人们进一步了解到3Dpol蛋白用于新型疫苗研究的潜在价值。WilhelmGerner等[6]在c/c和d/d单体型微型猪内发现了口蹄疫3Dpol非结构蛋白上被SLA识别的特异的T细胞表位,位于346-370位氨基酸,这为口蹄疫新型疫苗的设计提供了有用的信息。不同种属宿主和不同个体的T细胞对T细胞表位的识别是受到机体MHC分子多态性的限制的,3Dpol蛋白作为不同血清型及不同毒株之间相对保守的功能蛋白,极可能存在保守的病毒T细胞表位,能够被不同的宿主及个体T细胞所识别。
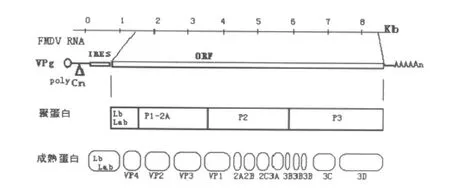
图1 口蹄疫病毒基因组结构和成熟蛋白[1]Fig.1 FMDV genome structure and matured protein[1]
3 3Dpol的表达时相及结构
3Dpol蛋白在病毒复制的早期产生。García-Briones等[7]研究了 FMDV 在 BHK-21细胞中的分布,免疫荧光试验发现在感染后1.5h首先检测到非结构蛋白3Dpol,之后2~2.5h才检测到其他的非结构蛋白2B、2C、3B、3C,他们均以间歇分散的模式出现,3A和3Dpol集中在核的一侧。经共聚焦显微镜发现,虽然3Dpol短暂表达,但其在细胞核包括核仁中分布均匀,这与转染3AB的细胞一致。在感染细胞中还发现3Dpol和其前体3CD,表明在FMDV感染时,这些蛋白可以同细胞核直接作用。
FMDV 3Dpol约有470个氨基酸残基,形成典型的右手结构,与其它的聚合酶的三维结构一样,有典型的手指、手掌和拇指亚结构。在 NH2末端(1-96位氨基酸)连接手指和拇指结构亚域的片段包围着酶的活性位点,这个区域又称为指套,与其他属病毒的聚合酶相比,这是FMDV 3Dpol特有的。手指和手掌亚结构域包含6个不同的模体:A、B、C、D、E和F。手指亚结构域(97-207位和249-302位)包含8个α螺旋 (α3-α9)和7个β折叠 (β3-β7和β9-β10);手掌亚结构域 (230-248位和303-403位)包含2个螺旋(α11,α12),5个β折叠片(β8,β11,β12,β14,β15),有3个β折叠片(β8,β11,β12)位于α11 和α12之间,这段区域是所有聚合酶中最保守的区域[8],由5个保守模体A-E组成,在核苷酸结合、磷酰基转移、手掌亚结构域的完整性和引导核苷酸结合方面发挥重要作用。拇指亚结构域(403-470位)包含4个α螺旋 (α13-α16)和2个卷曲[9]。
4 3Dpol的功能
FMDV 3Dpol首先以基因组正链为模板合成互补的负链RNA,然后再以负链为模板合成子代病毒的基因组的正链RNA。研究表明正链RNA病毒的复制有2种方式:引物依赖的RNA合成和引物非依赖的RNA合成即从头合成。FMDV RNA合成是以VPg为引物的引物依赖的合成方式。之前研究已经阐明了PV、FMDV和HRVs的RdRps的三维结晶结构,要么是非结合蛋白,要么是形成引物-模板-NTP底物复合物[11-12]。正链和负链 RNA合成的第一步是形成VPg-pU(带有一个UMP的VPg同酪氨酸Tyr3共价结合),之后发生尿苷化,紧接着进行引物延伸。CV-B3RdRp采用了一个典型的RdRp折叠方式,与其它聚合酶一样,RdRp亚结构域中最保守的是起催化作用的拇指结构域,2个天冬氨酸和2个二价的金属离子都是催化作用必须的[13]。FMDV 3Dpol与 VPg结合位点和 CV-B3 RdRp与VPg结合位点不同,在FMDV 3Dpol与VPg残 基 1-GPYAGPLERQPRPLKV-15 结 合,但 是CVB3 3Dpol-VPg 复 杂 结 构 表 明,VPg 7-PNQKPRVPT-15位残基与3Dpol拇指结构域的底部结合。其实早在研究PV RdRp时,通过一系列的遗传学和生物学实验已经证明了第2个结合位点的存在,并且通过结构验证了其准确性[14-15]。3Dpol催化的FMDV RNA复制机制如下:
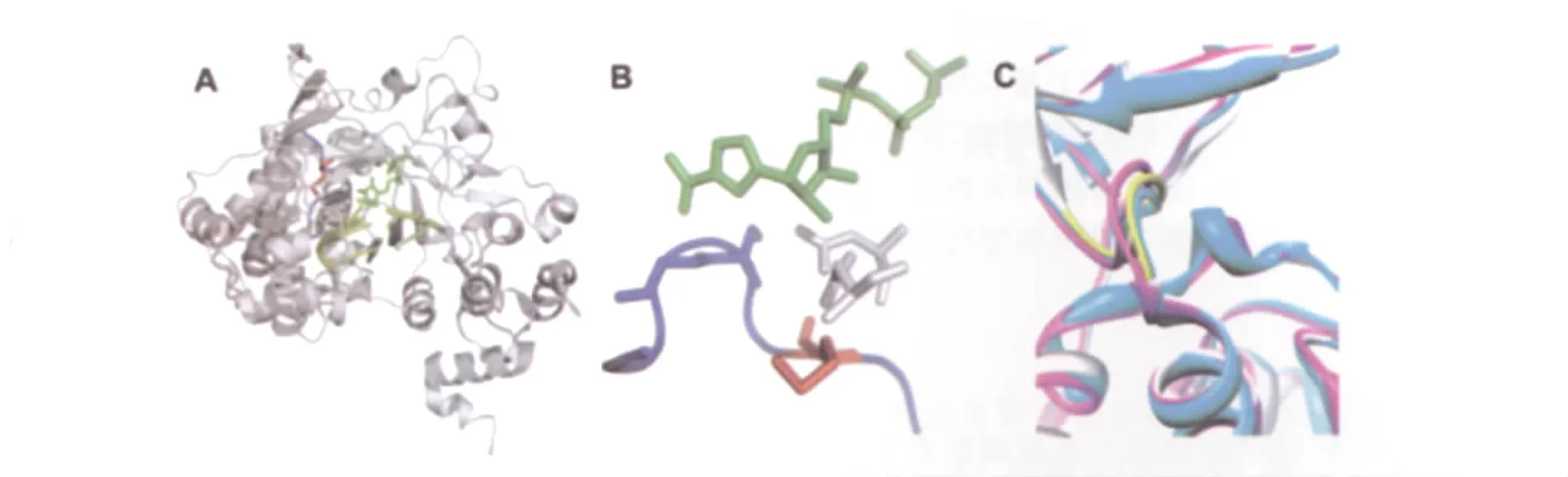
图2 FMDV 3Dpol-RNA-RTP结晶结构[10]A:3Dpol与引物模板结合;B:3Dpol骨干;C:不同FMDV的3Dpol结构重叠Fig.2 FMDV 3Dpolcrystal structureA:3Dpol-template-pmimer molecular;B:3Dpol bone,C:superimposition of different FMDV 3Dpol
4.1 FMDV引物依赖性的复制起始 在RNA复制的起始,RdRp与病毒和宿主的许多蛋白相互作用。在小RNA病毒科中,3DPol使病毒编码的引物蛋白VPg尿苷化,从而引发复制的起始[16]。3DPol和VPg 2个复合物的结构及其定点突变的效应分析,揭示了位于3DpolPol活性位点的残基不仅参与与VPg结合,而且与RNA合成起始的VPg尿苷化反应密切相关[17]。
VPg采用几乎不具二级结构的完全伸展的构相,结合在3DPol聚合酶的中心槽,VPg的N末端部分位于NTP通道附近,使突出的第3位Tyr残基的侧链深入活性位点区域,之后VPg滑行穿过大的RNA结合位点到达拇指结构域[18]。手指、手掌、拇指结构域的保守残基对于VPg的结合稳定性有重要作用。在3DPol-VPg-UMP复合物中,Tyr3侧链的-OH与UMP分子的α-磷酸共价结合,模体F带正电的残基参与尿苷化反应,使Tyr3和UMP稳定在一个合适的构象。模体A和C的天冬氨酸(Asp)及2个二价的阳离子也参与尿苷化反应,其机制与其它聚合酶催化的核苷酸酸转移反应相似[19]。已有研究表明,在RNA复制起始和延伸过程中3Dpol聚合酶的结构不同。依据FMDV VPg的结构,复制起始时FMDV 3DPol模体B的保守残基的307位天冬酰胺与尿苷化复合物的3′-OH作用,但 在 延 伸 过 程 中 是 2′-OH[20]。 氟 尿 苷 三 磷 酸(FUTP)是 VPg尿苷化的抑制剂,但不能抑制延伸。
PV蛋白酶和聚合酶前导蛋白3CD的结晶结构也完全支持FMDV的尿苷化模型,在3CD分子与VPg结合位点之间存在有大量接触面,同样FMDV 3Dpol-VPg复合物中3Dpol与VPg所形成的接触界面,在病毒复制起始促进和调节VPg尿苷酰化方面发挥重要作用[21]。
4.2 FMDV 3DPol引发的引物模板识别和链的延伸 有序的核苷酸转移反应是RNA延伸的基础。核苷酸转移反应是引物链的3′-OH亲核进攻核苷三磷酸的α-磷酸,从而形成磷酸二酯键,释放PPi。根据两个金属离子催化模型,金属离子A会降低引物3′-OH的pKa,从而引发去质子化;金属离子B确定进入的核苷酸的方向,在PPi从聚合酶上释放之前将其质子化[22]。但最近的另一项研究表明,不同的聚合酶催化的核苷酸延伸过程中的突变分析和动力学分析,PPi的质子供体是位于酶活性位点的带正电的氨基酸残基[23]。
正链RNA病毒的聚合酶的保守氨基酸残基位于结合槽内,是同核苷酸底物相互作用的优势候选物,如模体A和C上的两个天冬氨酸(第245位Asp和第338位Asp),还包模体B上的保守残基第303位 Thr,第304位Ser和第307位 Asn[24]。在自然底物ATP和UTP存在时,或有诱变剂如FUTP和利巴韦林三磷酸(RTP)存在时,得到4种FMDV 3DPol的催化反应复合物,由此发现RNA延伸过程可以分为4步[25]:第1步,3DPol-RNA-RTP复合物表明抗病毒诱变剂占据聚合酶的活性位点,与发生磷酰基转移反应的位点相同;第2步,3DPol-RNA-ATP复合物表明形成新的碱基对,RNA产物易位,PPi释放;第3步,3DPol-RNA-ATP/UTP 复合物表明RNA产物易位,新的底物定位到活性位点附近;第4步,3DPol-RNA-FUTP复合物表明突变核苷酸类似物FUTP与新生RNA结合,释放PPi。4种复合物的比较表明,位于模板和引物核苷酸的结合位置的聚合酶残基,参与识别和定位新的参与延伸反应的核苷酸。
5 结 语
有关FMDV 3Dpol结构和功能的研究有了一定的进展,但仍有许多未知。FMDV 3Dpol是非常保守的非结构蛋白,在病毒的复制和转录过程中发挥重要作用,也是非常有效的抗病毒靶标。现在也发现针对结构蛋白和结构蛋白2C、3A、3C的抑制剂,相信随着科技的发展,一定会发现更多的抗FMDV复合物,从而为有效的控制此严重危害畜牧业发展的传染性疾病做出贡献。
[1]谢庆阁.口蹄疫[M].北京:中国农业出版社,2004:21.
[2]Collen T,Pullen L,Doel TR.T cell-dependent induction of antibody against foot-and-mouth disease virus in a mouse model[J].Journal of General Virology,1989,70(2):395-403.
[3]Collen T,Baron J,Childerstone A,et al.Heterotypic recognition of recombinant FMDV proteins by bovine T-cells:the polymerase(P3Dpol)as an immunodominant T-cell immunogen[J].Virus Res,1998,56(2):125-133.
[4]Blanco E,Garcia-Briones M,Sanz-Parra A,et al.Identification of T-cellepitopes in nonstructural proteins of foot-and-mouth disease virus[J].J Virol,2001,75(7):3164-3174.
[5]Garcia-Briones MM,Blanco E,Chiva C,et al.Immunogenicity and T cell recognition in swine of foot-and-mouthdisease virus polymerase 3Dpol[J].Virolog,2004,322(2),264-275.
[6]Gerner W,Denyer MS,Takamatsu HH,et al.Identification of novel foot-and-mouth disease virus specific T-cell epitopes in c/c and d/d haplotype miniature swine[J].Virus Research,2006,121(2):223-228.
[7]Garc a-Briones M,Rosas MF,Gonz lez-Magaldi M,et al.Differential distribution of non-structural proteins of foot-and-mouth disease virus in BHK-21cells[J].Virology,2006,349(2):409-421.
[8]O'Reilly EK,Kao CC.Analysis of RNA-dependent RNA polymerase structure and function as guided by known polymerase structures and computer predictions of secondary structure[J].Virology,1998,252(2):287-303.
[9]Ferrer-Orta C,Arias A,Perez-Luque R,et al,Structure of Footand-Mouth Disease Virus RNA-dependent RNAPolymerase and Its Complex with a Template-Primer RNA[J].J Biol Chem,2004,279(45):47212-47221.
[10]Armando A,Jamie J,Macarena S,et al.Determinants of RNADependent RNA Polymerase(In)fidelity Revealed by Kinetic Analysis of the Polymerase Encoded by a Foot-and-Mouth Disease Virus Mutant with Reduced Sensitivity to Ribavirin[J].Journal Of Virology,2008,82(24):12346-12355.
[11]Ferrer-Orta C,Arias A,Agudo R,et al.The structure of a protein primer-polymerase complex in the initiation of genome replication[J].EMBO J,2006,25(4):880-888.
[12]Ferrer-Orta C,Arias A,Escarmis C,et al.A comparison of viral RNA-dependent RNA polymerases[J].Curr Opin Struct Biol,2006,16(1):27-34.
[13]Castro C,Smidansky ED,Arnold JJ,et al.Nucleic acid polymerases use a general acid for nucleotidyl transfer[J].Nat Struct Mol Biol,2009,16(2):212-218.
[14]Tellez AB,Crowder S,Spagnolo JF,et al.Nucleotide channel of RNA-dependent RNA polymerase used for intermolecular uridylylation of protein primer[J].J Mol Biol,2006,357(2):665-675.
[15]Gruez A,Selisko B,Roberts M,et al.The crystal structure of coxsackievirus B3RNA-dependent RNA polymerase in complex with its protein primer VPg confirms the existence of a second VPg binding site on Picornaviridae polymerases[J].J Virol,2008,82(19):9577-9590.
[16]Pathak HB,Oh HS,Goodfellow IG,et al.Picornavirus genome replication:roles of precursor proteins and rate-limiting steps in oriI-dependent VPg uridylylation[J].J Biol Chem,2008,283(45):30677-30688.
[17]Castro C,Smidansky E,Maksimchuk KR,et al.Two proton transfers in the transition state for nucleotidyl transfer catalyzed by RNA-and DNA-dependent RNA and DNA polymerases[J].Proc Natl Acad Sci,2007,104(11):4267-4272.
[18]Ferrer-Orta C,Arias A,Agudo R,et al.The structure of a protein primer-polymerase complex in the initiation of genome replication[J].EMBO J,2006,25(4):880-888.
[19]Steitz TA,Steitz JA.A general two-metal-ion mechanism for catalytic RNA [J].Proc Natl Acad Sci,1993,90(14):6498-6502.
[20]Korneeva VS,Cameron CE.Structure-function relationships of the viral RNA-dependent RNA polymerase:fidelity,replication speed,and initiation mechanism determined by a residue in the ribose-binding pocket[J].J Biol Chem,2007,282(22):16135-16145.
[21]Marcotte LL,Wass AB,Gohara DW,et al.Crystal structure of poliovirus 3CD protein:virally encoded protease and precursor to the RNA-dependent RNA polymerase[J].J Virol,2007,81(7):3583-3596.
[22]Castro C,Smidansky E,Maksimchuk KR,et al.Two proton transfers in the transition state for nucleotidyl transfer catalyzed by RNA-and DNA-dependent RNA and DNA polymerases[J].Proc Natl Acad Sci,2007,104(11):4267-4272.
[23]Castro C,Smidansky ED,Arnold JJ,et al.Nucleic acid polymerases use a general acid for nucleotidyl transfer[J].Nat Struct Mol Biol,2009,16(2):212-218.
[24]Hansen JL,Long AM,Schultz SC.Structure of the RNA-dependent RNA polymerase of poliovirus[J].Structure,1997,5(8):1109-1122.
[25]Ferrer-Orta C,Arias A,Perez-Luque R,et al.Sequential structures provide insights into the fidelity of RNA replication[J].Proc Natl Acad Sci,2007,104(22):9463-9468.

