维氏气单胞菌吉林分离株外膜蛋白AⅡ基因的克隆及生物信息学分析*
单晓枫,吴同垒,孟庆峰,王伟利,钱爱东
维氏气单胞菌吉林分离株外膜蛋白AⅡ基因的克隆及生物信息学分析*
单晓枫1,吴同垒1,孟庆峰2,王伟利2,钱爱东1
目的 克隆维氏气单胞菌(Aeromonas veronii,AV)吉林株外膜蛋白AⅡ(OMPAⅡ)基因,并对其编码蛋白进行生物信息学分析。方法根据维氏气单胞菌已知OMPAⅡ基因序列设计合成一对引物,通过PCR技术扩增OMPAⅡ基因,并将其克隆到p MD18-T载体上,阳性重组质粒经PCR鉴定后进行序列测定,通过Blast N分析维氏气单胞菌OMPAⅡ基因序列与其他菌种OMPAⅡ序列同源性,并构建系统进化树,同时对维氏气单胞菌OMPAⅡ蛋白进行生物信息学分析。结果克隆基因长1 001 bp,与GenBank报道的基因序列同源性为95%,生物信息学软件分析OMPAⅡ蛋白无跨膜区,其N端含有1个信号肽,二级结构以β折叠和β转角为主,有10个区域可能存在B细胞抗原表位。结论成功的克隆维氏气单胞菌OMPAⅡ基因,并对OMPAⅡ蛋白的相关生物信息学进行了分析。
维氏气单胞菌;外膜蛋白AⅡ;克隆;序列分析;生物信息学
维氏气单胞菌(Aeromonas veronii,AV)是1983年美国疾病预防与控制中心为纪念法国微生物学家Veron而将9株气单胞菌属的新种命名,其广泛分布于水体与陆地环境中,可以感染多种恒温及变温动物,甚至感染人。做为一种新型水生动物病原菌,近年,已有相当多的病例报道,感染水生动物的种类更是多样[1-5]。而有关感染人的病例也有增多的趋势,其可引起多种炎症:胃肠炎、脑膜炎、败血症、腹膜炎等,甚至有报道称AV可引起人的溶血性尿毒综合症和弥漫性血管溶栓[6-8]。AV做为一种新型的人-兽-鱼共患病原菌,应当引起人们的足够重视。已证实:AV的毒力因子包括气溶素、内毒素、外膜蛋白、粘附素、胞外蛋白酶等,其中,外膜蛋白在增强吞噬附着力、抵抗补体介导的血清杀伤力及参与细菌接合作用等方面均起着主要作用,且外膜蛋白有着较强的免疫原性,对其进行深入了解,将为AV疫苗的研究打下良好的基础。
目前,国内对AV的外膜蛋白尚无报道,基于此,本试验克隆了AV吉林分离株的外膜蛋白AⅡ基因,并对其序列及编码的蛋白进行了相应的生物信息学分析,以期为AV基因工程疫苗的研究及建立可靠的检测方法奠定基础。
1 材料与方法
1.1 菌种和载体 维氏气单胞菌CY0806,分离自吉林某渔场框镜鲤,由本实验室保存;大肠杆菌DH5α,由本实验室保存制备;p MD18-T载体,购自宝生物工程(大连)有限公司。
1.2 主要试剂 DL2000 Marker、Taq DNA 聚合酶、d NTP均购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒购自爱思进生物技术有限公司;细菌基因组DNA提取试剂盒、质粒小量抽提试剂盒购自北京索莱宝科技有限公司;气单胞菌培养基RS购自北京陆桥技术有限责任公司;其他试剂均为进口或国产分析纯。
1.3 引物设计与合成 根据GenBank上发表的AV外膜蛋白AⅡ基因序列,用生物软件Primer Premer 5.0设计一对特异性引物,上游引物P1:5′-GCTGAATTCATGAAACTCAAAATGGCTC-3′、下 游 引 物 P2:5′-GCGAAGCTTTTACTGTTGTACTTGC-3′,预计扩增片段长1 001 bp,引物由宝生物工程(大连)有限公司合成。
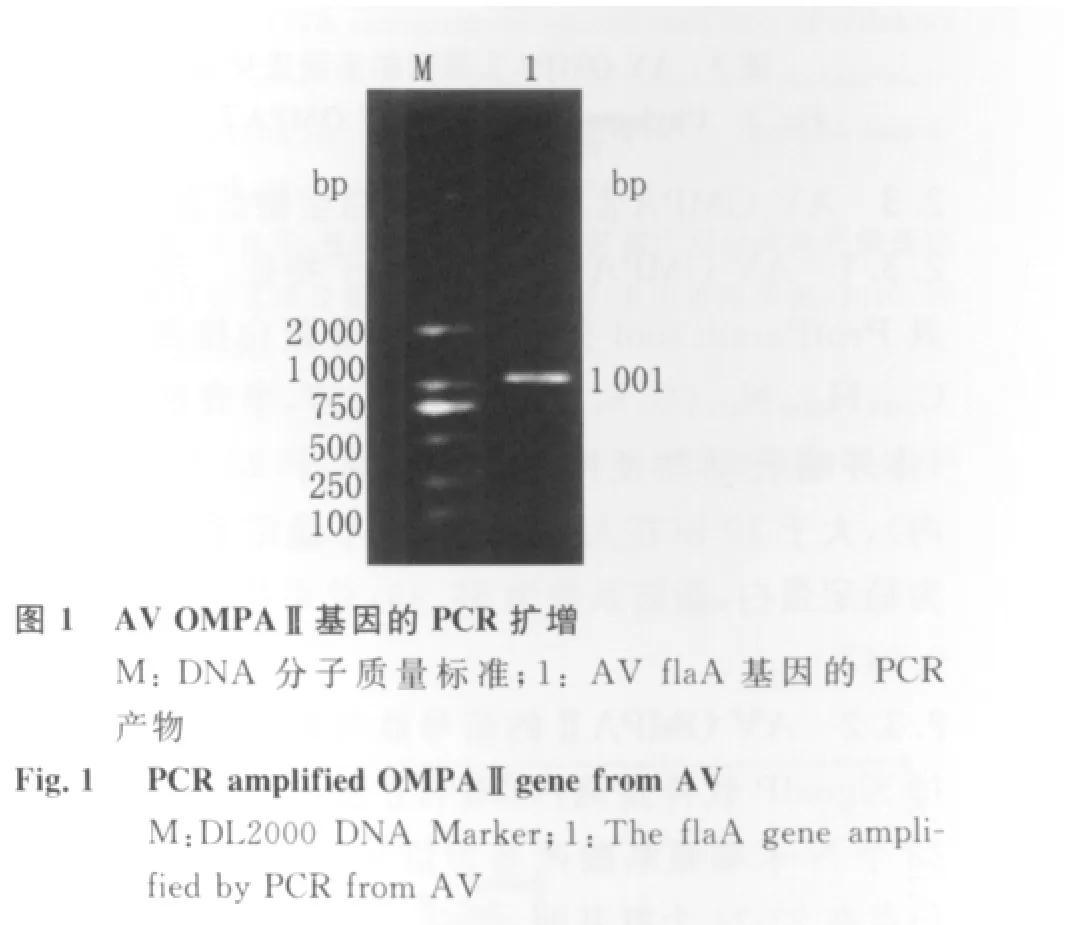
1.4 AV OMPAⅡ基因的PCR扩增 将低温冷存的AVCY0806复苏,并划线接种于RS培养基上,30℃培养24 h,挑取黄色单个菌落接种于普通LB液体培养基中,30℃培养18 h,取1 m L菌液提取细菌基因组DNA,以该基因组DNA为模板,P1、P2为引物,50μL体系进行PCR扩增OMPAⅡ基因,反应条件为:94℃预变性5 min;94℃变性1 min,59℃复性1 min,72℃延伸1.5 min,共34个循环;72℃延伸10 min。用1.0%琼脂糖凝胶电泳检验扩增产物。
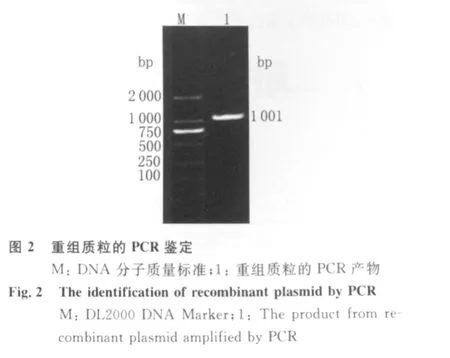
1.5 AV OMPAⅡ基因的克隆及鉴定 PCR产物经琼脂糖凝胶电泳检验后用DNA凝胶回收试剂盒回收目的片段,并与p MD18-T载体连接,将连接产物转化至DH5α感受态细胞中,平铺于含氨苄青霉素LB固体培养基上培养,挑取单个菌落增菌,提取质粒DNA并进行PCR验证。将筛选的阳性重组质粒送至宝生物工程(大连)有限公司。
1.6 AV OMPAⅡ基因的序列分析及系统进化树构建 利用NCBI的Blastn对测序结果进行比对,并从GenBank上下载不同菌种的OMPAⅡ基因的,应用Mega4.0软件构建系统进化树。
1.7 AV OMPAⅡ基因编码蛋白的生物信息学分析 以AV CY0806 OMPAⅡ基因完整开放阅读框编码的氨基酸序列为原始数据,选择不同的生物信息学分析软件对OMPAⅡ蛋白的分子量、理化参数、信号肽、跨膜区、二级结构、B细胞抗原表位等进行预测分析。
2 结 果
2.1 AV OMPAⅡ基因的PCR扩增与鉴定 用2条特异性引物从AV CY0806基因组DNA中扩增出约1 000 bp的特异性条带,片段大小与预期结果一致(图1);挑选的阳性克隆菌落提取质粒通过PCR鉴定,得到与目的基因大小一致的片段(图2)。
2.2 AV OMPAⅡ基因的序列分析与系统进化树构建 测定的AV OMPAⅡ基因的全长1 001 bp,预测编码333个氨基酸,分子量35 034.4 u。以Blast N对获得的OMPAⅡ基因序列进行同源性分析:该基因与维氏气单胞菌AB290200和FJ711769 OMPAⅡ同源性为95%,与温和气单胞菌X91983、嗜水气单胞菌AF146597同源性分别为82.6%和83%。与不同菌种的OMPAⅡ基因构建的系统进化树如图3所示。

图3 AV OMPAⅡ基因的系统进化树Fig.3 Phylogenetic tree of AV OMPAⅡgene
2.3 AV OMPAⅡ基因编码蛋白生物信息学分析2.3.1 AV OMPAⅡ蛋白的分子特征 经在线工具ProtParam tool分析:OMPAⅡ蛋白推测分子式C1559H2441N421O483S9,等电点为4.97,半衰期为30 h(体外哺乳动物类网状细胞)、大于20 h(在酵母内)、大于10 h(在大肠杆菌内),不稳定系数20.45,为稳定蛋白,脂肪系数为89.43,总平均亲水性为-0.042。
2.3.2 AV OMPAⅡ的信号肽与跨膜区分析 通过SignalP软件预测:OMPAⅡ蛋白序列最前端的23个N-末端氨基酸残基为信号肽序列,最佳切割位点在23-24个氨基酸(图4);TMHMM分析结果显示:OMPAⅡ蛋白无跨膜区。
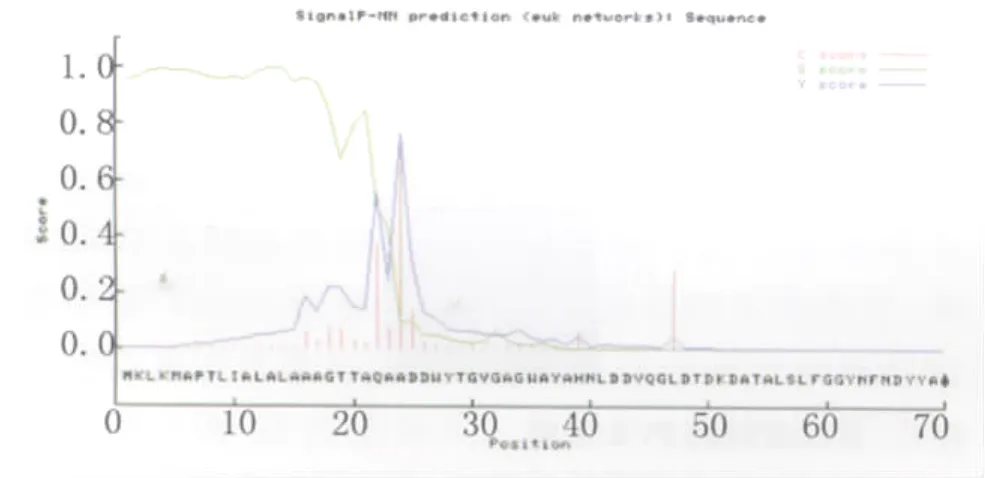
图4 AV OMPAⅡ蛋白分子信号肽预测Fig.4 Signal peptide prediction of AV OMPAⅡ
2.3.4 AV OMPAⅡ的二级结构预测分析 以Garnier Robson方法预测OMPAⅡ的二级结构发现:α螺旋占35.1%,β折叠占46.2%,在各α螺旋与β折叠间存在不同的β转角和无规则卷曲,其中β转角占8.71%,无规则卷曲占10.8%;而应用Chou-Fasman分析显示:α螺旋占25.8%,β折叠占25.8%,二者相间分布,在β折叠之间存在大量β转角,占36%(图5)。
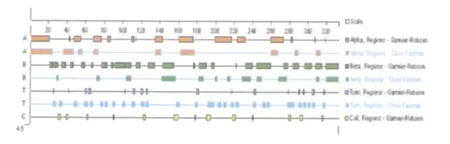
图5 AV OMPAⅡ的二级结构预测Fig.5 Secondary structure prediction of AV OMPAⅡ
2.3.5 AV OMPAⅡ的B细胞抗原表位预测 分别以Kyte-Doolittle氨基酸亲水标准分析AV OMPAⅡ的亲水区,Emini原则预测其表面可及性,Karplus-Sohulz的柔性蛋白预测方案预测其柔性区域,Jameson-Wolf分析其抗原指数。综合以上各种方案预测结果,经分析,虽然不同方案得到的能形成的B细胞抗原表位优势区的数量与区域有所不同,但综 合 各 结 果:区 域 122-125、165-166、219-222、242-243、254-255、258-259、267-268、291-293、305-307、317-320,在此10个区域的预测参数值高于其他区域,因此,以上区域所形成B细胞抗原表位的可能性最大。
3 讨 论
维氏气单胞菌做为一种新型的人-兽-鱼共患病原菌,近年来已引发多种水生动物不同疾病的爆发,其感染人的病例也时常报道,但国内对其研究并不深入,有诸多问题尚待解决。外膜蛋白是革兰氏阴性菌外膜的重要组成部分,在免疫原性和致病性方面起着至关重要的作用,其可以刺激机体产生体液免疫和细胞免疫,起到保护机体免受病原菌攻击的作用,相关研究表明:将AV的OMPs基因连接到真核表达载体,构建DNA疫苗并免疫班带副鲈,对AV的攻击起到很好的保护作用[9]。鉴于此,本试验针对AV OMPAⅡ基因设计一对特异性引物,对框镜鲤源AV吉林分离株进行PCR扩增,得到目的基因片段,经序列测定与分析:该菌株OMPAⅡ基因与GenBank的AV菌株AB290200和FJ711769 OMPAⅡ同源性为95%,与其他气单胞菌同源性为83%左右,说明气单胞菌属间OMPAⅡ存在着一定的种属差异。
通过信号肽预测,OMPAⅡ蛋白存在信号肽,序列为最前端23个N-末端氨基酸残基,且为疏水性氨基酸。疏水区的存在不利于蛋白表达,所以在后续的异源表达试验中,可将信号肽去掉,则有利于外膜蛋白的表达。经预测OMPAⅡ无跨膜区,则预示该蛋白可能会较高量、可溶性的表达[10]。本试验对AV OMPAⅡ基因编码蛋白二级结构进行了预测,结果显示:β折叠和β转角占有较高的比例,而β转角与无规则卷曲区域则可能形成抗原表位,本研究对B细胞抗原表位的预测综合了多种参数,以提高预测的准确性,最后得到10个区域可能是AV OMPAⅡB细胞抗原表位的位点。
本研究成功的克隆了AV OMPAⅡ基因,并对其编码蛋白进行了分子特征、信号肽与跨膜区、二级结构以及B细胞抗原表位的分析与预测,研究结果将为AV的基因工程疫苗、以及特异性免疫诊断奠定基础。
[1]Rahman M,Colque-Navarro P,Kuhn I,et al.Identification and characterization of pathogenic Aeromonas veronii biovar sobria associated with epizootic ulcerative syndrome in fish in Bangladesh[J].Applied Environmental Microbiology,2002,68(2):650-655.
[2]Sung H H,Hwang S F,Tasi F M.Responses of Giant Freshwater Prawn (Macrobrachium rosenbergii)to Chall-enge by Two Strains of Aeromonas spp.[J].Journal of Invertebrate Pathology,2000,76:278-284.
[3]房海,陈翠珍,张晓君,等.中华绒螯蟹病原维氏气单胞菌的检验[J].中国人兽共患病学报,2008,24(1):45-49.
[4]秦蕾,徐静,张晓军.泥鳅的凡隆气单胞菌感染[J].中国人兽共患病学报,2008,24(12):1100-1102.
[5]潘晓艺,沈锦玉,李建应,等.青虾“软壳综合症”病原及其特性[J].微生物学通报,2009,36(10):1571-1576.
[6]Wang J T,Fang C T,Hsueh P R,et al.Spontaneous bacterial empyema caused by Aeromonas veronii biotype sobria[J].Diagnostic Microbiology and Infectious Disease,2000,37:271-273.
[7]Shiina Y,Ii K,Iwanaga M.An Aeromonas veronii biovar sobria infection with disseminated intravascular gas production[J].Infect Chemother,2004,10:37-41.
[8]Figueras M J,Aldea M J,Ferna ndez N,et al.Aeromonas hemolytic uremic syndrome.A case and a review of the literature[J].Diagnostic Microbiology and Infectious Disease,2007,58:231-234.
[9]Vazquez-Juarez R C,Gomez-Chiarri M,Barrera-Saldana H,et al.Evaluation of DNA vaccination of spotted sand bass(Paralabrax maculatofasciatus)with two major outer-membrane protein-encoding genes from Aeromonas veronii[J].Fish &Shellfish Immunology,2005,19:153-163.
[10]陈善真,王贵平,曾振灵,等.副嗜血杆菌广东分离株外膜蛋白P5基因的克隆及蛋白结构预测[J].中国兽医学报,2010,30(2):206-210.
Cloning and bioinformatics analysis on outer membrane protein gene AⅡof Aeromonas veronii isolated from Jilin Province
SHAN Xiao-feng,WU Tong-lei,MENG Qing-feng,WANG Wei-li,QIAN Ai-dong
(College of Animal Science and Technology,Jilin Agricultural University,Changchun 130118,China)
The purpose of this study was to clone outer membrane protein gene AⅡof Aeromonas veronii isolated from Jilin Province and analyze biological information of coding protein.Based on the sequence of published OMPAⅡgene,a pair of primers was designed to amplify the OMPAⅡgene by PCR technique,and was cloned into PMD18-T vectors.Then the positive recombinant plasmid was identified by PCR and sequencing.At last,the OMPAⅡgene homology among this strain and others was analyzed by Blast N,and the phylogenetic tree was constructed.Meanwhile,the related biological information of the coding protein was analyzed.The result showed that the OMPAⅡgene was 1001bp and the homology with others gene sequences reported by GenBank was 95%.By bioinformatics analysis,the OMPⅡprotein doesn’t contain transmembrane region and its N-terminal contains one signal peptide.The secondary structure mainly containsβ-pleated sheet andβ-turn,and ten regions are likely to contain B cell antigenic determinants.The OMPAⅡgene of Aeromonas Veronii was successfully cloned,and related biological information of the protein was analyzed.
Aeromonas Veronii;outer membrane protein gene AⅡ;gene cloning;sequence analysis;bioinformatics
R917.1
A
1002-2694(2011)12-1082-04
*国家支撑计划项目(2010BAD04B01)、吉林省科技厅项目(20080218)和吉林农业大学青年启动基金项目联合资助;单晓枫和吴同垒为同等贡献
钱爱东,Email:qianaidong0115@163.com
1.吉林农业大学动物科学技术学院,长春 130118;2.吉林出入境检验检疫局,长春 130062
2011-04-15;
2011-06-21

