苯酚高效降解菌的筛选及其降解特性研究
刘建忠,王 乾,颜家保,秦晓蓉,李凌凌
(武汉科技大学煤转化与新型炭材料湖北省重点实验室,湖北武汉,430081)
苯酚是一种应用广泛的化工原料,但同时也是一种生物毒性物质,其对人体和环境中的其他生物均可造成不同程度的危害[1]。特殊环境中的少数微生物不仅能够耐受苯酚,而且能以苯酚为生长的碳源和能源[2]。从被酚类物质污染的环境中筛选、驯化苯酚高效降解菌并应用于苯酚类物质的处理,具有经济、安全以及所能处理的污染物阈值低、残留少、无二次污染等优点,应用前景十分广阔[3]。近年来,国内外已有不少从事苯酚降解菌的分离及降解特性研究的文献报道[4-9],但如何提高苯酚降解效率、缩短工业废水在净化池中的停留时间还有待于进一步研究。
本文对从某焦化厂处理废水的活性污泥中筛选苯酚高效降解菌进行试验研究,并对其降解特性进行分析,以期为含酚废水生物处理技术的应用提供依据。
1 试验
1.1 试验材料
分离菌株的活性污泥、混合菌群均采自某焦化厂废水处理车间初曝池,焦化废水中苯酚浓度约为300 mg/L。
富集培养基的组成包括[10]:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、苯酚(根据需要加入),加蒸馏水定容至1 L,pH=7.0~7.2。
无机盐培养基以苯酚为惟一碳源,其组成包括[11]:K2HPO40.4 g、KH2PO40.4 g、NaCl 0.1 g、M gSO4·H2O 0.2 g、M nSO4·H2O 0.01 g、Fe2(SO4)3·H2O 0.01 g、Na2MoO4·2H2O 0.01 g、(NH4)2SO41.0 g、苯酚(根据需要加入),加蒸馏水定容至1 L,pH=7.0~7.2。
1.2 菌种的筛选和驯化
按1%的接种量吸取2 m L活性污泥至200 mL苯酚浓度为300 mg/L的富集培养基中,在30℃、200 r/min的摇床中培养3 d,然后依次转接至苯酚浓度分别为500、1 000、1 500 mg/L的富集培养基中。将经过苯酚浓度为1 500 m g/L的富集培养基富集后的菌体转接至无机盐培养基中驯化。采用稀释涂布和划线的方法,在分离培养基平板上分离筛选以苯酚为惟一碳源和能源的菌株。
1.3 固定化小球的制备
取对数期的菌悬液低速离心(5 000 r/min下离心15 min),弃上清液。菌体经生理盐水充分洗涤后再次离心,收集菌体。称取5 g湿菌体与100 m l 2%(质量分数)的海藻酸钠混合均匀。分别用2、5、10 mL的注射器将海藻酸钠与菌体的混合物以恒定的速度滴入8%(质量分数)的CaCl2溶液中,于4℃交联钙化后得到海藻酸钠钙凝胶小球。
1.4 检测方法
微生物生长量的测定以空白培养基为对照,在600 nm处测吸光度。每个试样设置两个平行的试验,数值取两个平行试验的平均值。
苯酚浓度采用改进的4-氨基安替比啉法测定[12-13]。
2 结果与分析
2.1 菌株的筛选与降解条件的优化
经反复驯化、涂板分离,共得到8株以苯酚为惟一碳源和能源而高效生长的菌株。通过比较发现其中3号菌株(命名为Wust-C,初步鉴定为香茅醇假单胞菌)降解苯酚的效率明显高于其他菌株,故选其作为研究菌株,其革兰氏染色结果为阴性。
通过一系列的降解条件优化试验发现,含酚废水的pH值对wust-C降解苯酚的效果有显著的影响。中性或偏碱性的环境有利于该菌株对苯酚的降解,碳源和氮源的添加对菌株降解苯酚没有明显的改善作用。降解条件优化试验结果表明,该菌株降解苯酚较合适的条件是:培养温度为30℃,培养液pH值为7,摇床转速为200 r/min,当三角烧瓶中无机盐培养基的装液量为90 m L时,菌种(OD600≈0.6)接菌量为10 m L。以下试验均是利用该菌株在上述条件下进行的。
2.2 Wust-C的生长与苯酚的降解
将wust-C接入初始苯酚浓度为1 000 mg/L的无机盐培养基中,每隔4 h测定一次培养基中的菌体浓度和苯酚含量,计算该菌体生长的平均OD值和苯酚平均降解率,得到如图1所示的菌体生长和苯酚降解曲线。
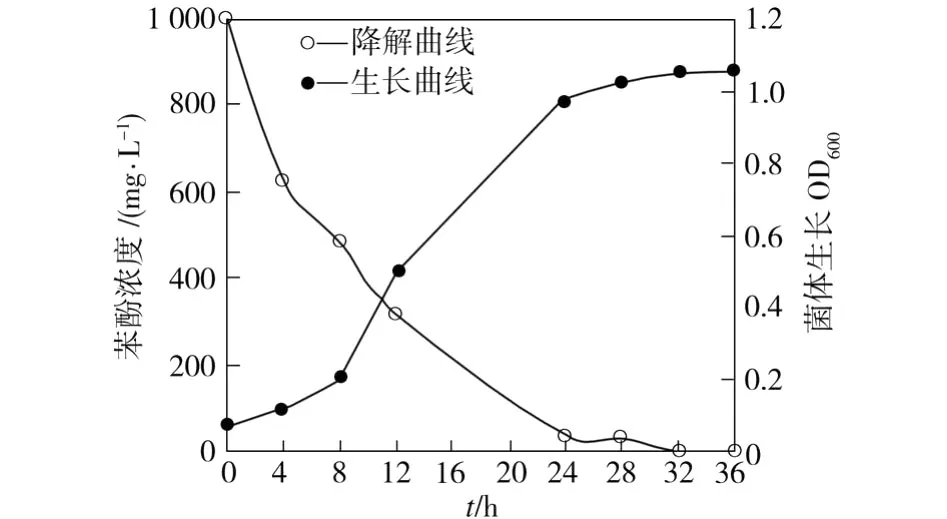
图1 菌株生长和苯酚降解曲线Fig.1 Curves of bacterial growth and phenol degradation
从图1中可以看出,随着菌体的大量增长,培养基中的苯酚残余量迅速下降。由于接菌量较大,菌株停滞期非常短,很快进入对数期。菌体的快速增长使其对碳源的需求量迅速增大,苯酚降解迅速、浓度下降很快,经过24 h,苯酚降解率可达到98%。此后,由于培养基中的碳源已相对较少,加上代谢产物的不断累积,使菌体的生长受到抑制,其数量增加缓慢,苯酚降解速度也趋缓。经过32 h,培养基中的苯酚可完全降解。
2.3 Wust-C对不同初始浓度苯酚的降解效果
wust-C在初始含酚浓度不同的培养基中对苯酚的降解特征如图2所示。由图2可见,Wust-C在以苯酚为惟一碳源的培养基中可有效降解不同浓度的苯酚。初始苯酚浓度越低,降解所需时间越短。在初始苯酚浓度为300 mg/L和500 mg/L的试样中,苯酚完全降解所需的时间分别为8 h和12 h;在初始苯酚浓度为1 000 m g/L的试样中,苯酚完全降解所需的时间为32 h;在初始苯酚浓度为1 600 mg/L的试样中,菌体的生长速度和苯酚的降解速度均极其缓慢。培养4 h时,wust-C对初始含酚浓度分别为300、500、800、1 000 mg/L试样中的苯酚降解率分别达到86.4%、59.3%、47.6%、41.7%。
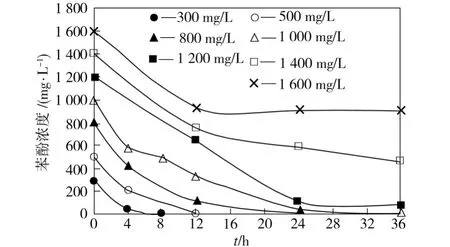
图2 Wust-C对不同初始浓度苯酚的降解效果Fig.2 Degradation of phenol with different initial concentrations by Wust-C
2.4 固定化Wust-C对苯酚的降解效果
通过比较采用2、5、10 m L注射器制作的Wust-C固定化小球(分别记为1#、2#、3#小球)在初始苯酚浓度为1 000 mg/L的培养基中对苯酚的降解情况发现,1#小球的降酚效率高于另外两种小球。1#小球与游离菌在相似的条件下对初始苯酚浓度分别为1 000 mg/L和1 200 mg/L试样中的苯酚降解情况如图3所示。
由图3可见,在相似的条件下,固定化细菌降解苯酚的效率显著高于游离细菌。在初始苯酚浓度为1 000 mg/L的试样中,培养12 h时,固定化细菌和游离细菌对苯酚的降解率分别为78%和68%,培养24 h时,两者的苯酚降解率分别为100%和96.6%;在初始苯酚浓度为1 200 mg/L的试样中,培养24 h时,固定化细菌和游离细菌对苯酚的降解率分别为100%和91.5%。游离细菌完全降解初始苯酚浓度为1 200 mg/L试样中的苯酚需要48 h以上的时间。另外,固定化wust-C能在4 h内完全降解初始苯酚浓度为300 mg/L试样中的苯酚,而且固定化小球可以重复使用,使用5次后其对苯酚的降解效率未出现明显的下降。
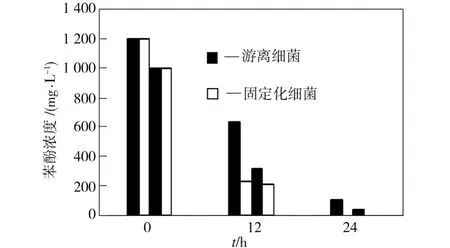
图3 固定化细菌和游离细菌对不同初始浓度苯酚的降解比较Fig.3 Comparison of the phenol degrading performance between free and immobilized bacteria
2.5 Wust-C接入混合菌后对苯酚的降解效果
将Wust-C分别以5%、10%、15%(体积分数)比例添加到混合菌群中,测定其对初始苯酚浓度为1 000 mg/L试样中苯酚的降解特性,如图4所示。
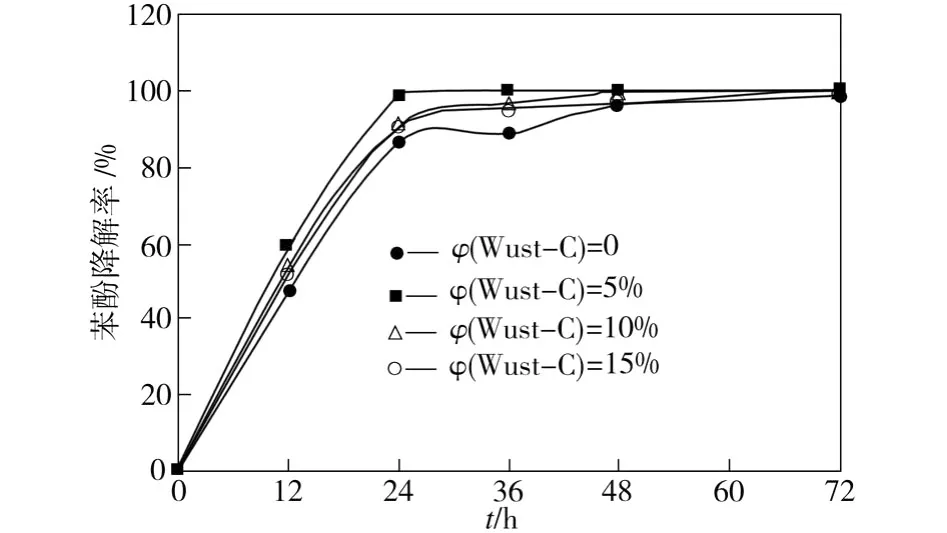
图4 混合菌群添加Wust-C后对苯酚的降解效果Fig.4 Degradation of phenol by mixed bacterial consortia after adding Wust-C
由图4可见,加入Wust-C后,混合菌群降解苯酚的效果得到改善,其中加入5%Wust-C的混合菌群降酚效果最优。在培养36 h时,加入5%wust-C的混合菌群已将苯酚完全降解。与加入15%Wust-C的混合菌群相比,加入10%Wust-C的混合菌群降酚效果略优,但二者都能在60~72 h内实现对苯酚的完全降解。而未加入Wust-C的混合菌在培养72 h时,对苯酚的降解率才达到98.5%。
3 结论
(1)从某焦化厂处理废水的活性污泥中筛选到8株能以苯酚为惟一碳源和能源而高效生长的菌株,其中命名为Wust-C的菌株降解苯酚的效果较好。
(2)Wust-C的加入能增强混合菌群降解苯酚的能力,但这种改善作用并不随Wust-C含量的增加而增强,表明混合菌群内不同菌株在降解焦化废水中的污染物时存在着复杂的互作和共生关系。
(3)固定化处理可明显提高Wust-C降解苯酚的效率。
[1] 陈朝东,何明清,黎青松.环境保护基础知识问答[M].北京:化学工业出版社,2006:167.
[2] KiliçN K.Enhancement of phenol biodegradation byOchrobactrumsp.isolated from industrial waste waters[J].International Biodeterio ration&Biodegradation,2009,63:778-781.
[3] 刘桂萍,魏剑峰,刘长风,等.改性聚丙烯酰胺固定化细胞降解苯酚的研究[J].沈阳化工学院学报,2009,23(2):130-133.
[4] 刘广金,张袖丽.苯酚高效降解菌的筛选及其降解特性的研究[J].现代农业科技,2007(11):202-203.
[5] Chung Tsuey-Ping,Tseng Hsiu-Ya,Juang Ruey-Shin.Mass transfer effect and intermediate detection for phenol degradation in immobilizedPseudomonasputidasystem s[J].Process Biochemistry,2003,38:1 497-1 507.
[6] 胡忠,吴奕瑞,徐艳,等.海洋苯酚降解菌Candidasp.P5的分离鉴定及其降解特性[J].应用与环境生物学报,2007,13(2):243-247.
[7] Wang Ying,Tian Ye,Han Bin,et al.Biodegradation of phenol by free and immobilizedAcinetobactersp.strain PD12[J].Journal of Environmental Sciences,2007,19:222-225.
[8] Adav S S,Chen M ing-Yuan,Lee Duu-Jong,et al.Degradation of phenol byAcinetobacterstrain isolated from aerobic granules[J].Chemosphere,2007,67:1 566-1 572.
[9] Nair I C,Jayachandran K,Shashidhar S.Treatment of paper facto ry effluent using a phenol degradingAlcaligenessp.under free and immobilized conditions[J].Bioresource Technology,2007,98:714-716.
[10] 袁利娟,姜立春,彭正松,等.一株高效苯酚降解菌的选育及降酚性能研究[J].微生物学通报,2009,36(4):587-592.
[11] 余水静,李杰庆,宋秋华,等.两株苯酚降解菌的分离及降解特性的初步研究[J].生物技术,2005,15(3):62-64.
[12] 徐玉泉,张维,陈明,等.一株苯酚降解菌的分离和鉴定[J].环境科学学报,2000,20(4):450-455.
[13] 国家环保局编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,1997:408-410.

