《酸碱中和滴定》的几点心得
张建梅
(介休市第二职业中学,山西 介休 032000)
《酸碱中和滴定》的几点心得
张建梅
(介休市第二职业中学,山西 介休 032000)
多年的工作中,发现学生经常在《酸碱中和滴定》的几个知识点犯错误,笔者根据《酸碱中和滴定》的两大知识块:酸碱中和滴定的原理和实验浅谈了几点心得体会。
酸碱中和滴定;心理;原理;实验
多年的教学工作中,发现学生经常在《酸碱中和滴定》的几个知识点犯错误,我不断探索,力求找到如何把这几个知识点讲清楚,使自己的教学工作更完善。下面谈谈我对《酸碱中和滴定》的几点心得。
《酸碱中和滴定》主要有两大知识块:酸碱中和滴定的原理和酸碱中和滴定的实验。
1 酸碱中和滴定的原理
1.1 酸碱中和滴定原理的知识点
(1)酸碱中和反应的实质是酸电离出的 H+和碱电离出的OH-反应生成H2O,即H++ OH-= H2O。同学有这样的疑问:醋酸溶液和氨水反应的离子方程式是CH3COOH+NH3·H2O =+ CH3COO-+H2O。它的实质也是H++ OH-= H2O吗?回答:确实也是。离子方程式中醋酸和一水合氨不改写成离子形式只是因为它们是弱电解质,大部分以分子形式存在,但实际上是电离出的离子之间的反应,由于:
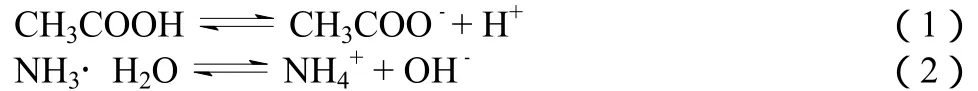
其中(1)电离出的H+和(2)电离出的OH-发生反应H++OH-=H2O,使(1)中c(H+)减小,平衡右移,同时(2)中c(OH-)减小,平衡也右移,即在同一溶液中两电离平衡相互促进。
(2)根据酸碱中和反应的实质是H++OH-=H2O,可以得出:不论什么样的酸和什么样的碱发生反应,参加反应的n(H+)和n(OH-)必相等。
(3)酸和碱什么时候恰好中和?回答是:当酸和碱的物质的量之比恰好等于化学计量数之比时恰好中和,即这时提供的酸和碱恰好都消耗了,就成了生成盐的水溶液了。
(4)酸和碱恰好中和时,溶液一定呈中性?结论是:不一定。
当强酸和强碱恰好中和时,形成强酸强碱盐溶液,溶液呈中性。例如,H2SO4+2NaOH=Na2SO4+2H2O,当提供的 n(H2SO4)/n(NaOH)=2/1时,H2SO4溶液和NaOH溶液恰好中和,形成了Na2SO4溶液,呈中性。
当强酸和弱碱恰好中和时,形成强酸弱碱盐溶液,溶液呈酸性。例如,HCl + NH3·H2O =NH4Cl + H2O,当提供的 n(HCl)/n(NH3·H2O)=1时,盐酸和氨水恰好中和,形成了NH4Cl溶液,因为微弱水解而呈酸性。
当弱酸和强碱恰好中和时,形成强碱弱酸盐,呈碱性。例如,CH3COOH+NaOH=CH3COONa+H2O,当提供的n(CH3COOH)/n(NaOH)=1时,醋酸溶液和氢氧化钠溶液恰好中和,形成CH3COONa溶液,因为微弱水解而呈碱性。
1.2 酸碱中和滴定原理的练习
(1)用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为 V1和 V2,则 V1和 V2的关系正确的是( )。
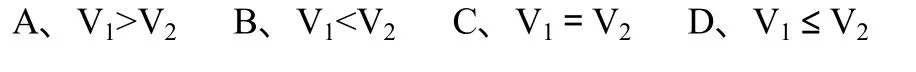
答案:A。
解析:盐酸和醋酸都是一元酸,中和等物质的量的 NaOH所需二者的物质的量相等,现在盐酸的浓度比醋酸小,所需体积必然比醋酸大。
(2)在通常状况下,把醋酸滴入氢氧化钠溶液中,当溶液中c(CH3COO-)= c(Na+)时,溶液的pH是( )。
A、大于7 B、等于7 C、小于7 D、不能确定
答案:B。
解析:此题可根据整个溶液不显电性有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),已知 c(CH3COO-)=c(Na+),所以c(H+)= c(OH-),pH等于7。注意此时不是恰好中和,提供的醋酸的物质的量已大于氢氧化钠的物质的量。
(3)一种一元强酸HA溶液中加入一种碱MOH反应后,溶液呈中性,下列判断中正确的是( )。
A、加入的碱过量
B、混合前酸与碱中溶质的物质的量相等
C、生成的盐不发生水解
D、反应溶液中c(A-)、c(M+)相等
答案:D。
解析:一元强酸HA溶液中如果加入的是强碱,溶液呈中性时,B成立;如果加入的是弱碱,溶液呈中性时,A成立。现在没有说明是强碱还是弱减,所以A、B都不能选,根据整个溶液不显电性有:c(M+)+c(H+)= c(A-)+c(OH-),已知溶液呈中性即 c(H+)= c(OH-),所以 c(M+)、c(A-)相等。
2 酸碱中和滴定的实验
2.1 酸碱中和滴定的实验的分类讨论
这部分主要讲滴定管的使用以及根据酸碱中和反应原理测定酸或碱的浓度,其难理解处在于“一些错误操作对未知浓度测定的影响”。我们以书本例题来说明:用0.1032 mol/L的盐酸溶液滴定25.00 mL未知浓度的NaOH溶液,通过中和滴定测定NaOH的物质的量浓度是多少?
原理:HCl + NaOH=NaCl + H2O

从上面可看出,c(NaOH)取决于滴定实验中读出的V[HCl(aq)],并且这两个量成正比,读出的 V[HCl(aq)]准确,c(NaOH)就准确;读出的 V[HCl(aq)]偏大,c(NaOH)就偏大;读出的V[HCl(aq)]偏小,c(NaOH)就偏小。
我们用以下情况来说明:
(1)酸式滴定管用水洗涤后,直接注入0.1032 mol/L的标准 HCl(aq)。上述情况直接引起标准 HCl(aq)的浓度小于0.1032 mol/L,中和25.00 mL未知浓度的NaOH溶液必然引起消耗盐酸溶液体积偏大,c(NaOH)就偏大。
(2)滴定前滴定管尖嘴部分有气泡,滴定完毕气泡消失。这种情况读出的V[HCl(aq)]中包括真正消耗的V[HCl(aq)]和V(气泡),即读出的V[HCl(aq)]偏大,c(NaOH)就偏大。
(3)滴定前仰视滴定管刻度,滴定完毕平视滴定管刻度。上述情况滴定前读出的刻度偏低,导致读出的V[HCl(aq)]比真正消耗的偏小,c(NaOH)就偏小。
(4)滴定完毕,滴定管尖嘴处悬挂着一滴盐酸。这种情况读出的V[HCl(aq)]包括滴入锥形瓶中的盐酸溶液的体积和悬着一滴的体积,所以读出的V[HCl(aq)]比真正消耗盐酸溶液体积偏大,c(NaOH)就偏大。
(5)锥形瓶用水洗涤后,又用未知浓度的NaOH溶液润洗。这样将使锥形瓶中盛有未知浓度的 NaOH溶液的体积大于25.00 mL,导致n(NaOH)增大,所需标准盐酸溶液的体积必然增大,c(NaOH)就偏大。
(6)滴定时,锥形瓶振荡过于剧烈,部分NaOH溶液溅出。这种情况使锥形瓶内n(NaOH)减小,所需标准盐酸的体积必然减小,c(NaOH)就偏小。
(7)滴定中向锥形瓶内加入蒸馏水。这样做是把25.00 mL未知浓度的NaOH溶液稀释,但稀释过程中n(NaOH)保持不变,所需标准盐酸溶液的体积无影响,所以读出的V[HCl(aq)]准确,c(NaOH)就准确。
2.2 酸碱中和滴定实验的练习
(1)用酸滴定碱时,滴定前读酸式滴定管读数时视线高于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度( )。
A、偏高 B、偏低 C、不受影响 D、不能确定答案:A。
(2)在一支25 mL的酸式滴定管中盛入0.1 mol/L HCl溶液,其液面恰好在5 mL刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1 mol/L NaOH溶液进行中和,则所需NaOH溶液的体积( )。
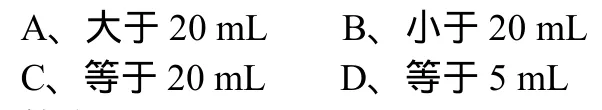
答案:A。
解析:滴定管25 mL刻度下面还有溶液,所以从酸式滴定管放出的是大于20 mL的0.1 mol/L HCl溶液,用0.1 mol/L NaOH溶液进行中和,所需NaOH溶液的体积也就大于20 mL。
“Acid and alkali Neutral Titrate” Several Desserts
Zhang Jianmei
In many year work, discovered student frequently in “Acid and alkali Neutral Titrate” several knowledge spots make a mistake,the author according to “Acid and alkali Neutral Titrate” two big knowledge blocks: The acid and alkali neutral titrate’s principle and the experiment introduced several dessert appropriate meetings.
acid and alkali neutral titrate; psychology; principle; experiment
G632
A
1000-8136(2011)06-0140-02

