利用氢氧化镁热分解氯化铵制氨气工艺的研究
,
(1.昆明理工大学化学工程学院,云南昆明 650224;2.云南省化工研究院)
1 化学反应原理
利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺,其反应温度大概在325~500 ℃[1]。体系发生的主要反应为:

(1)

(2)

(3)

(4)

(5)

(6)

(7)
考虑到氧化镁回收后继续分解氯化铵时的反应活性问题,需要控制所得产物为MgOHCl。因为如果得到的是MgCl2,那么在下一步释放氯化氢的反应中,所得的MgO颗粒太细,活性不高,且容易引起粉尘堵塞管道的问题。在这个反应体系当中,最重要的是控制反应(6)使反应不断向右进行。根据Gibbs-Helmholtz方程:
(8)


表1 反应(6)中各化合物的摩尔定压热容 (CP)与温度之间的关系[2]
ΔCP=∑γiCP(生成物)-∑γiCP(反应物)
式中: ΔCP为化学反应的摩尔定压热容变化值;∑γiCP(生成物)为生成物的摩尔定压热容之和;∑γiCP(反应物)为反应物的摩尔定压热容之和。
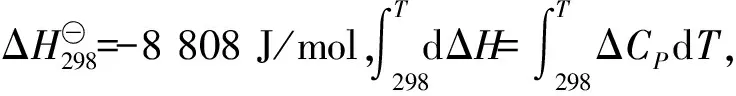
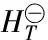
进而可根据方程(8)推导出反应⑹的标准吉布斯自由能与温度的关系式为:
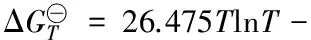
159.49T+73.38
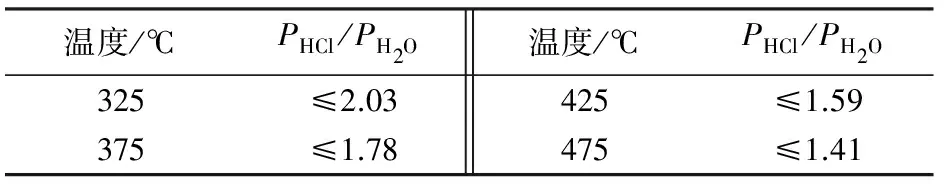
表2 不同温度下反应(6)的PHCl/PH2O值
2 实验过程
2.1 实验装置及原料
实验装置如图1所示。
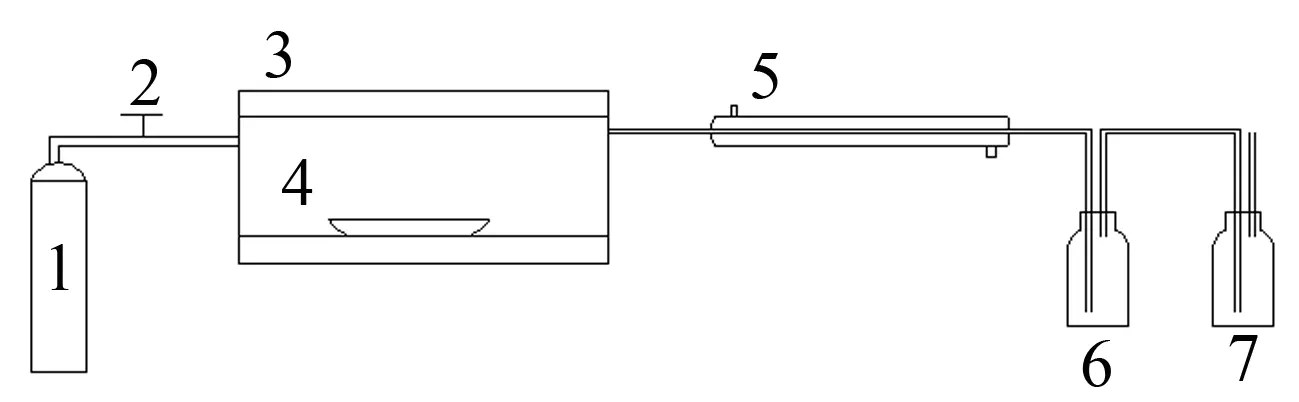
1—氮气瓶;2—开关;3—反应炉; 4—坩埚;5—冷凝管;6—吸收瓶; 7—吸收瓶
图1实验装置图
原料:NH4Cl(分析纯),Mg(OH)2(化学纯)。
2.2 实验方法
先将管式炉升温至反应温度,再将混合好的反应物盛入坩埚,放入炉中。同时通入氮气,使炉中生成的NH3顺利流出,生成的NH3用稀硫酸吸收。
2.3 产物分析
产物中氮含量按GB/T 3600—2000《肥料中氨态氮含量的测定 甲醛法》进行测定,产物中的氯含量的测定流程为:称量取样→用等量HNO3加热溶解样品→容量瓶定容→全自动电位滴定仪(METTLER TOLEDO DL53 Titrator)滴定。利用XRD(日本理学公司 D/max-3B X射线衍射仪)测定产物的物相组成。
3 实验结果及讨论
3.1 反应温度的影响
取反应时间为80 min,Mg(OH)2与NH4Cl的物质的量比为1∶1,控制反应温度分别为325、375、425、475 ℃,含氮量(产物中含氮元素的质量分数)、氯收率、NH3收率随反应温度的变化如图2所示。从图2可看出,产物中含氮量随反应温度的升高而接近于零,说明反应温度高时产物中没有氯化铵存在了。随着反应温度的升高,产物的氯收率随之降低。主要是反应温度过高导致氯化铵分解速率过快,分解生成的HCl来不及与Mg(OH)2(或MgO)反应便已和NH3一同离开反应体系,在低温下又重新结合生成了NH4Cl。综合考虑产物中的含氮量、氯收率和NH3收率,反应温度选择375 ℃较为合适。
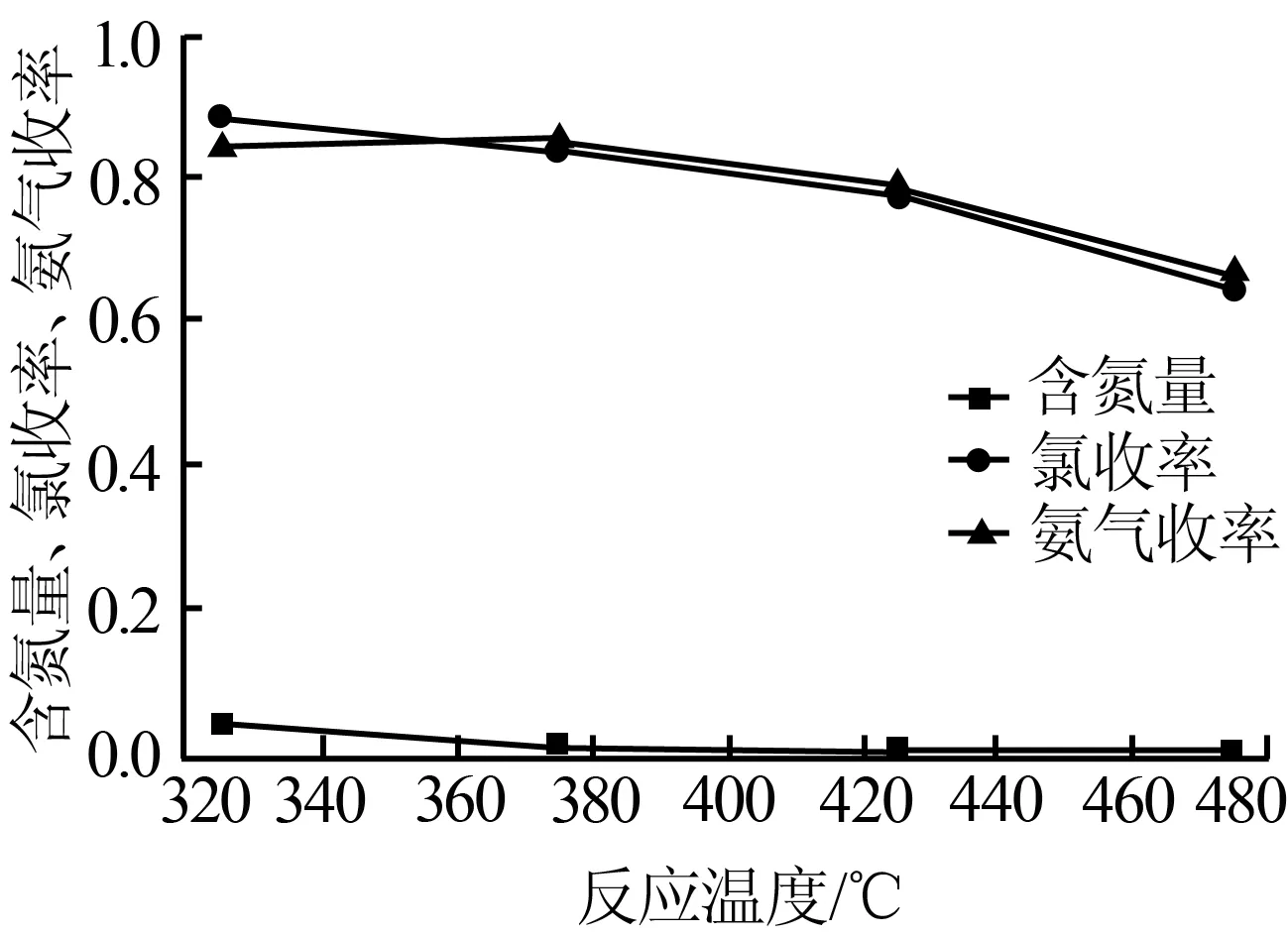
图2含氮量、氯收率、氨气收率随温度的变化
图3为反应温度为375 ℃,反应时间为80 min,Mg(OH)2与NH4Cl的物质的量比为1∶1,反应物充分混合时所得产品的XRD谱图。图3显示所得产物大部分为MgOHCl,有少部分未完全反应的Mg(OH)2,还有微量的MgCl2·6H2O。说明用氢氧化镁热分解氯化铵,可以利用氢氧化镁分解产生的水,使反应体系保持一定的PHCl/PH2O值,得到MgOHCl。
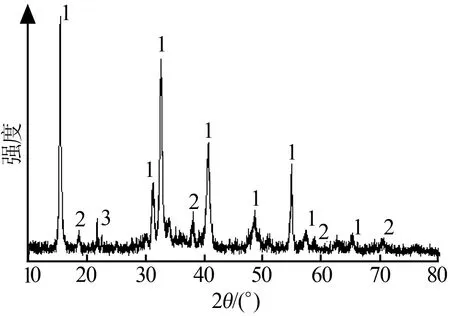
1—MgOHCl; 2—Mg(OH)2;3—MgCl2·6H2O
图3产品的XRD谱图
3.2 反应物物质的量比的影响
取反应温度为375 ℃,反应时间为80 min,反应物均匀混合,Mg(OH)2与NH4Cl的物质的量比分别为1∶1、 1∶0.95、1∶0.9、1∶0.85、1∶0.8、1∶0.75、1∶0.7、1∶0.65、1∶0.6、1∶0.55、1∶0.5,实验结果如表3所示。从表3可看出,随着反应物中氯化铵的减少,NH3收率在升高,这是因为氯化铵周围的氢氧化镁量增加了,氯化铵分解时产生的氯化氢能更好地与氢氧化镁接触并反应,从而避免了氯化氢离开反应体系,在温度低处与氨气重新化合生成氯化铵。当n[Mg(OH)2]∶n(NH4Cl)=1∶0.75时,再减少氯化铵的量,NH3收率变化不大。综合考虑氨气收率和镁利用率,选择n[Mg(OH)2]∶n(NH4Cl)为1∶0.75较为合适。
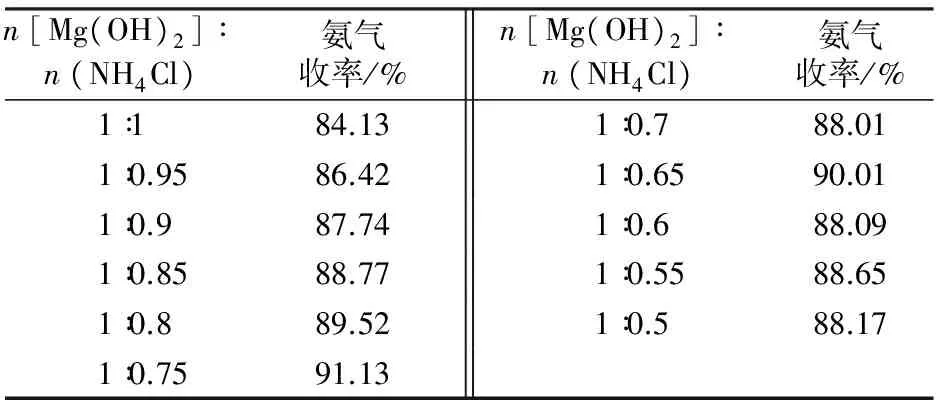
表3 反应物配比对氨气收率的影响
图4为反应温度为375 ℃,反应时间为80 min,氢氧化镁与氯化铵物质的量比分别为1∶1、1∶0.9、1∶0.8、1∶0.7时所得产物的XRD谱图。从图4可以看出,所得产物基本相同,均为碱式氯化镁。随着氢氧化镁与氯化铵物质的量比的下降,产物中的MgCl2·6H2O没有了,产物中未完全反应的氢氧化镁增多了。这说明通过改变反应物的配比,也改变了反应体系的PHCl/PH2O值,使得反应⑹更彻底。
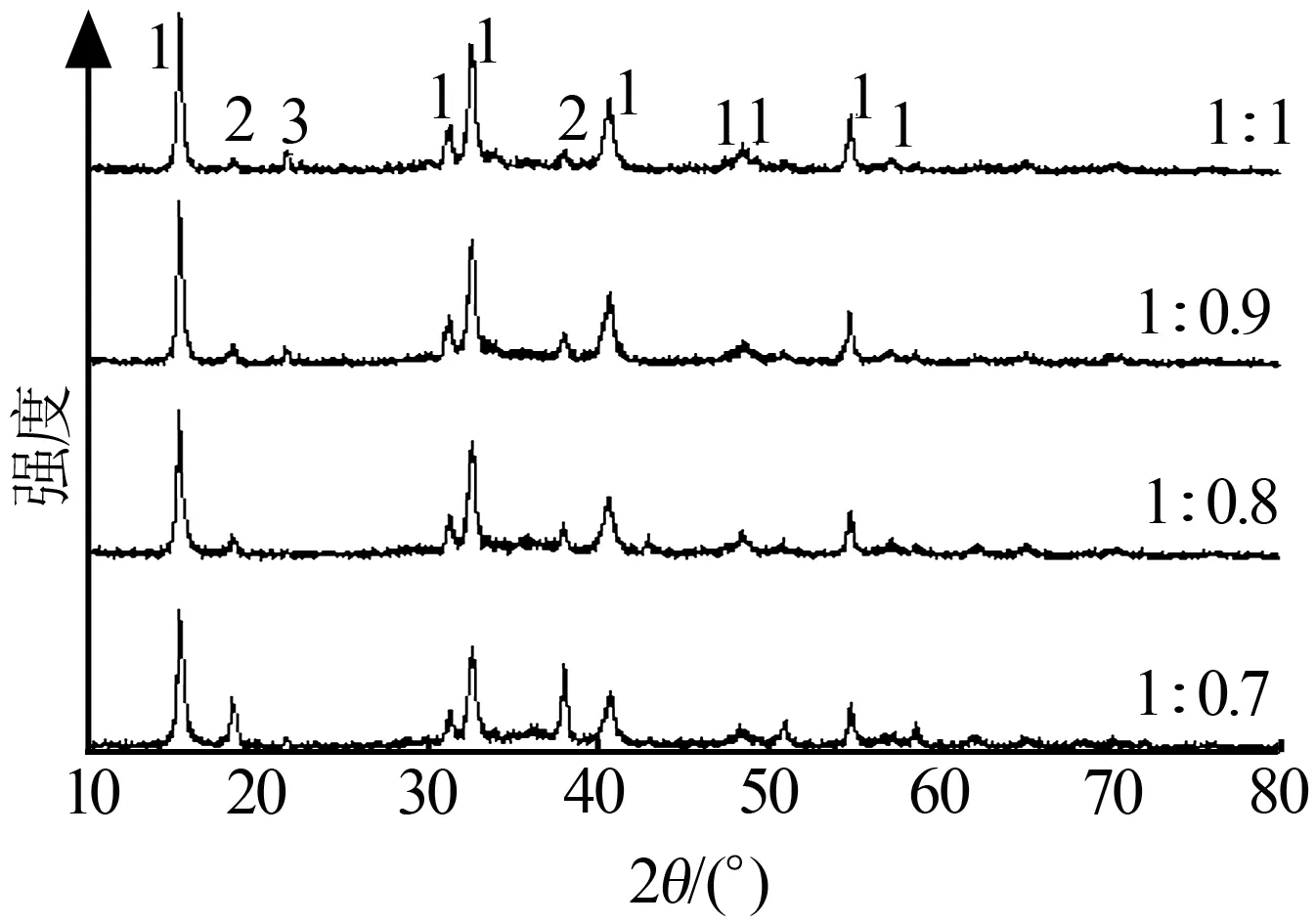
1—MgOHCl; 2—Mg(OH)2;3—MgCl2·6H2O
图4产物的XRD谱图
3.3 反应时间的影响
在反应温度为375 ℃,氢氧化镁与氯化铵物质的量比为1∶0.75时,取反应时间为20、50、80、110、140 min。实验结果如图5所示。从图5可看出,在反应时间为20 min时,所得产物中的含氮量较高,氯收率也较高,但NH3收率不高,因为反应时间过短导致产物中还有未完全反应的NH4Cl存在。随着反应时间的延长,产物几乎不含有氮。产物的氯收率随着反应时间的延长在下降,这可能是因为生成的MgOHCl又分解成MgO和HCl,反应时间越长,失去的HCl越多,导致了氯收率的降低。NH3收率随着反应时间的延长是先增加而后近似不变。综合考虑上述情况,选择反应时间为50 min较好。
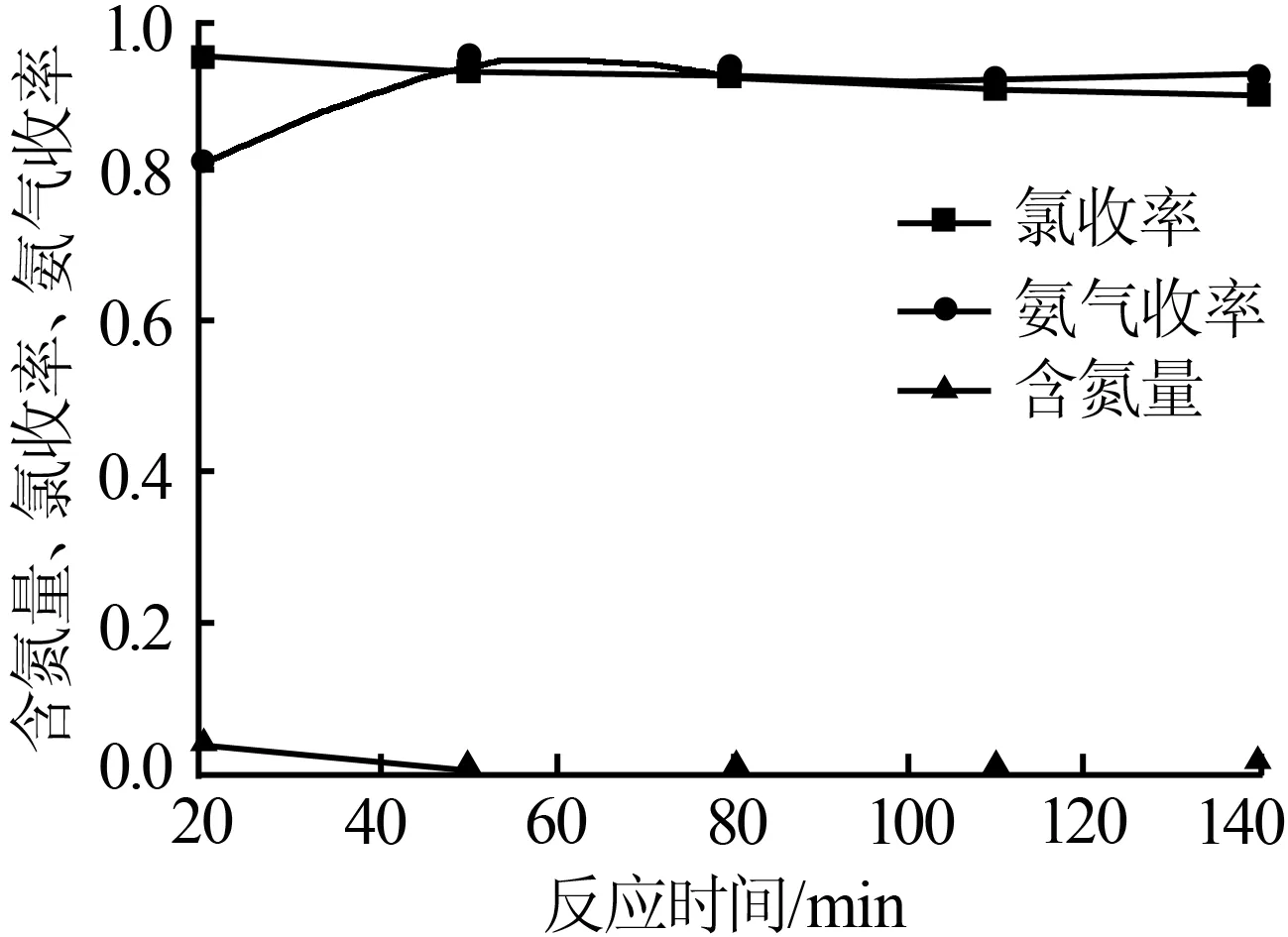
图5反应时间对含氮量、氯收率、氨气收率的影响
4 结论
采用氢氧化镁为原料热分解氯化铵,高温下固相反应可以直接得到MgOHCl。氢氧化镁热分解氯化铵在反应温度为375 ℃,n[Mg(OH)2]∶n(NH4Cl)=1∶0.75,反应时间为50 min的实验条件下,热分解产物氯收率和氨气收率均为90%以上。获得的热分解产物经XRD分析,显示所得产物大部分为MgOHCl,有少部分未完全反应的Mg(OH)2。
[1] Fuchsman C H.Method of recovering ammonia from ammonium chloride:US,2823981[P].1958-12-18.
[2] 叶大伦,胡建华.实用无机物热力学手册[M].2版.北京:冶金工业出版社,2001.

