急性肺栓塞大鼠肺泡Ⅱ型上皮细胞形态及功能变化
刘春萍, 崔俊玉, 陈杭薇, 陶 然, 张力华, 陆慰萱 (北京军区总医院心内科, 北京 00700;
2北京军区总医院呼吸科;3北京军区总医院全军心理卫生指导中心;4盘锦市第四人民医院护理部;5北京协和医院呼吸科;*通讯作者,E-mail:liuchunpingcn@yahoo.com.cn)
急性肺栓塞大鼠肺泡Ⅱ型上皮细胞形态及功能变化
刘春萍1*, 崔俊玉1, 陈杭薇2, 陶 然3, 张力华4, 陆慰萱5(1北京军区总医院心内科, 北京 100700;
2北京军区总医院呼吸科;3北京军区总医院全军心理卫生指导中心;4盘锦市第四人民医院护理部;5北京协和医院呼吸科;*通讯作者,E-mail:liuchunpingcn@yahoo.com.cn)
目的 探讨急性肺栓塞大鼠肺泡Ⅱ型上皮细胞功能及形态的变化。 方法 16只雄性SD大鼠以随机数字表法随机分为对照组、栓塞组,每组8只。栓塞组以明胶海绵溶液经颈静脉注入制备大鼠肺栓塞模型,经右心导管测定肺动脉压、心率、呼吸频率,并行动脉血气分析;对照组手术过程同栓塞组,颈静脉注入同等体积生理盐水。实验大鼠于造模后24 h时处死,取肺组织制备病理切片,HE染色光镜下观察肺组织病理变化,电镜下观察Ⅱ型上皮细胞形态学改变;留取支气管肺泡灌洗液(BALF)行磷脂测定,肺组织行肺表面活性物质相关蛋白A(SPA)蛋白及mRNA水平测定。 结果 对照组和栓塞组大鼠肺动脉平均压、动脉血氧分压(单位:mmHg)比较均有统计学差异(14.2 ±4.1vs26.1 ±7.5,P<0.05;94.1 ±8.8vs80.5 ±5.8,P<0.05)。对照组和栓塞组肺泡灌洗液磷脂水平分别为(374.17 ±36.55)mg/100 ml、(311.67 ±48.56)mg/100 ml(P<0.05)。栓塞组肺组织SPA蛋白、mRNA水平均明显低于对照组(P<0.05)。光镜下24 h时栓塞组大鼠肺组织可见多个血管腔有明胶海绵栓塞;电镜下,对照组大鼠肺泡Ⅱ型上皮细胞形态规则,线粒体、内质网等细胞器丰富,板层小体排列整齐,肺泡表面活性物质层连续完整;栓塞组大鼠Ⅱ型上皮细胞形态欠规则,线粒体肿胀、嵴断裂,板层小体空泡化,肺泡表面活性物质层连续性中断。 结论 急性肺栓塞后大鼠肺泡Ⅱ型上皮细胞功能及形态均发生明显变化,产生表面活性物质能力显著降低,可能在肺栓塞动脉低氧血症中起重要作用。
肺栓塞; 大鼠; Ⅱ型肺泡上皮细胞
肺表面活性物质在维持肺泡稳定性、降低肺泡表面张力方面起着决定性作用,其主要由肺泡Ⅱ型上皮细胞合成和分泌。肺表面活性物质由90%的磷脂和10%的肺表面活性物质相关蛋白(SPs)组成,后者以SPA为主[1],是磷脂降低肺表面张力的必需成分。本研究的目的是了解急性肺栓塞时肺泡Ⅱ型上皮细胞功能及形态学改变。
1 材料及方法
1.1 方法 雄性SD大鼠16只,体重230-260 g(由中国医学科学院动物研究所提供)按随机数字表法随机分为对照组和实验组,每组8只。实验组以明胶海绵溶液制备大鼠肺栓塞模型[1]。所有大鼠均在制作模型后24 h时处死。
1.2 实验数据的采集及标本处理 上述动物处死前以模型制备时相同的麻醉方法麻醉。
1.2.1 大鼠生理指标测定及病理检查 用聚苯乙烯管经右颈外静脉插管测定肺动脉压、心率和呼吸频率;经颈动脉插管取血行动脉血气分析;取肺左叶置4%多聚甲醛溶液中固定48 h以上,石蜡包埋切片,苏木精-伊红(HE)染色,剪一小块肺组织(约2-3 mm)置2%戊二醛中固定,行透射电镜(日本JEOL公司JEM1010)检查。
1.2.2 大鼠肺泡灌洗液磷脂测定 采用消化法。先用氯仿甲醇混合液提取磷脂,然后用硫酸-过氯酸消化提取液中的有机物,再加入钼酸盐,然后用还原剂抗坏血酸使磷钼酸还原产生钼兰,分光光度计比色、测定脂性磷的含量,卵磷脂分子中磷约占4%,故脂性磷换算成磷脂的因数一般用25。
1.2.3 大鼠肺组织SPA蛋白及mRNA检测 主要试剂及仪器:羊抗人SPA多克隆抗体(美国Santa Cruz公司);兔抗羊二抗(北京中山试剂公司)。TGL-16G低温高速离心机(上海安亭科学仪器厂);BIO-RAD 450型酶标仪(美国BIO-RAD公司)。实验中一抗浓度1∶200,二抗浓度1∶3 000。
1.2.3.1 免疫印迹法检测肺组织SPA蛋白表达
用蛋白裂解液提取肺组织蛋白并测浓度,行聚丙烯酰胺凝胶电泳,然后将蛋白转印至聚偏二氟乙烯(PVDF)膜。PVDF膜用封闭液(脱脂奶粉溶于0.1%TBST(Tween-20 Tris缓冲液)中,终浓度5%)封闭4℃过夜,一抗4℃过夜,TBST漂洗PVDF膜3次,每次10 min,再加二抗室温孵育1 h,TBST洗3次,每次10 min。将化学发光剂、增强剂按1∶1比例配成应用液滴于膜上,共育5 min后暗室曝光2 min,取出冲洗,结果扫描入计算机,用Quantity One软件进行分析。以对照组条带灰度定为基础值,各组条带灰度值与其之比作为SPA相对值。
1.2.3.2 SPA mRNA的提取及检测 提取肺组织总RNA,行逆转录-聚合酶链反应(RT-PCR)扩增SPA目的片段,引物序列(上海生工生物技术公司代理合成):SPA上游引物,5'-GGAAGCCCTGGGATCCCTGGA -3',下游引物,5'- TGGGTACCAGTTGGTGTAGT-3',扩增片段长度539 bp;3-磷酸甘油醛脱氢酶(GAPDH)上 游 引 物,5'-ACCATCTTCCAGGAGCGAGATC-3',下游引物,5'-GCCATCCACAGTCTTCTGAGT-3',扩增片段长度348 bp。先合成cDNA第1链,然后行PCR反应:在PCR反应管中依次加入无菌水 34.5 μl、cDNA 3.0 μl、10 × PCR buffer 5 μl、dNTPs(每种 0.25 μl,浓度 mmol/L)1.0 μl、上下游引物各3.0 μl(终浓度 0.5 μmol/L),混匀后稍离心,置95℃ 5 min后立即冰浴;加0.5 μl DNA聚合酶混匀离心,95℃变性30 s,56℃退火30 s,72℃延伸60 s,循环28次后72℃延伸10 min。分别取SPA扩增产物10 μl与等量GAPDH扩增产物混合,加10×加样缓冲液4 μl,于1.5%琼脂糖凝胶电泳,用UVI凝胶图像扫描仪分析,比较每个样本SPA DNA与相应GAPDH DNA扩增条带光密度,其比值作为SPA mRNA水平的相对值。
1.3 统计学分析 本研究结果采用SPSS11.0软件进行统计。实验数据以±s表示,实验结果比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠呼吸生理指标及动脉血气分析结果 与对照组比较,栓塞组大鼠肺栓塞后24 h肺动脉平均压显著升高、动脉血PO2显著下降,心率、呼吸频率、动脉血PCO2、pH变化不明显,见表1。
2.2 大鼠肺组织病理及电镜观察结果 光学显微镜下,正常组大鼠肺泡结构排列整齐(图1A);栓塞组大鼠多个肺动脉腔内有海绵明胶栓塞,其中网罗有红、白细胞,纤维蛋白等,可见继发红血栓形成(图1B)。所有肺栓塞后大鼠肺组织均有不同程度充血、水肿,肺泡间隔增厚,炎性细胞浸润明显,肺泡腔内巨噬细胞明显增多。电镜下,对照组大鼠肺泡Ⅱ型上皮细胞形态规则,线粒体、内质网等细胞器丰富,板层小体排列整齐;肺泡表面活性物质层连续完整(图2A);肺栓塞后大鼠Ⅱ型上皮细胞形态欠规则,线立体肿胀、嵴断裂,板层小体空泡化,肺泡表面活性物质层连续性中断(图2B)。
表12组大鼠肺动脉压、心率、呼吸频率、动脉血气分析结果及比较(±s,n=8)Tab 1 Comparison of pulmonary artery pressure,heart rate,respiratory rate and blood gas analysis between 2 groups(±s,n=8)

表12组大鼠肺动脉压、心率、呼吸频率、动脉血气分析结果及比较(±s,n=8)Tab 1 Comparison of pulmonary artery pressure,heart rate,respiratory rate and blood gas analysis between 2 groups(±s,n=8)
组别 肺动脉压/mmHg 心率(次/min) 呼吸(次/min) PaO2/mmHg PaCO2/mmHg对照组 14.2 ±4.1 415.0 ±15.2 81.0 ±1.7 94.1 ±8.8 43.9 ±2.8栓塞组 26.1 ±7.5 451.4 ±34.8 80.6 ±2.5 80.5 ±5.8 42.5 ±3.2 t值 3.60 1.33 1.46 2.98 2.05 P值0.04 0.05 0.30 0.04 0.28
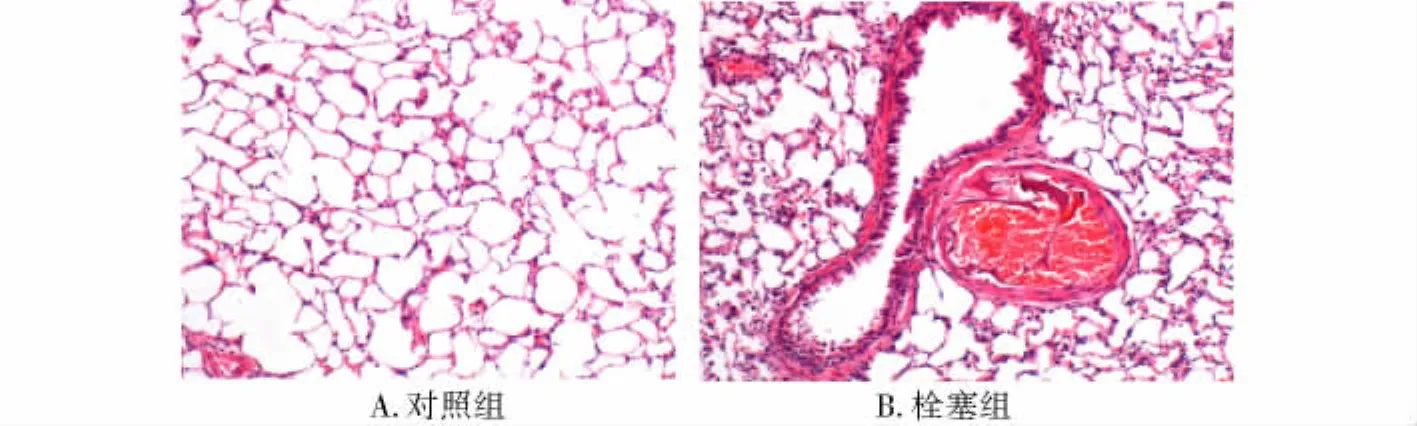
图1 光镜下大鼠肺组织病理变化(HE,×100)Fig 1 Pathological changes of lung tissues under microscope(HE,×100)

图2 电镜下大鼠肺泡Ⅱ型上皮细胞形态(×8 000)Fig 2 Morphology of typeⅡ pneumonocytes in rats under electromicroscope(×8 000)
2.3 大鼠BALF磷脂、肺组织SPA mRNA及蛋白表达水平变化 与对照组比较,栓塞组大鼠BALF磷脂(mg/100 ml)水平显著下降,肺组织SPA mRNA(SPA/GADPH)、SPA蛋白(SPA/C)表达均显著降低(P<0.05,见表2)。
表22组大鼠BALF磷脂、肺组织SPA mRNA及蛋白表达水平比较(±s)Tab 2Comparison of phospholipid in BALF,expression of SPA mRNA and protein in lung tissue between 2 groups(±s)
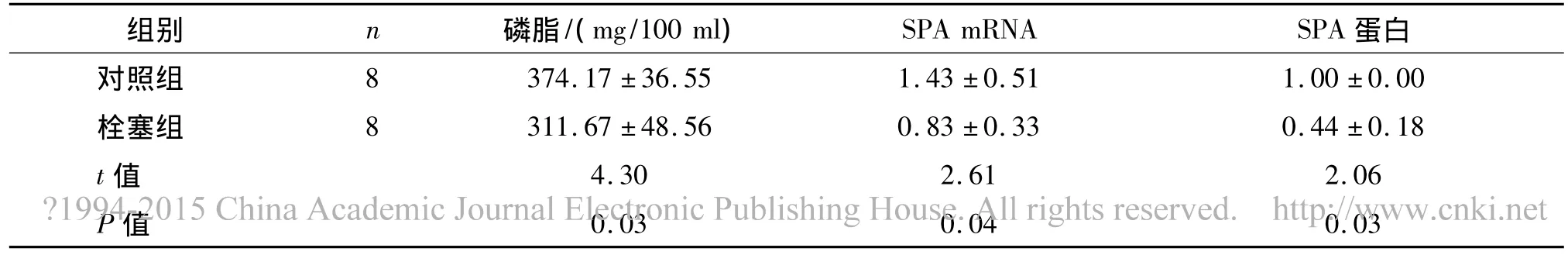
表22组大鼠BALF磷脂、肺组织SPA mRNA及蛋白表达水平比较(±s)Tab 2Comparison of phospholipid in BALF,expression of SPA mRNA and protein in lung tissue between 2 groups(±s)
组别 n 磷脂/(mg/100 ml) SPA mRNA SPA 蛋白对照组374.17 ±36.55 1.43 ±0.51 1.00 ±0.00栓塞组 8 311.67 ±48.56 0.83 ±0.33 0.44 ±0.18 t值 4.30 2.61 2.06 P值80.03 0.04 0.03
3 讨论
肺表面活性物质是由磷脂和特异性蛋白组成的复合物,在降低肺泡气液面表面张力、维持肺泡稳定性方面起着重要作用。肺表面活性物质是在肺泡Ⅱ型细胞内网状结构内合成,通过高尔基复合体转运到板层小体中贮存,然后经胞吐作用分泌到肺泡腔,转变为管状髓磷脂,最终在SPs作用下形成吸附在肺泡表面的分子膜,发挥生理功能[2]。因此,Ⅱ型上皮细胞功能正常在维持肺泡张力中至关重要,同时,肺表面活性物质的变化也可反映Ⅱ型上皮细胞功能的改变。
既往国外学者曾通过结扎动物肺动脉的方法观察肺动脉血流阻断后肺表面张力和表面活性磷脂的变化。结果显示,急性肺栓塞后有肺栓塞区域肺最小表面张力的升高及肺表面活性磷脂合成的减少,从而可导致肺不张[3,4]。Wilson 等[5]曾研究了 21例既往没有心肺疾患的急性肺栓塞患者低氧血症的原因,发现几乎所有患者的低氧血症都可用“分流样”效应解释。他们推测肺栓塞后由于血流的部分或完全中断,引起肺表面活性物质的改变,造成肺不张;或因为梗死区发生自发性纤溶和再通,自发性纤溶清除栓子的速度快于局部肺泡表面活性物质恢复的速度,因而也会造成肺不张及分流。以上研究均支持肺泡表面活性物质减少所致肺不张、肺内分流引起急性肺栓塞呼吸困难机制。
尽管Ⅱ型肺泡上皮细胞在肺表面活性物质代谢中的作用至关重要,但尚没有文献报道急性肺栓塞情况下Ⅱ型肺泡上皮细胞的变化。在此基础上,本研究观察了急性肺栓塞大鼠Ⅱ型肺泡上皮细胞功能及形态的改变。本研究结果显示,急性肺栓塞后24 h大鼠肺泡Ⅱ型上皮细胞形态变得不规则,线粒体肿胀、嵴断裂,板层小体空泡化,肺泡表面活性物质层连续性中断,同时其功能也发生明显变化,表现为BALF中总磷脂与肺组织SPA mRNA及蛋白一致性下降,说明急性肺栓塞时Ⅱ型肺泡上皮细胞形态及功能均发生明显变化,导致肺表面活性物质明显减少。Ⅱ型肺泡上皮细胞变化的主要原因考虑是由于肺动脉栓塞、肺组织血流中断导致Ⅱ型肺泡上皮细胞缺血、缺氧,功能下降或消失所致。当然,肺表面活性物质的减少还可能存在其他原因,如灭活增加、巨噬细胞吞噬增加以及消耗增加等[5,6],但Ⅱ型肺泡上皮细胞功能损伤所致肺表面活性物质的产生减少可能在肺栓塞动脉低氧血症、呼吸困难发生中起更为重要的作用。
本研究结果提示,肺泡Ⅱ型上皮细胞形态及功能改变在急性肺栓塞病理生理中起着重要作用。
[1] 刘春萍,吴郡,刘伟国,等.急性肺栓塞大鼠血清血管紧张素转换酶I的变化[J].中华老年心脑血管病杂志,2007,9(10):700-702.
[2] Andreeva AV,Kutuzov MA,Voyno-Yasenetskaya TA.Regulation of surfactant secretion in alveolar type Ⅱ cells[J].Am J Physiol Lung Cell Mol Physiol,2007,293(2):L259 -271.
[3] Finley TN,Tooley WH,Swenson EW,et al.Pulmonary surface tension in experimental atelectasis[J].Am Rev Respir Dis,1964,89:372-374.
[4] Sutnick AI,Soloff LA.Pulmonary arterial occlusion and surfactant production in humans[J].Ann Intern Med,1967,67:549 -551.
[5] Wilson JE,Pierce AK,Johnson RL,et al.Hypoxemia in pulmonary embolism,a clinical study[J].J Clin Invest,1971,50:481 - 491.
[6] Doyle IR,Nicholas TE,Bersten AD.Serum surfactant protein-A levels in patients with acute cardiogenic pulmonary edema and adult respiratory distress syndrome[J].Am J Respir Crit Care Med,1995,152:307 -317.
[7] Tussio A,Alberti A,Armanini D,et al.Different pathways of degradation of SP-A and saturated phosphatidylcholine by alveolar macrophages[J].Am J Physiol,2000,279:L91 - L99.
Morphological and functional changes of typeⅡpneumonocytes in rats after acute pulmonary embolism
LIU Chun-ping1*,CUI Jun-yu1,CHEN Hang-wei2,TAO Ran3,ZHANG Li-hua4,LU Wei-xuan5(1Dept of Cardiovascular Disease,Military General Hospital of Beijing PLA,Beijing 100700,China;2Dept of Respiratory,Military General Hospital of Beijing PLA;3Mental Health Center,Military General Hospital of Beijing PLA;4Forth People’s Hospital of Panjing City;5Dept of Respiratory,Peking Union Hospital;*Corresponding author,E-mail:liuchunpingcn@yahoo.com.cn)
ObjectiveTo explore the changes of morphology and function of typeⅡpneumonocytes in rats with acute pulmonary embolism.MethodsSixteen male SD rats were randomized into control group(n=8)and embolism group(n=8).The rats were injected with medical gelfoam microspheres via jugular vein to induce PE model in embolism group,while in control group the rats were injected with saline instead of gelfoam granule solution.They were sacrificed at 24 h after establishing PE model.Pulmonary artery pressure,heart rate and respiratory rate were detected by right heart catheterization and artery blood gas was analyzed at 24 h.Bronchoalveolar lavage fluid(BALF)was collected for detecting the levels of phospholipid.Lung tissue was dyed with HE and the morphology of typeⅡ pneumonocytes was observed under electric microscope.RT-PCR and Western blot were used to study the expression of SPA mRNA and SPA protein in lung tissues.ResultsThe mean pulmonary pressure and artery oxygen blood pressure were significantly different between control group and embolism group[(14.2 ±4.1)mmHgvs(26.1 ±7.52)mmHg,P<0.05;(94.1 ±8.8)mmHgvs(80.5 ±5.8)mmHg,P<0.05].The levels of phospholipid in BALF were(374.17 ±36.55)mg/100 ml and 311.67 ± 48.56)mg/100 ml in control group and embolism group,respectively(P<0.05).The expression of SPA mRNA and protein was significantly lower in embolism group than in control group(0.83 ±0.33vs1.43 ±0.51,P<0.05;0.44 ±0.18vs1.00 ±0.00,P<0.05).At 24 h,pulmonary arteries were seen emboliation with gelfoam under microscope.The microvillus of type Ⅱ pneumocytes reduced and desquamated under eletromicroscope,the mitochondria was bulged with fractured ridge and irregular empty lamina bodies,and the continuity of surfactant layer was interrupted.ConclusionThe morphology and function of typeⅡpneumonocytes are changed significantly in acute pulmonary embolism rats,with decreased production of surfactant,which may play an important role in hypoxemia of pulmonary embolism.
pulmonary embolism;rats;typeⅡpneumonocyte
R563.5
A
1007 -6611(2011)01 -0029 -04
10.3969/J.ISSN.1007 -6611.2011.01.008
刘春萍,女,1967-11生,博士,副主任医师.
2010-10-18]

