二维液相色谱法测定卷烟主流烟气中的间-苯二酚及其他酚类化合物
颜权平,王丁丽,赵阁,郭吉兆,谢复炜
中国烟草总公司郑州烟草研究院烟草行业烟草化学重点实验室,郑州高新技术产业开发区枫杨街2号450001
近10年来,高效液相色谱(HPLC)法在卷烟主流烟气中酚类化合物主要是邻-苯二酚、间-苯二酚、对-苯二酚、苯酚、邻-甲酚、间-甲酚和对-甲酚的分析中得到了广泛的应用[1-3],YC/T 255—2008[4]也规定采用此法测定。然而,由于卷烟主流烟气中间-苯二酚的含量较低,同时又有其他物质干扰,不能对卷烟主流烟气中间-苯二酚进行准确定量。二维液相色谱[5]是将分离机理不同而又相互独立的两支色谱柱串联起来构成的分离系统,完全正交的二维液相色谱的峰容量是两种一维分离模式单独运行时峰容量的乘积[6-7]。Dugo等[8]利用二维液相色谱系统分析了红酒中的多酚类物质,与一维液相色谱相比,分析时间减少,分离能力大大增加;Cacciola等[9]利用二维液相色谱系统分析了啤酒和红酒中的酚酸类和黄酮类的抗氧化剂物质,共分离了24种酚酸类和黄酮类物质,扩大了分析对象,提高了方法的分析能力。而有关二维液相色谱法测定卷烟主流烟气中的酚类化合物鲜见报道,因此进行本研究,旨在为卷烟主流烟气中这7种酚类化合物的准确定量提供一种新的方法。
1 材料与方法
1.1 仪器和试剂
醋酸(色谱纯),苯酚,对、邻、间-苯二酚,对、间、邻-甲酚(纯度>99.5%)(Chem servie);乙腈(色谱纯,Dikma化学试剂公司);超纯水(电阻率≥18.2MΩ·cm)。
Agilent 1200高效液相色谱仪(美国Agilent公司),配备自动进样器、柱温箱(配备六通阀)、荧光检测器;SM450直线型吸烟机(英国Cerulean公司);CP224S电子天平(感量:0.000l g,德国Sartorius公司);KQ-700DE型超声波振荡器(昆山舒美公司);Milli-Q超纯水系统(美国Millipore公司)。
1.2 样品处理与分析
将卷烟样品在(22±1)℃和相对湿度(60±2)%条件下平衡48 h,用SM450吸烟机按照YC/T 29—1996规定的条件抽吸卷烟,每个孔道抽吸4支烟,用剑桥滤片捕集卷烟主流烟气。吸毕,取出滤片。将l张捕集烟气粒相物的剑桥滤片折叠,放入100 mL锥形瓶中,加入50 mL l%(体积分数)醋酸水溶液,室温下超声萃取20 min,静置5 min。取2 mL萃取液,用0.45 μm微孔滤膜过滤,滤液取样进行LC×LC分析。分析流程如图1。当柱切换阀处于位置1时,样品在色谱柱1上进行前期分离。样品收集环连同色谱柱2用10%乙腈水溶液进行平衡冲洗;当阀切换至位置2时,把一维分离中的某一时间段的分离组分切换至200 μL的样品收集环进行收集;当阀再次处于位置1时,色谱分析系统泵2的流动相将收集在样品收集环中的组分反冲至色谱柱2,进行下一步的色谱分离。
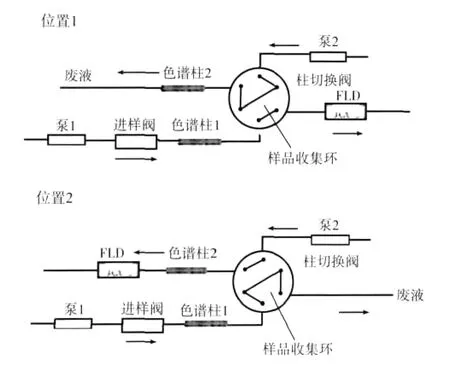
图1 二维液相色谱分析流程
一维色谱条件为:色谱柱:AgilentXDB-C18(50 mm×4.6 mm,1.8 μm)柱;流动相:1%冰醋酸水溶液(A)、乙腈(B);梯度洗脱:0 min,10%B;1 min,35%B;4 min,35%B;8 min,80%B;12 min,80%B;15 min,10%B;20 min,10%B;柱温:30℃;柱流速:0.5 mL/min;进样量:10 μL;检测波长:Ex=275 nm,Em=315 nm;中心切割时间:2.9~3.3 min;二维色谱条件为:色谱柱:Zorbax CN(4.6 mm×250 mm,5 μm)柱;流动相:10∶90乙腈水溶液;等度洗脱:流速1 mL/min;检测波长:同一维色谱。
采用与标样比较保留时间法定性,外标工作曲线法定量。
2 结果与讨论
2.1 中心切割时间的确定
在YC/T 255—2008规定的条件下,卷烟主流烟气中的间-苯二酚不能与干扰物完全分离,而二维液相色谱系统将一维色谱分离时间-苯二酚与干扰物质一起切换至第二维色谱柱,通过第二维色谱柱将其分离以进行准确定量,并对卷烟样品主流烟气中的其他酚类化合物进行了分析测定。结果(图2)显示,在第一维色谱柱分离时,对于标准样品,除对、间-甲酚不能基线分离外,其他几种酚类物质都能够达到基线分离,但对于卷烟样品,对、间-甲酚,间-苯二酚都不能达到很好的基线分离。标准样品间-苯二酚的保留时间为3.14 min,卷烟样品中间-苯二酚与其干扰物的出峰时间从2.75~3.75 min,根据标准样品的保留时间和卷烟样品中干扰物的保留时间,确定中心切割的时间为2.9~3.3 min。

图2 标准样品和烟气样品的一维HPLC图
2.2 第二维色谱柱的选择
对于二维液相色谱系统来说,第二维色谱柱是影响二维色谱系统分离能力的关键因素,主要考察了3种不同柱填料的色谱柱:C8柱(Zorbax SB-C84.6 mm×150 mm,5 μm)、苯基柱(Zorbax SB-Phenyl 2.1 mm×150 mm,5 μm)和氰基柱(Zorbax CN 4.6 mm×250 mm,5 μm)对间-苯二酚与其干扰物的分离效果,结果见图3。从图3可以发现,当第二维色谱柱采用C8和苯基柱时,卷烟主流烟气中的间-苯二酚与其它干扰物都不能达到基线分离,而当第二维色谱柱采用氰基柱时,样品中的间-苯二酚和干扰物能够达到基线分离,考虑到目标分析物的分离效果,选用氰基柱作第二维色谱柱。
2.3 第二维色谱流动相的确定

图3 间-苯二酚在不同的二维色谱柱上的HPLC图
考虑到方法的简便性,第二维色谱柱主要采用水和乙腈等度洗脱,在流速1 mL/min,Ex=275 nm和Em=315 nm条件下,以卷烟样品主流烟气中的酚类化合物为对象,考察了4种不同比例流动相[乙腈∶水(体积比)=5∶95,10∶90,15∶85,20∶80]的色谱分离情况。结果(图4)表明,当用10∶90乙腈水溶液作流动相时,卷烟样品主流烟气中间-苯二酚能够与干扰物质达到很好的基线分离,因此,选择10∶90乙腈水溶液作第二维色谱柱的流动相。
2.4 中心切割的稳定性
为了考察二维液相色谱系统的稳定性,通过六通阀在2.9~3.4 min时间段对标准样品和实际卷烟烟气样品进行了连续10次中心切割和二维HPLC分离试验。结果表明,对于同一个标准样品,其间-苯二酚峰面积的RSD为1.16%,保留时间的RSD为0.16%;对于同一个卷烟烟气样品,其间-苯二酚峰面积的RSD为1.06%,保留时间的RSD为0.11%。这说明,本二维液相色谱系统能够对卷烟样品中间-苯二酚进行稳定的中心切割分离。

图4 间-苯二酚在第二维色谱柱4种流动相下的HPLC图
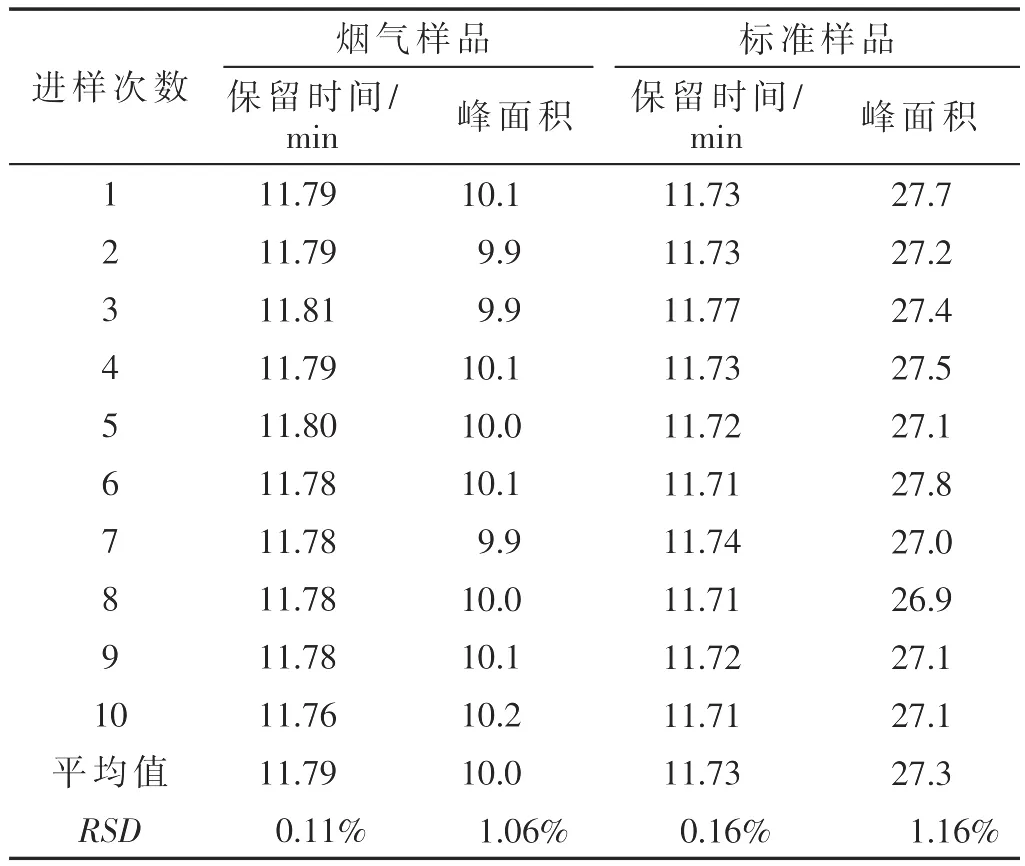
表1 同一标准样品和烟气样品连续10次中心切割和二维HPLC分离的间-苯二酚的保留时间、峰面积及其RSD
2.5 工作曲线与检测限
准确称取100 mg邻-苯二酚、对-苯二酚、苯酚,50 mg邻-甲酚、间-甲酚,20 mg的间-苯二酚,置于同一只烧杯中,加入30 mL 1%乙酸水溶液,待完全溶解后,转移到100 mL棕色容量瓶中,用1%乙酸水溶液定容,得到7种酚的标准样品混合物的储备溶液。取10.00 mL储备溶液,用1%乙酸水溶液稀释至100 mL,得一级标准溶液。再取10 mL一级标准溶液,用1%乙酸水溶液稀释至100 mL,得到二级标准溶液。移取1,2,5 mL二级标准溶液,1,2 mL一级标准溶液,分别用1%乙酸水溶液稀释至50 mL,得5个标准溶液。对5个标准溶液和二级标准溶液分别进行二维HPLC分析,并以酚类化合物的积分峰面积对其浓度进行回归分析,得7种酚类化合物的标准曲线方程(表2)。将最低浓度的标准溶液平行测定10次,将其测定结果标准偏差的3倍作为测定方法的检测限,10倍作为测定方法的定量限(表2)。7种酚类成分的检测限均在ng级的水平,远远低于卷烟烟气中酚类成分的释放量[3]。
2.6 回收率与精密度
在已知释放量(5次平行测定的平均值)的卷烟烟气样品中添加3个浓度水平的酚类标准样品混合物,然后分别进行二维HPLC测定,并根据已知量、加标量和加标后测定量计算各酚的回收率,结果见表3。由表3可见,卷烟烟气中酚类化合物的回收率在97.8%~100.2%之间,说明本方法对卷烟烟气中这些酚类成分的测定较为准确。
采用本方法对同种样品一天内平行测定5次,得到了日内精密度(表4);对同一样品连续测定5 d,得到了日间精密度(表5)。由此可见,7种酚类化合物的日内和日间RSD均小于5.5%,说明本方法的重复性较好。
2.7 部分卷烟样品烟气中7种酚的释放量
采用本方法和行业标准方法[13]分别测定了2R4F,3R4F 2种参考卷烟和10种国产商品卷烟(5种混合型卷烟和5种烤烟型卷烟)主流烟气中的7种主要酚类化合物的释放量,结果见表6。由此可见,本方法测定的2R4F卷烟间-苯二酚的释放量比该行业标准方法的测定值低,也低于Moldoveanu[14]利用HPLC-FLD法测定值0.84 μg/支,可能是该行业标准方法和Moldoveanu方法都不能使间-苯二酚与干扰物质达到基线分离造成的。其他6种酚类化合物释放量的测定值2种方法比较接近。
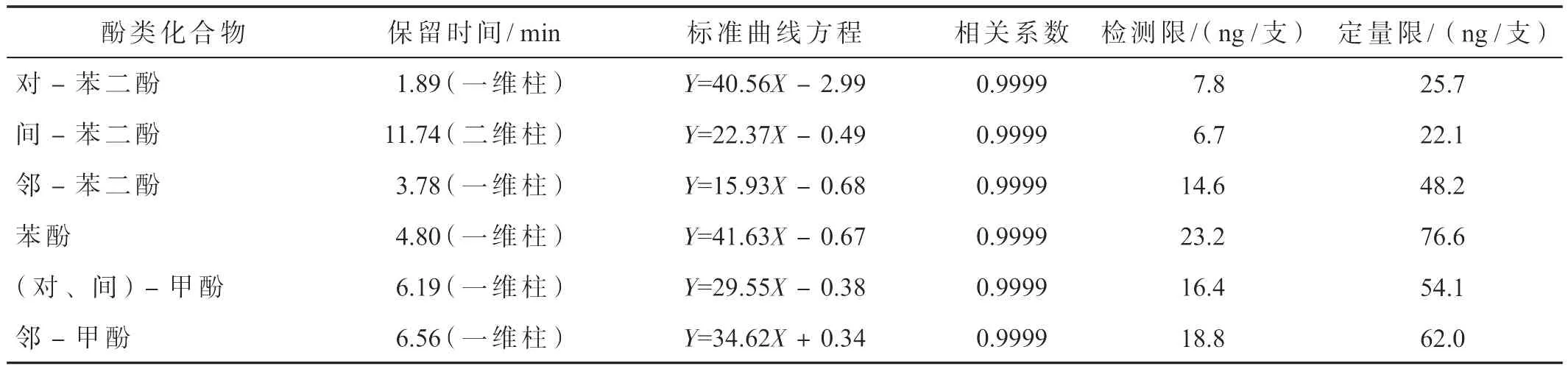
表2 方法的标准曲线、检测限

表4 酚类化合物日内检测值及其精密度(n=5)(μg/支)
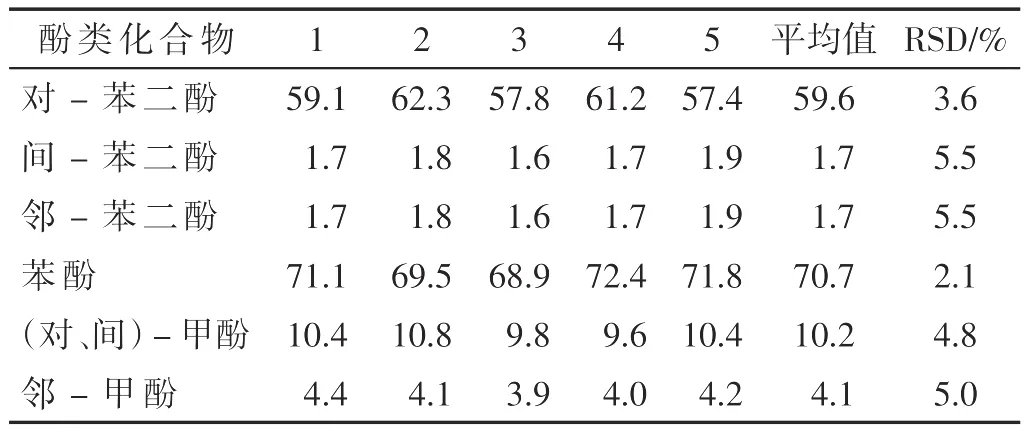
表5 酚类化合物日间检测值及其精密度(n=5)(μg/支)

表6 本方法和标准法测定的2种参考卷烟和部分商品卷烟样品主流烟气中酚类化合物的释放量(μg/支)
3 结论
建立了中心切割二维液相色谱测定卷烟主流烟气中的主要酚类化合物的方法;本方法能够实现间-苯二酚与干扰物质的有效分离,与行业标准方法相比,能够准确定量卷烟主流烟气中的间-苯二酚,同时不影响其它酚类物质的准确测定。
[1]Jeanty G,Masse J,Bercot P.Quantitative analysis of cigarette smoke condensate monophenols by reverse-phase high performance liquid chromatography[J].Beitr Tabakforsch Int,1984,12:245-250.
[2]CharlesHR,SheilaLC.Ahighperformanceliquid chromatographicdeterminationofmajorphenoliccompounds in tobacco smoke[J].J Chromatogr Sci,1990,28:239-244.
[3]谢复炜,赵明月,王,等.卷烟主流、侧流烟气中酚类化合物的高效液相色谱测定[J].烟草科技,2004(5):6-10.
[4]YC/T 255—2008卷烟主流烟气中主要酚类化合物的测定高效液相色谱法[S].
[5]OpiteckGJ,JorgensonJW.Two-dimensionalSEC/RPLC coupled to mass spectrometry for the analysis of peptides[J].Anal Chem,1997,69:2283-2291.
[6]DavisJM,GiddingsJC.Statisticaltheoryofcomponent overlapinmulticomponentchromatograms[J].AnalChem,1983,55:418-424.
[7]Giddings J C.Concepts and comparisons in multidimensional separation[J].J High Resolut Chromatogr,1987,10(5):319-323.
[8]Dugo P,Cacciola F,Donato P,et al.Comprehensive twodimensional liquid chromatography to quantify polyphenols in red wines[J].J Chromatogr A,2009,1216:7483-7487.
[9]Cacciola F,Jandera P,Hajdu Z,et al.Comprehensive twodimensional liquid chromatography with parallel gradients for separationofphenolicandflavoneantioxidants[J].J Chromatogr A,2007,1149:73-87.
[10]MoldoveanuSC,KiserM.Gaschromatography/mass spectrometryversusliquidchromatography/fluorescence detection in the analysis of phenols in mainstream cigarette smoke[J].J Chromatogr A,2007,1141:90-97.

