打顶及仿生信号分子对烟草氧化胁迫的影响
张新华,姚忠达,陈常伟,查向东,程新胜*
1.中国科学技术大学烟草与健康研究中心,合肥市徽州大道1129号230052
2.安徽大学生命科学学院,合肥市肥西路3号230039
3.安徽中烟工业公司技术中心,合肥市天达路9号230088
植物在受到昆虫伤害或其他机械性创伤时其组织内可诱发大量活性氧积聚,使植株形成氧化胁迫[1],并激活以茉莉酸(Jasmonic acid,JA)为主要信号分子的抗性反应[2],使碳水化合物的分配路径、次生代谢产物的形成发生变化,促使大量抗生性物质积累。打顶是烟草生产上一项提高烟叶产量、质量的重要技术措施[3],关于打顶对烟叶的影响已有大量研究[4-7],但打顶对烟草来说也是一种机械性损伤,这种损伤对此生长时期的烟草植株产生氧化胁迫尚未见报道。另外,一些取食烟草的寡食性昆虫(如烟青虫Heliothis assulta Guenee)通过下唇腺分泌特异性酶,抑制创伤信号分子的积累和传递,从而降低其取食对烟株的刺激,减少烟碱合成与传递[8-9]。黄兰等[10]选取由昆虫下唇腺特异性酶产生的与创伤信号相颉抗的仿生型信号分子BSM(Bionics Signal Molecule),在烟草打项后将其涂抹在打顶烟株创伤端面,可以降低烟草生物碱的含量。为此,进行了打顶后一定时期内烟草植株的氧化胁迫反应以及BSM对烟草这一氧化胁迫的抑制效应研究。
1 材料和方法
1.1 供试材料
供试品种为白肋烟鄂烟1号(Nicotiana tabacum cv.Eyanyihao),2010年在中国科学技术大学南区实验基地种植。采用温室盆栽,盆高35 cm,直径25 cm,每盆装过筛风干土至2/3处,施氮量为64 g/株,按N∶P∶K=1∶1.5∶2.5施用烟草专用复合肥。
1.2 仪器与试剂
756P型紫外-可见分光光度计(上海光谱仪器有限公司)、超声仪(Autoscience公司)、FA1004电子天平(上海天平仪器厂)、TGL-20G高速冷冻离心机(上海安亭科学仪器厂)、pHS-3C型精密pH计(上海雷磁仪器厂);HH-8电热恒温水浴锅(深圳国华仪器厂)、SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司)、Olympus SP-560UZ数码相机。
3,3′-二氨基联苯胺(DAB,上海晶纯试剂有限公司);氮蓝四唑(NBT,Sigma公司);盐酸羟胺(AR,上海化学试剂厂);α-萘胺(CP,上海泗联化工厂);对氨基苯磺酸(AR,国营上海化学试剂厂);聚乙烯毗咯烷酮(PVP,国药集团化学试剂有限公司);EDTA-Na2(CP,中国上海试剂一厂);核黄素(BR,上海化学试剂厂);水合氯醛(AR)、硫代巴比妥酸(BR)、三氯乙酸、甲硫氨酸(BR)(中国医药上海化学试剂公司)。
1.3 试验处理
设置对照(CK)、处理1(T1,常规打顶)与处理2(T2,常规打顶+涂抹BSM)3个处理。其中T2处理组中,BSM的浓度是1.0 mol/L,打顶后立即用中号羊毫蘸取约0.25 mL BSM涂抹于处理株伤口端面。每株烟打顶后的总留叶数为20片,每组处理均取10株烟苗分别挂牌标记。在打顶后3,6,12,24,48 h采摘第18叶(从上至下数)测定超氧阴离子(O2-·)、过氧化氢(H2O2)含量;打顶后2,4,6,8和10 d采摘第19叶测定超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。
1.4 样品处理与生化分析
参照王爱国等[11]的方法测定O2-·含量:在采集的烟叶上用打孔器取直径为6 mm小圆片,称取1 g,放入50 mL烧杯中,并加入10 mmol/L盐酸羟胺5 mL,真空渗入10 min后,将烧杯置于30℃温箱中温育45 min。温育结束后,从样品试管中吸取2mL溶液,与1 mL 17 mmol/L对氨基苯磺酸和1 mL 7 mmol/L α-萘胺混合,显色反应10 min。测定530 nm下样品的吸光度,根据标准曲线得出吸光度与O2-·含量满足:CO2-·=(2×A530-0.0286)/0.0215。
参照文献[12]对H2O2进行活体组织化学原位检测:取上部叶,用双蒸水洗3次,在叶片前端叶脉两侧(避免取叶脉)剪下直径4 cm烟叶圆片,取酸化的1 mg/mL DAB溶液15 mL,混合后反应8 h。然后取出叶圆片,将其固定并在95%乙醇中煮沸10 min,然后取出在95%乙醇中洗涤3次,观察叶片上枯斑并用数码相机拍照。
丙二醛(MDA)含量分析:参照文献[13]并稍作改进,将采取叶片去叶脉,取鲜重0.5 g,置于预冷研钵中,加入2 mL 0.05 mol/L pH7.8的磷酸缓冲液和少量石英砂研磨、匀浆后,定容到10 mL刻度试管中。取5 mL于刻度试管中在16000 r/min下离心15 min,上清液即为样品提取液,5℃下保存备用。取5 mL试管分别加入1.5 mL粗酶液,2.5 mL,0.5%硫代巴比妥酸的5%三氯乙酸溶液,混匀物于沸水浴上加热15 min,迅速冷却后,再离心。取上清液测定532和600 nm波长下的吸光度值。
MDA的浓度公式:C=[(A532-A600)×A×V/a]/0.155×W
式中:A——反应液总量;V——提取液总量;a——反应液中的提取液数量;W——植物样品重量。
SOD活性测定[14]:取烟草叶片(去叶脉)0.5 g于预冷的研钵中,使溶液终体积为10 mL。取4 mL于18000 r/min下离心20 min,上清液即为SOD粗提液。分别加入1.5 mL 0.05 mol/L磷酸缓冲液,0.3 mL 130 mmol/L Met溶液,0.3 mL 750 μmol/L NBT溶液,0.3 mL 100 μmol/L EDTA-Na2液,0.3 mL 20 μmol/L核黄素0.1 mL酶液,0.5 mL蒸馏水。混匀后将1支对照管置暗处,其他各管于30℃4000 Lx日光下反应30 min。分别测定其在560 nm处的吸光度值。已知SOD活性单位以抑制NBT光化还原的50%为一个酶活性单位表示,计算SOD活性。
SOD总活性=(Ack-AE)×V/(Ack×0.5×W×Vt)
式中:Ack——照光对照管的吸光度;AE——样品管的吸光度;V——样品液总体积(mL);Vt——测定时样品用量(mL);W——样鲜重(g)。
1.5 数据处理
采用Excel,Matlab7.0软件进行Stdev分析。
2 结果与分析
2.1 打顶与BSM对白肋烟中超氧阴离子含量的影响
图1结果表明,对照烟叶中活性氧含量在48 h内变化基本平稳。打顶T1处理能诱导植物叶片产生大量活性氧,以打顶后3 h的O2-·含量最高,明显高于CK与T2处理,之后渐趋下降,在24 h后其含量快速下降,到48 h O2-·含量接近其他两个处理。T2处理叶片中O2-·的含量一直介于CK与T1处理之间,但在检测时间内其变化趋势与CK及T1不同:在3 h后仍呈上升趋势,12 h后呈明显下降趋势,至48 h O2-·含量与其他两处理接近。
2.2 打顶及BSM对白肋烟H2O2含量的影响

图1 打顶及BSM对白肋烟O2-·含量的影响Fig.1 The effects on burley tobacco O2-·content by topping and BSM
二氨基联苯胺(DAB,3,3′-diaminobenzidine)在H2O2的存在下失去电子而呈现出颜色变化和积累,形成棕褐色沉淀[15],叶片上褐色面积与组织中H2O2含量呈正相关。图2结果表明,在5个不同时间段的样品中,总体上均呈现出T1处理的褐斑面积大或颜色最深,表明其组织中的H2O2明显高于CK与T2处理,并以打顶后6 h的褐色沉淀斑点最显著;而CK 5个时间段的样品上,叶片中褐色沉淀斑点变化不明显且斑点面积最少;而打顶后涂抹BSM的T2处理,在5个时间段中,除48 h外,其他时间段内其叶片上褐色斑面积与CK差异不明显,且5个时间段样品上的色斑明显小于T1处理。表明打顶后烟草的叶片组织内迅速积累了H2O2,而涂抹BSM降低了H2O2的积聚。
2.3 打顶与BSM对白肋烟MDA含量的影响
MDA是细胞膜脂过氧化的最终分解产物,其含量代表着氧化胁迫对叶片细胞膜脂质双分子层过氧化的程度[14]。从图3可见,不打顶的CK,从第2天至第10天叶片中MDA含量稍有增加但变化平缓;T1处理中的MDA高于CK与T2处理,且在2~10 d内叶片中MDA含量变化不明显;T2处理中,在第2天的MDA含量最高,大大高于CK但仍低于T1处理,且随着时间的推移呈明显下降趋势,至第10天时,MDA含量达到最低。总体来看,打顶使烟株组织细胞膜发生了过氧化反应形成了MDA的积累,但BSM处理能显著降低叶片中MDA的含量。

图2 不同处理对白肋烟H2O2含量的影响Fig.2 The effects on burley tobacco H2O2content by different treatment
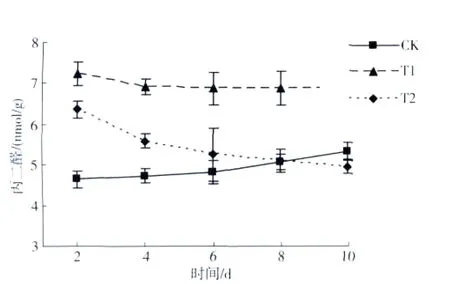
图3 不同处理中白肋烟中MDA的变化Fig.3 The effects on burley tobacco MDA content by different treatment
2.4 打顶与BSM对白肋烟SOD活性的影响
由图4可见,在不打顶条件下,测定不同时间段内白肋烟叶片中SOD活性变化不明显;而T1处理中,打顶引起了烟叶中SOD活性的明显变化,在打顶后第4天,与CK和T2处理相比,T1处理的SOD活性明显降低,随着时间的推移,T1处理叶片中SOD活性逐渐上升,到第10天,与CK和T2处理基本一致;但打顶后涂抹BSM较大幅度地提高了烟叶中SOD活性,T2处理与CK的烟叶SOD活性基本相近。

图4 不同处理白肋烟SOD活性的变化Fig.4 The effects on burley tobaccoSOD activity different treatment
3 小结与讨论
本研究结果表明,烟株打顶会导致烟草叶片在打顶后一段时间内产生并积累超氧自由基(O2-·),H2O2,其组织中SOD酶活性降低,同时MDA含量增加,说明烟草打顶这一机械损伤能使烟草植株形成氧化胁迫并且导致叶片细胞膜脂质双分子层发生过氧化反应;源于昆虫下唇腺特异性酶的BSM可以大幅度提高SOD活性,降低O2-·,·OH和H2O2含量,并且BSM还减少了MDA的含量,说明BSM可缓解打顶对烟草叶片的氧化胁迫。
内源茉莉酸可激活烟碱合成关键性酶-腐胺N-甲基转移酶(Putrescine N-methyltransferase PMT)基因的转录,诱导烟草生物碱的合成[16]。而JA这一信号分子是由亚麻酸起始的十八烷酸途径在植物体内合成的[17],即植物在发生过氧化胁迫、细胞膜发生过氧化后α-亚麻酸被释放,在质体中经脂氧合酶(LOX)、丙二烯氧合酶(AOS)和环化酶(AOC)的催化生成12-氧-植物二烯酸(12-O-PDA)进入细胞质中,在过氧化物体中经3次β-氧化形成JA[18]。在打顶后涂抹BSM使烟草叶片中生物碱含量下降,正是由于BSM在信号传导的上游通过抑制烟草植株的氧化胁迫,减少了烟草植物体内JA的合成,从而导致烟叶烟碱含量的降低。
[1]Guan L M,Scandalios J G.Hydrogen peroxide-mediated catalasegeneexpressioninresponsetowounding[J].Free Radical Bio Med,2000,28(8):1182-1190.
[2]FarmerEE,JohnsonRR,RyanCA.Regulation of expression of proteinase inhibitor gene by methyl jasmonate and jasmonic acid[J].Plant Physiol,1992,98(3):995-1002.
[3]Davis D L,Nielson M T.Tobacco production,chemistry and technology[M].Oxford:Blackwell Science,1999:120-126.
[4]苏德成.中国烟草栽培学[M].上海科学技术出版社,2005:373-375.
[5]程君奇,周群,杨春雷,等.打顶时期对白肋烟烟叶腺毛分泌物的影响[J].烟草科技,2009(9):50-54.
[6]邹焱,苏以荣.打顶及施用植物生长调节剂对烟草内源激素的影响[J].烟草科技,2008(10):50-52,57.
[7]李章海,刘登乾,田必文,等.打顶和施用NAA对烟株生长、烟碱合成和钾素吸收的影响[J].烟草科技,2008(9):52-55.
[8]华煜,林国平,黄文昌,等.仿生型信号分子对烟草硝酸盐、亚硝酸盐的抑制作用[J].烟草科技,2010(4):51-53,58.
[9]MusserRO,Hum-MusserSM,EichenseerH,etal.Herbivory:caterpillar saliva beats plant defences[J].Nature,2002,416(6881):599-600.
[10]黄兰,王正刚,舒俊生,等.仿生型信号分子对烟草主要生物碱的调控作用[J].中国烟草学报,2010,16(5):1-5.
[11]WangAG,LuoGH.Quantiativerelationbetweenthe reaction of hydroxylamine and superoxide anion radicals in plants[J].Plant Physiol Commun,1990(6):177-179.
[12]Wang C F,Huang L L,Buchenauer H,et al.Histochemical studies on the accumulation of reactive oxygen species(O2-·and H2O2)in the incompatible and compatible interaction of wheat-Puccinia striiformis f.sp.tritici[J].Physiol Mol Plant Pathol,2007,71(4-6):230-239.
[13]张宪政,陈凤玉,王荣富.植物生理学实验技术[M].辽宁科学技术出版社,1994:164-165.
[14]邹琦.植物生理学实验指导[M].北京:中国农业出版社,1994:163-164.
[15]Zhang X L,Wang P C,Song C P.Methods of detecting hydrogenperoxideinplantcells[J].ChineseBulletinof Botany.2009,44(1):103-106.
[16]Shoji T,Yamada Y,Hashimoto T.Jasmonate induction of putrescine N-methyltransferase genes in the root of nicotinana sylvestris[J].Plant Cell Physiol,2000,41(7):831-839.
[17]Sun D Y,Guo Y L,Ma L.Cellur Signal Transduction.Third edition[M].Beijing:Science press,2001:284-285.
[18]Vick B A,Zimmerman D C.The biosynthesis of jasmonic acid:Aphysiologicalroleforplantlipoxygenase[J].Biochem Biophys Res Commun,1983,111:470-477.

