西北部分地区苦马豆根瘤菌的表型多样性研究
徐 琳,龚明福,韦革宏*
(1.新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室塔里木大学生命科学学院,新疆阿拉尔 843300;2.西北农林科技大学,陕西杨凌 712100;3.河西学院生物系,甘肃张掖 734000)
根瘤菌是土壤中广泛分布的重要微生物类群,它与豆科植物的共生是固氮中效能最高的体系。近年来,对根瘤菌资源和其固氮机理的研究正在逐步广泛和深入,新的属种不断被发现[1-3]的同时,也发掘并保藏了一大批具有优秀抗逆品质的根瘤菌菌种。苦马豆广泛分布于我国西北地区,其根系发达,是优良的保土固沙植物,由于能与根瘤形成共生体,使得其抗逆能力有效提高。全世界有2种[4]苦马豆,主要分布于西亚、中亚、东亚、西伯利亚及大洋洲,我国仅产1种,为苦马豆(Sphaerophysa salsula),主要分布于我国西北干旱半干旱地区。目前对苦马豆根瘤菌的研究极少,仅有徐琳等[5]对苦马豆根瘤菌进行了多样性和系统发育研究,而对其表型多样性并未进行深入研究。本研究拟采用表型性状测定及数值分类,旨在发掘一大批具有优良性状的根瘤菌菌株,为丰富我国根瘤菌菌种资源库、探索受损生态系统恢复重建及乡土植物资源生态产业化提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株 本实验共选取根瘤菌55株,其中48株未知菌株分别来自甘肃、宁夏和新疆[5],另外7株为参比菌。未知菌株编号、宿主和地理来源见表1。
1.1.2 参比菌株 选取已知参比菌株7株(见表2),与供试菌株同时测定生理生化性状。
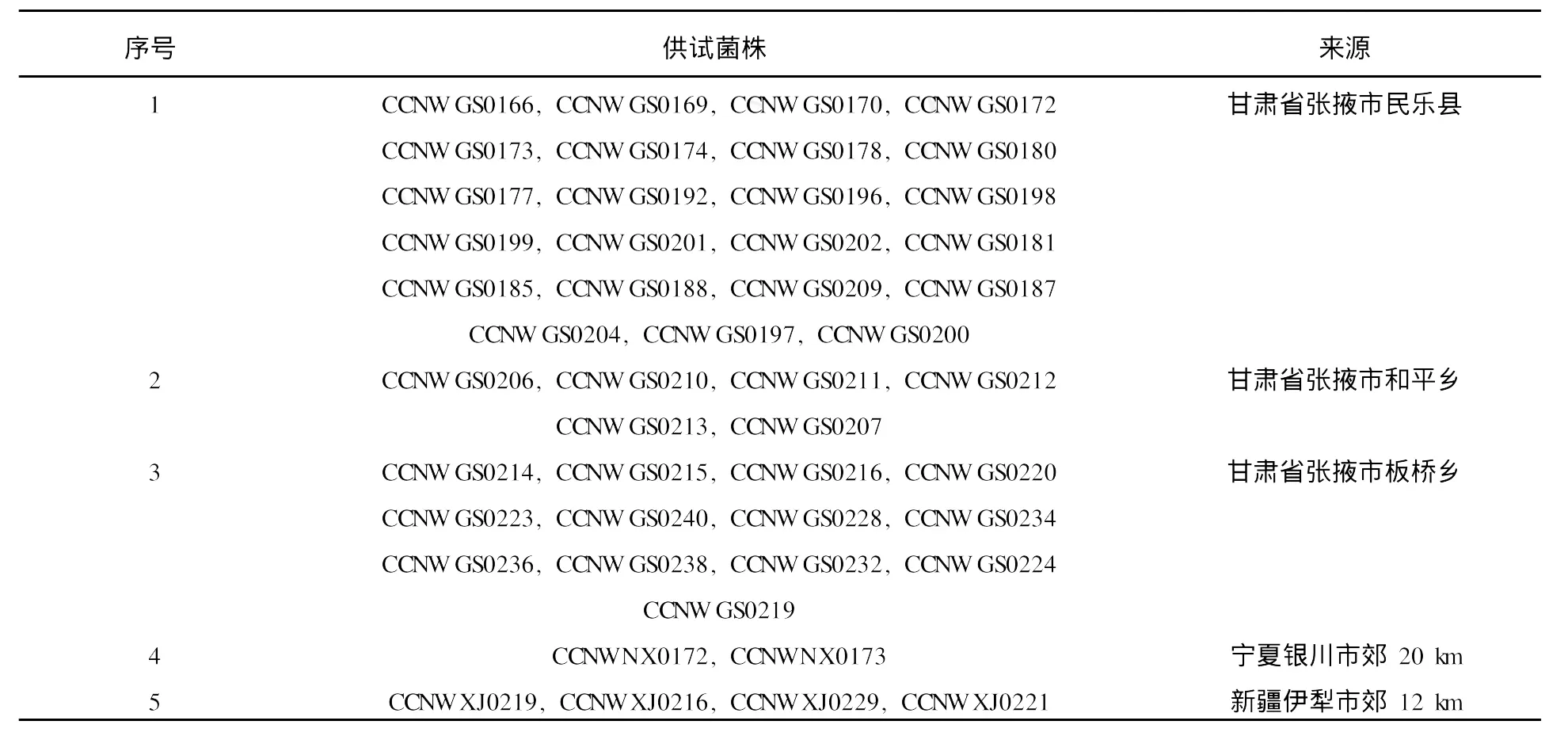
表1 供试菌株编号及来源Table 1 List of bacterial strains tested and their origins

表2 参比菌株及来源Table 2 The reference strain and their origins
1.2 方法
1.2.1 性状分析 实验共测定表型性状113项,其中唯一碳源利用24项;唯一氮源利用13项;抗生素敏感性28项;染料抗性测定14项;其他测定项目有耐盐性、初始pH、温度生长范围、硝酸盐还原、耐尔蓝还原、BTB酸碱反应、过氧化氢酶、L-苯丙氨酸脱氢酶测定尿酶、肉汤生长等,每个性状设3个重复[6]。
1.2.2 聚类分析 用NTSYSpc软件按照平均连锁法(UPG MA)进行聚类,结果以树状图谱方式表示。
1.2.3 表观群中心菌株的确定 采用最大平均数法,计算群内菌株的相似性系数,求平均值,平均值最大的即为该表观群的中心菌株[7]。
2 结果与分析
2.1 生理生化测定结果
2.1.1 唯一碳源的利用 蔗糖、肌醇、L-鼠李糖、葡萄糖、D-果糖、D-甘露糖、海藻糖、麦芽糖可被全部测试菌株利用;95%菌株可利用D-山梨醇、蜜二糖、L-树胶醛糖、半乳糖、乳糖、L-阿拉伯糖;CCNWGS0174、CCNWGS0199、CCNWXJ0221、CCNWXJ0219、CCNWXJ0216、CCNWGS0236、CCNWGS0209、CCNWGS0185、CCNWGS0197、CCNWGS0224这10株菌除L-山梨糖外,其余供试碳源均可利用,说明这些菌株的糖酵解底物范围比较广泛。结果表明:大多数供试菌株能以不同形式的单糖或二糖作为生长的良好碳源。
2.1.2 唯一氮源的利用 DL-组氨酸不能作为所用供试菌株的唯一氮源,而参比菌株USDA2914、USDA1002、CCBAU71714则可利用DL-组氨酸;L-天冬氨酸、L-正白氨酸、L-苯丙氨酸、L-白氨酸、L-酪氨酸、L-谷氨酸、L-精氨酸可被全部测试菌株利用;90%菌株可利用L-半胱氨酸、L-胱氨酸、L-甘氨酸、L-赖氨酸、DL-氨基丙酸作为唯一氮源。参比菌株USDA2914可利用全部供试氮源。
2.1.3 抗生素抗性测定 所有测试菌株对林可霉素(5、50μg/mL)具有抗性,90%测试菌株对卡那霉素(5μg/mL)、氯霉素(5μg/mL)、硫酸阿米卡星(5μg/mL)、林可霉素(100、300μg/mL)具有抗性,能在含其浓度抗生素培养基上正常生长,但随抗生素浓度的增加菌株的生长受到不同程度的抑制,当链霉素浓度增加至300μg/mL、卡那霉素浓度增加至100μg/mL、阿奇霉素浓度增加至50μg/mL、硫酸阿米卡星浓度增加至50μg/mL时,所有测试菌株的生长受到抑制。40%菌株能耐高浓度的青霉素(300μg/mL),CCNWGS0174和CCNWXJ0216能耐高浓度的氯霉素(300μg/mL),95%菌株能耐高浓度的林可霉素(300μg/mL)。
2.1.4 对染料及化学药物的耐性测定 88%菌株对染料甲基蓝(0.1%、0.2%)、溴百里酚蓝(0.1%、0.2%)、刚果红(0.1%、0.2%)和中性红(0.1%)不敏感,能在含其培养基上正常生长;所有测试菌株均不能耐受0.2%的亚甲基蓝、0.2%的甲基红及0.2%的孔雀石绿。除USDA2914、SDW014、USDA3306、SH2672205 4株参比菌株外,其他供试菌株均可在含有0.4%亚硝酸钠的培养基上正常生长;仅有4%的菌株不能在含有0.2%去氧胆酸钠的培养基中生长。
2.1.5 耐盐性、初始pH、温度生长范围测定 除参比菌株SDW014、USDA3306外,全部供试菌株能耐1%的NaCl,80%菌株可以耐2%、3%的NaCl,55%菌株可以耐4%、5%的NaCl,35%菌株可以耐6%的NaCl。全部测试试菌株在pH 4、pH 5的酸性环境中不能生长;除参比菌株SDW014、USDA3306、SH2672205外,其余菌株均可在pH 9~12的碱性环境中生长。全部测试菌株在4℃时不生长;除参比菌株外,其余菌株均可在10℃时生长;47%菌株在40℃时可以生长。将菌株60℃处理30 min、70℃处理10 min后置28℃培养,95%菌株可正常生长;而在进行60℃处理1 h、70℃处理30 min及70℃处理1 h后,分别有24%、55%菌株及0%的菌株生长。
2.2 数值分类结果
从聚类图(图1)可以看出全部测试菌株在43.5%的相似水平上聚在一起,未知供试菌株在56%的相似水平上聚在一起。所有未知菌株在72%的相似水平上分为5个群。群Ⅰ有39株菌,在74.6%相似水平聚合,中心菌株为CCNWGS0215;群Ⅱ有5株菌,在76%相似水平聚合,中心菌株为CCNWGS0228;群Ⅳ包括了CCNW0172和CCNW0173 2株菌,在81.5%的相似水平上聚合;群Ⅲ和V群分别有1株菌,在68.5%和56.5%的相似水平上与其他供试菌株明显区分。

图1 数值分类树状图Fig.1 Dendrogram of the rhizobial strains in numerical taxonomy
2.3 各类群之间的鉴别特征

表3 各类群之间的鉴别特征Table 3 Characteristics of identification among clusters
从表3各类群的鉴别特征统计结果可以看出:第Ⅲ、Ⅳ类群的菌株几乎对糖原和D-木糖均不能利用,而第Ⅰ、Ⅱ类群有80%以上的菌能够利用它们作为唯一碳氮源;第Ⅰ类群的菌株对青霉素不敏感,而其他3个群的菌株对其敏感。第Ⅳ类群的菌株对氯化钠(6%),中性红(0.2%),青霉素(300 mg/mL)及氯霉素(50μg/mL)的耐受性较低,而群Ⅰ对这些指标的耐受度较高。这些鉴别特征是它们独立成群的主要依据。
3 讨 论
生理生化测定结果表明,供试的48株根瘤菌绝大多数菌株能利用不同形式的单糖或二糖作为生长的良好碳源,对供试抗生素及染料有较好的抗性,所有的菌株均具有较强的耐盐碱能力,全部未知菌株均可耐受pH 12的强碱性环境。Janet[8]和Mohammad等[9]认为,根瘤菌在抗干旱和抗盐碱方面具有相关性,陈利云等[10]研究表明,抗旱性强的根瘤菌耐盐碱能力也较强。供试菌株所体现出的性状与其寄主植物的生存环境密切相关,植物采样地为西北干旱半干旱区,气候为大陆荒漠气候区,绝大部分样区位于盐碱地或荒漠地,与它们所共生的根瘤菌所具有的特殊生理性状是其在长期逆境胁迫下,经过双重选择,逐渐进化、适应生态环境的结果。
通过对数值分类的分析表明,全部未知供试菌株在72%的相似水平上分为5个表观群,显示了供试菌株丰富的表型多样性。除USDA 2914、USDA 1002及CCBAU71714可与类群Ⅰ在77%的相似水平上聚群外,其他参比菌株与未知菌株的相似性都较低,表明供试菌株与参比菌株差别较大。未知菌株均为革兰阴性,无芽胞,多数菌株可利用D-木糖、乳糖、丙酸钠、L-阿拉伯糖、D-果糖、蜜三糖、鼠李糖、甘露糖、有机酸、柠檬酸盐、醋酸钠、葡萄糖、蔗糖、乳糖、酒石酸钠和肌醇,但不能以D-山梨醇为唯一碳源。可利用L-胱氨酸、甲硫氨酸、L-丙氨酸、谷氨酸、苏氨酸、白氨酸、精氨酸及腺嘌呤作为唯一氮源。最佳生长温度为28℃,温度60℃以上时生长受到抑制,最适pH为7~10。对0.1%甲基绿、5μg/mL阿奇霉素、50 μg/mL卡那霉素和50μg/mL阿米卡星敏感。是否属于潜在的新种,需要进一步验证。
从聚类图还可以得出:同一地理来源的菌株具较高的相似性,并聚到同一个类群,如群Ⅳ的CCNWNX0172和CCNWNX0173 2株菌均来源于宁夏银川,它们的相似性达95%。不同地理来源的菌株具较高的相似性,可以聚到同一个类群,如群Ⅰ的28株菌中包括了分离自新疆的4株菌株和来源于甘肃省张掖市的24株菌,它们在92%相似性水平上聚群。上述现象表明,根瘤菌与豆科植物之间的共生结瘤关系受到地理来源和生态环境的影响,这一结果与陈文新等[11]的观点一致。
[1] Zhang GX,Ren SZ,Xu MY,et al.Rhizobium borborisp.nov.,an aniline-degrading bacterium isolated from activated sludge[J].Int J Syst EvolMicrobiol,2010,doi:10.1099/ijs.0.022228-0.
[2] Zhang RJ,HouBC,Wang ET,et al.Rhizobium tubonensesp.nov.,a symbiotic bacterium isolated from root nodulesofOxytropis glabra grown in Tibet,China[J].Int J Syst EvolMicrobiol,2010,doi:10.1099/ijs.0.020156-0.
[3] Ren DW,Chen WF,Sui XH,et al.Rhizobium vignaesp.nov.,a symbiotic bacterium isolated from multiple legume species grown in China[J].Int J Syst EvolMicrobiol,2010,doi:10.1099/ijs.0.023143-0.
[4] 中国科学院中国植物志编辑委员会.中国植物志第42卷:第1分册[M].北京:科学出版社,1993:6-9.
[5] 徐琳,徐家洁,刘巧莉,等.西北部分地区苦马豆根瘤菌的遗传多样性[J].生物多样性,2009,17(1):69-75.
[6] 万晓红,韦革宏,杨亚珍,等.紫花苜蓿品种根瘤菌表型多样性研究[J].草地学报,2004,12(4):276-280.
[7] 韦革宏,陈文新,朱铭莪.陕甘宁地区根瘤菌数值分类与DNA同源性分析[J].应用与环境生物学报,1999,5(1):73-78.
[8] Janet J.Effect of heat stress on cell activity and cellmorphology of the tropical rhizobium[J].FEMS Microbiology Ecology,2001,34(3):267-268.
[9] Mohammad R M,Akhavan KM,CapbellW F,et al.Identification of salt-and drought-tolerant rhizobiummeliloti L,strains[J].Plant and Soil,1991,134(2):271-276.
[10] 陈利云,张丽静,周志宇.耐盐根瘤菌对紫花苜蓿接种效果的研究[J].草业学报,2008,17(5):43-47.
[11] 陈文新,汪恩涛,陈文峰.根瘤菌-豆科植物共生多样性与地理环境的关系[J].中国农业科学,2004,37(1):81-86.

