以HIV-1 5'LTR为靶点的药物筛选细胞模型的构建
李建彬,陈斌,米志强,安小平,李存,刘大斌,王晓娜,范华昊,方祥,童贻刚*
(1.华南农业大学食品学院,广东广州510642;2.军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室,北京100071)
人类免疫缺陷病毒(HIV)又称艾滋病病毒,该病毒能攻击破坏人体的免疫系统,最终使人易感多种疾病而死亡。自1981年第1例艾滋病被发现以来,世界上很多国家相继报道了本国艾滋病感染情况,在短短的30多年间,感染这种疾病的人与日俱增,截至2011年世界上约有6 400万人感染艾滋病毒,每天平均有7 000宗新病例,其已成为威胁人类健康及社会经济发展的一个重要问题。HIV分为2种类型:HIV-1和HIV-2。目前全球流行的主要是HIV-1且HIV-1的毒性与传染性均高于HIV-2。对于HIV的治疗一直是医学领域较为头疼的问题,现主要是应用小分子药物抑制HIV的复制和侵染或研制新的疫苗抵制HIV的攻击[1]。由于HIV基因组具有高突变率,艾滋病发现至今,仍没有研制出有效的药物和疫苗抵抗HIV。即便使用新研制出的药物对抗HIV,但随着时间的推移,很快病毒就会对该种药物产生耐药,如何提高药物的疗效并加快药品的研发是一个迫切需要解决的问题。HIV-1的LTR区位于基因组2端,是高度保守的序列,大量的研究表明HIV-1的转录受5'LTR的调控,在5'LTR区存在着和各种转录因子的结合位点[2-3]。如药物能抑制5'LTR的活性,则HIV的基因表达和复制就会受到影响,该药物就有可能用于艾滋病的治疗。TK基因能够将GCV磷酸化为二磷酸产物GCVDP,然后在细胞内激酶作用下形成三磷酸产物GCV-TP,GCV-TP具有强烈的细胞毒性,能抑制DNA聚合酶活性,最终导致细胞死亡[4-5]。本研究利用5'LTR区的特性并结合TK自杀基因的功能,将TK基因克隆到5'LTR序列下游,构建了由HIV-1 5'LTR调控TK基因表达的载体。通过将其转染HEK293细胞获得稳定表达细胞系并用药物GCV对TK基因的表达进行验证,建立了以HIV-1 5'LTR为靶点,TK基因为负向筛选标记的药物筛选细胞模型。
1 材料与方法
1.1 材料
HEK293细胞系、克隆载体pcDNA3.1、载体puc-18-EGFP-denv和载体HSV-106均为本室保存;细胞转染试剂Lipofectamine2000、二甲基亚砜及G418购自Invitrogen公司;药物更昔洛韦(GCV)购自Sigma公司;小鼠抗胸苷激酶单抗购自Abcam公司;辣根过氧化物酶标记的山羊抗小鼠IgG购自中杉金桥公司;大肠埃希菌DH5α购自博迈德生物公司;各种DNA限制性内切酶和T4 DNA连接酶购自宝生物工程有限公司;Fast Pfu DNA Polymerase购自全式金生物技术有限公司;细胞培养基DMEM和胎牛血清购自HyClone公司;质粒提取试剂盒购自Qiagen公司;实验所用引物合成于上海生工。
1.2 方法
1.2.1 引物合成用于扩增HIV-1 5'LTR的引物序列分别为HIV-LTR-F:5'-GTCAGGCCTCCACCTGGGTCTTGGAAT-3';LTR-TK-R:5'-GGTACGAAGCCATCTCTCTCCTTCTAGCCTC-3'。用于扩增TK基因的引物序列分别为TK-LTR-F:5'-GGAGAGAGATGGCTTCGTACCCCTGCCATCAAC-3';TK-pf1-R:5'-CGCGGATCCTGGTGTTTCAGTTAGCCTCC-3';RT-PCR验证TK基因表达引物分别为TK-F:5'-ATGGCTTCGTACCCCTGCCA-3';TK-R:5'-CGGCGTCGGTCACGGCATA-3'。
1.2.2 HIV-1 5'LTR和TK基因的扩增HIV-1 5'LTR的扩增:以载体puc-18-EGFP-denv为模板,使用Fast Pfu DNA Polymerase进行扩增,反应体系:模板30 ng,聚合酶缓冲液10 μL,dNTP(2.5 mmol/L)4 μL,引物(10 μmol/L)4 μL,Fast Pfu DNA polymerase 2.5 U,H2O补足50 μL。反应条件:95℃2 min,95℃20 s,56℃20 s,72℃20 s,72℃7 min,循环数为35。TK基因的扩增:以载体HSV-106为模板,使用Fast pfu DNA Polymerase进行扩增,反应体系及反应条件同HIV-1 5'LTR的扩增。将2扩增产物进行琼脂糖凝胶电泳回收大小约1 100 bp的5'LTR片段及大小约1 100 bp的TK基因片段。
1.2.3 HIV-1 5'LTR调控TK基因表达载体的构建以回收的HIV-1 5'LTR和TK基因片段为模板进行重叠PCR将2片段连接起来,使用引物为HIV-LTR-F和TK-pf1-R。反应体系:模板各30 ng,聚合酶缓冲液10 μL,dNTP(2.5 mmol/L)4 μL,引物(10 μmol/L)4 μL,Fast Pfu DNA Polymerase 2.5 U,H2O补足50 μL。反应条件:95℃2 min,95℃20 s,55℃20 s,72℃40 s,72℃7 min,循环数为35。利用琼脂糖凝胶电泳回收约为2 200 bp的LTR与TK基因重叠PCR产物。使用StuⅠ和BamHⅠ酶切回收的LTR与TK连接片段,NruⅠ和BamHⅠ酶切pcDNA3.1载体,酶切回收后使用T4 DNA连接酶将2片段连接起来构建成最终HIV-1 5'LTR调控TK基因表达载体pcDNA3.1-LTR+TK,载体大小为6 924 bp。
1.2.4 HEK293细胞的培养及稳定细胞系的构建HEK293细胞使用含10%胎牛血清的DMEM进行培养,于转染前1 d将HEK293细胞铺种于6孔板中,第2天当细胞达到90%到95%汇合时开始转染,采用Lipofectamine 2000进行转染。主要操作步骤:首先将4 μg质粒溶于250 μL的无血清的细胞培养基中并轻轻混匀,同时将10 μL Lipofectamine 2000转染试剂溶于250 μL的无血清培养基中并于室温静置5 min,之后将两者混匀再于室温静置20 min。最后将质粒与Lipofectamine 2000的混合物加入铺好的293FT细胞中于37℃含5%CO2的培养箱中培养,6 h后换上新鲜的培养液。在转染24 h后加入终浓度为800 μg/mL的G418进行加压筛选,加药2星期后获得稳定细胞株。将获得的稳定细胞株用倍比稀释法获得单克隆,同时用药物GCV作用于得到的单克隆以验证TK基因的表达从而获得HIV-1 5'LTR调控TK基因表达的稳定细胞系。
1.2.5 Western印迹分析将获得的稳定细胞株HEK293/TK与HEK293细胞用胰酶消化后收集并用PBS溶液反复洗2次,并加入1×细胞裂解液(Promega)反复吹打细胞使细胞充分裂解,12 000 r/min离心15 s后将上清液转移至新的离心管,使用微光分光光度计测定蛋白浓度。在蛋白中加入2×蛋白上样缓冲液(120 mmol/L Tris-HCl(pH 6.8)、丙三醇20%、SDS 4%、β-巯基乙醇3%、溴酚蓝0.02%),置于95℃变性5 min后将蛋白上样到15%的SDS-PAGE进行电泳,电泳完后转膜,将膜置于抗胸苷激酶单抗中37℃孵育2 h,TBS-tween洗膜3次,之后置于二抗37℃2 h后再显影。
2 结果与分析
2.1 pcDNA3.1-LTR+TK载体的构建
为了将HIV-1 5'LTR和TK基因连接起来,先分别从puc-18-EGFP-denv和HSV-106载体上扩增所需的目的片段,再以2扩增的目的片段为模板进行重叠PCR将两片段连接起来。HIV-1 5'LTR和TK基因的PCR扩增产物约为1 100 bp,两者进行重叠PCR之后大小约为2 200 bp,琼脂糖凝胶电泳(图1)的结果显示2片段成功连接在一起。将MluⅠ和BamHⅠ酶切重组载体pcDNA3.1-LTR+TK获得1 120 bp与5 804 bp大小的片段并将其测序,测序结果与理论结果一致,说明获得正确重组克隆。
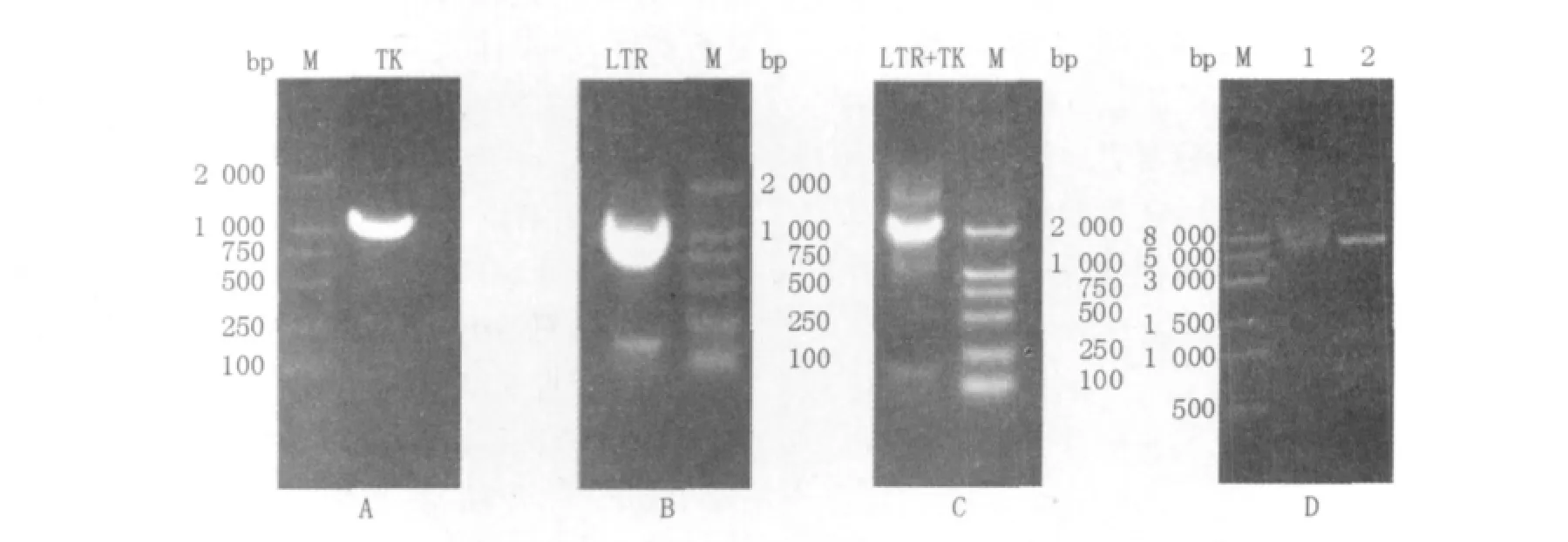
图1 PCR扩增图与酶切结果Fig.1 Results of PCR and restriction digestion
2.2 Western Blot与RT-PCR检测TK基因的表达
收集裂解的细胞上清进行电泳转膜后,加入相应的抗体进行反应,通过ECL法显影,结果如图2所示,同时用RT-PCR进行目的基因表达的鉴定,使用trizol试剂提取总RNA并用TaKaRa公司的反转录试剂盒进行逆转录后再进行PCR,结果如图3所示,无论从免疫印迹结果还是从RTPCR结果中都可以看出在构建的HEK293/TK细胞系中TK基因的表达。
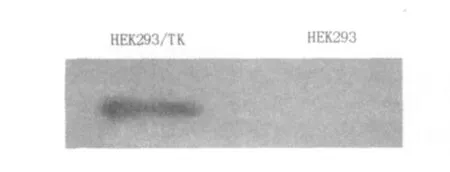
图2 Western印迹检测TK基因的表达Fig.2 Results of TK expression by western blotting
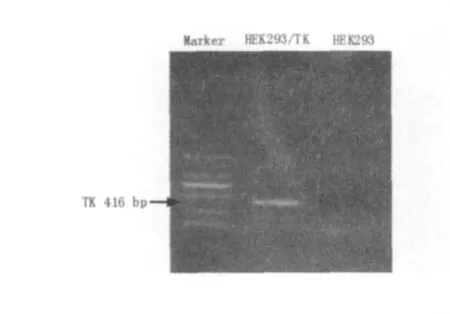
图3 RT-PCR检测TK基因的表达Fig.3 Results of RT-PCR amplification of TK gene
2.3 不同GCV浓度对稳定细胞系HEK293/TK的杀伤作用
将构建好的表达载体pcDNA3.1-LTR+TK转染细胞并在转染后24 h开始加入G418加压筛选获得稳定细胞系,将获得的稳定细胞系单克隆化后采用MTT法检测GCV对HEK293/TK细胞的杀伤作用。铺种HEK293/TK细胞于96孔板中,24 h后加入药物GCV,同时铺种未转pcDNA3.1-LTR+TK质粒的HEK293细胞于96孔板中做对照。在加入药物GCV 72 h后加入MTT并于37℃、5%CO2的培养箱中放置4 h,之后加入二甲基亚砜在酶标仪上读取OD570,根据公式(实验孔OD值/空白对照孔OD值)计算细胞存活率。实验结果如图4所示。当加入GCV浓度为0.1 μg/mL时,就能对HEK293/TK细胞产生毒害作用。随着GCV浓度的加大,细胞的存活率降低而对HEK293细胞几乎无毒害作用。结果采用单因素方差分析,在所实验的药物浓度内,HEK293/TK和HEK293细胞在加入药物GCV后存活率存在显著性差异(P<0.05)。
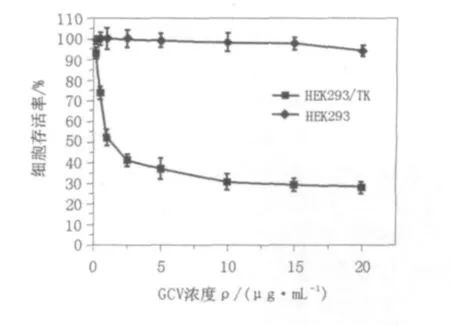
图4 MTT法检测药物GCV对HEK293/TK和HEK293细胞的杀伤作用Fig.4 GCV effects on the growth of HEK293 and HEK293/TK cells by using MTT
3 讨论
艾滋病已严重危害了人类健康,目前仍无根治药物,现阶段用于治疗艾滋病的化学药物反复多次使用易造成机体的耐药性而降低药物效果[6-7],随着对艾滋病病毒研究的深入,科研工作者正在寻求更多的药物作用靶点以提高药物治疗效果。由于药物所致的耐药性以及艾滋病病毒所具有的高突变性,建立一个高效的筛药体系对于加快抗HIV药物的研发制备以及艾滋病的控制都有着相当重要的意义,现如今常用抗HIV药物筛选模型有动物模型、细胞模型、酶水平和分子水平的筛选模型,但仍无较为理想的动物筛选模型,相比而言主要在细胞水平和分子水平上进行抗艾滋病药物的体外筛选。HIV的药物靶点已发现不少,有针对HIV吸附穿入、复制、整合、自身调控因子以及cc趋化因子等作用位点并根据这些位点构建了相应的筛药模型。HIV-1 5'LTR区含有HIV基因调控所必需的多个特定调控位点,其对HIV的复制至关重要,基于此位点的重要性,故构建了以HIV-1 5'LTR为靶点,以TK自杀基因作为筛选标记的抗HIV药物筛选模型。
TK自杀基因作为负向筛选标记在很多筛选体系中已被使用,Jaffrelo等[8]将该系统引入HCV研究,应用该反向筛选机制极大地提高了筛选效率,成功地筛选到6个HCV基因组自身携带的蛋白质翻译调控序列,由此说明采用自杀基因负筛选系统,可以十分有效地筛选到所需的靶标。本研究构建了基于HIV-1 5'LTR为靶点的药物筛选细胞模型,将TK基因作为筛选标记置于HIV-1 5'LTR下游,并将构建好的载体pcDNA3.1-LTR+TK转染HEK293细胞获得稳定表达细胞系,在使用药物GCV作用于HEK293与HEK293/TK细胞时,在所实验的药物浓度范围内,发现药物GCV对HEK293/TK细胞具有毒害性,而对HEK293细胞几乎无毒害作用,说明TK基因能在LTR的启动下进行表达,当GCV的浓度大于2.5 μg/mL时细胞存活率差异性开始降低,故在后续筛选实验中需注意加入合适的药物浓度。该细胞模型以TK基因作为筛选标记方便灵敏,其可用于针对HIV-1 5'LTR的药物筛选,在抗HIV药物筛选中具有一定的应用意义。
[1] Gao Y.A way Leading to an effective anti-HIV Vaccine[J].Anti Infect Pharm,2011,8(1):2.
[2] AI-Harthi L,Roebuek KA.Human immunodeficiency virus type-1transcription:role of the 5'-untranslated leader region[J].Int J Mol Med,1998,l(5):875-881.
[3] Pereira LA,Bentley K,Peeters A,et al.A complation of cellular transcription factor interactions with the HIV-l LTR promoter[J].Nucletic Acids Research,2000,28(3):663-668.
[4] Kwong KY,Zou Y,Day CP,et al.The suppression of colon cancer cell growth in nude mice by targeting beta-catenin/TCF pathway[J].Oncogene,2002,21(54):8340-8346.
[5] M?kinen K,Loimas S,Wahlfors J,et al.Evaluation of herpes simplex thymidine kinase mediated gene therapy in experimental pancreatic cancer[J].The Journal of Gene Medicine,2000,2(5):361-367.
[6] Shafer RW,Schapiro JM.HIV-l drug resistance mutations:an updated frame work for the Second decade of HAART[J].AIDS Rev,2008,10(2):67-84.
[7] Hinkley T,Martins J,Chappey C,et al.A systems analysis of mutational effects in HIV-1 protease and reverse transcriptase[J].Nature Genetics,2011,43(5):487-489.
[8] Jaffrelo L,Chabas S,Reigadas S,et al.A functional selection of viral genetic elements in cultured cells to identify hepatitis C virus RNA translation inhibitors[J].Nucleic Acids Research,2008,36(15):e95.

