中期因子在卵巢上皮性肿瘤中的表达及与其临床病理特征的关系
刘 翼
在细胞表面和细胞外基质中,存在着一些对葡氨聚糖肝素和硫酸肝素具有高度亲和力的多肽,总称为肝素结合生长因子。如血管内皮生长因子、成纤维细胞生长因子等。中期因子(medikine,MK)是1988年发现的1种新的肝素结合生长因子,因起初在孕中期小鼠胚胎肾脏发现其大量表达而得名。MK特异表达于多种肿瘤组织,并参与肿瘤的生长、血管生成等过程,我们应用免疫组化技术,检测卵巢上皮性肿瘤组织中MK的表达情况,并进一步探讨与其临床病理因素的关系。
1 材料与方法
1.1 对象
2008年~2010年,我院收治的、经病理检查确诊的80例卵巢肿瘤患者,病例资料完整,术前未行放、化疗及激素治疗,平均年龄50.3岁,≤50岁28例,>50岁32例。良性卵巢肿瘤15例,其中浆液性囊腺瘤12例,黏液性囊腺瘤3例;卵巢交界性肿瘤10例;上皮性卵巢癌55例,其中浆液性囊腺癌40例,黏液性囊腺癌8例,子宫内膜样癌7例。卵巢癌临床病理分期:Ⅰ期27例,Ⅱ期15例,Ⅲ期11例,Ⅳ期2例(按国际妇产科联盟卵巢癌的临床分期FIGO 2008标准)。盆腔淋巴结转移13例,无转移42例。以正常卵巢上皮组织10例作为对照。
1.2 方法
标本经福尔马林液固定后,常规石蜡包埋,连续切片,厚度为4 μm,分别行HE染色,MK免疫组织化学SP法染色。室温干燥,经染色、显色、封片后镜检。所有切片均在同一实验室,由同一技术人员,使用同一批号试剂完成免疫组织化学染色。以试剂公司提供的阳性对照片作为阳性对照。
1.3 阳性判断标准
肿瘤细胞膜和(或)细胞质中出现清晰棕黄色染色的细胞即为阳性细胞,光镜下随机选取10个视野,每个视野计数100个细胞,阳性细胞数<20%为阴性,否则为阳性。
1.4 统计学处理
组间差异检验采用χ2检验进行分析,P<0.05为有显著性差异。
2 结果
2.1 MK在不同卵巢上皮性组织中的表达情况
正常卵巢上皮组织、良性卵巢上皮性肿瘤组织、交界性卵巢上皮性肿瘤组织及卵巢癌组织中,MK阳性表达率依次增高,分别为0(0/10)、13.3%(2/15)、50.0%(5/10)和89.1%(49/55)。上皮性卵巢癌组织中MK表达率与其他3组比较,明显升高,差异有统计学意义(P<0.05),见表1。结果表明,MK可能与上皮性卵巢癌的发生有关。
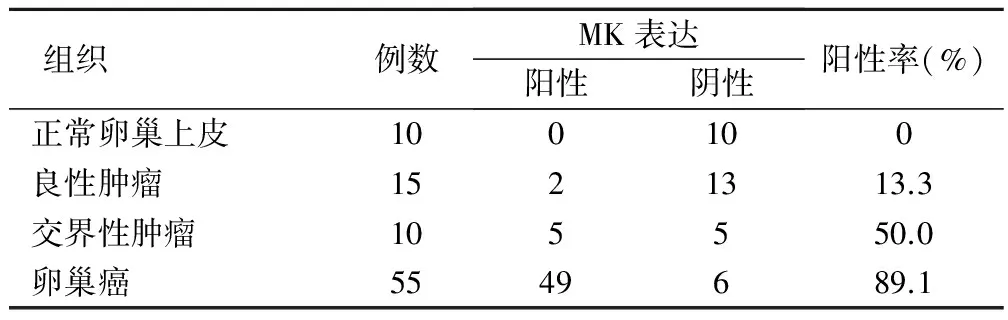
表1 各组织中MK表达情况(例)
注:卵巢癌组织与非卵巢癌各组织比较,P均<0.05
2.2 MK因子表达与上皮性卵巢癌临床病理特征的关系
MK因子与卵巢癌病理类型无相关性(P>0.05),Ⅱ~Ⅳ期患者MK阳性表达率,明显高于Ⅰ期患者(P<0.05),有淋巴结转移者MK阳性表达率显著高于无淋巴结转移者(P<0.05)(表2)。
3 讨论
中期因子又称神经轴突生长促进因子-2(neurite growth-promoting factor 2),是1988年发现的肝素结合生长因子。与另外1种肝素结合性生长因子,称为多效营养因子(pleio- trophin,PTN) 一起构成了Midkine家族。MK在脊椎动物中广泛表达。人类MK在妊娠中期胎儿上皮2间叶组织和神经组织中高表达,维持细胞生长,促进细胞迁移,对胎儿上皮和神经组织等的发育有重要作用。成人MK mRNA表达很低,通常检测不到。近年有报道MK在肺癌、乳腺癌、胰腺癌、食管癌、膀胱癌等多种肿瘤组织中有较高水平表达,可能参与肿瘤的发生、演进、生长及转移过程[1~4]。1997 年Choudhuri 等[5]通过实验证实了MK在肿瘤发生中的作用,在体内MK促进肿瘤细胞的生长,这种生长与肿瘤血管密度的增加有关。同时证实MK有促进肿瘤血管生成的作用。MK在肿瘤组织中的过度表达促进了肿瘤血管的形成,促进了肿瘤的生长和浸润[6]。因此,研究卵巢癌组织中MK因子与卵巢癌组织学特征的关系,可以了解其生物学行为,并指导治疗方向和预后判断。

表2 MK因子表达与上皮性卵巢癌临床病理特征的关系 (例)
本研究采用免疫组织化学染色,对比检测了MK蛋白在80例卵巢上皮性肿瘤和10例正常卵巢上皮组织中的表达情况。结果表明,在正常卵巢上皮组织及良性卵巢上皮性肿瘤中,MK无表达或仅微弱表达;交界性卵巢上皮性肿瘤MK阳性表达率为50%,而在卵巢上皮性癌组织中MK蛋白表达率高达89.1%,由于MK在上述几种组织中的表达有显著性差异,这也提示MK有作为卵巢上皮性癌标志物的可能性。MK阳性率与肿瘤病理类型无相关性,浆液性囊腺癌90%,黏液性囊腺癌87.5%,子宫内膜样癌85.7%,差异无显著性。 研究还显示,临床分期Ⅱ~Ⅳ期阳性表达率明显高于临床Ⅰ期,有淋巴结转移者MK阳性表达率显著高于无淋巴结转移者。MK因子在调控肿瘤血管生成过程中起重要作用,与血管生成密切相关[7],因此临床分期越晚的患者其MK阳性表达率越高。
近年来,MK家族血清学检测已逐渐成为研究热点。酶联免疫吸附试验表明,正常人体内MK血清含量通常为(0.5~0.6) ng/mL,在某些恶性肿瘤患者血清中MK水平超过临界值[8]。Shimada 等[9]比较了135 例表浅食管癌患者血清中CEA、鳞癌抗原、角蛋白(CY2FR2121) 、MK水平,并应用COX’s 危险模型进行生存分析,结果表明血清MK的敏感性高于血清中其他标志物,且术前血清MK高水平的患者预后差。由此可见,MK家族的血清学检测可为临床恶性肿瘤的诊断和预后估计提供有力帮助。但卵巢癌中MK的血清学水平是否具有相同的规律,成为有待进一步研究证实的问题。MK除在恶性肿瘤组织中呈高表达外,在交界性肿瘤中也有表达,其在肿瘤演进中的变化显示其癌变早期有可能发挥生物学功能,故有可能用于肿瘤早期的诊断。
[1]Tsutsui J,Kadomatsu K,Matsubara S,et al.A new family of heparin binding growth /differentiation factors:increased midkine expression in Wilms′tumor and other human carcinomas〔J〕.Cancer Res,1993,53 (6) :1281.
[2]Mishima K,Asa IA,Kadomatsu K,et al.Increased expression of midkine during the progression of human astrocytomas〔J〕.Neurosci Lett,1997,233 (1) :29.
[3]赵 秋,马松林,王 渝,等.Midkine在胰腺癌组织中的表达及临床意义〔J〕.胰腺病学,2006,6 (6):337.
[4]王 琼,赵永年,刘 钧,等.Midkine在食管鳞癌中的表达及其与微血管密度的关系〔J〕.肿瘤防治研究,2006,33 (1) :152.
[5]Choudhuri R,Zhang HT,Donnini S,et al.An angiogenic role for the neurokines midkine and pleiotrophin in tumorigenesis〔J〕.Cancer Res,1997,57 (2):1814.
[6]Beecken WD,Kramer W,Jonas D.New molecular mediators in tumor angiogenesis〔J〕.Cell Mol Med,2001,4 (4):262.
[7]陆永良,姚 行,戴利成,等.中期因子在胰腺癌组织中的表达及其临床意义〔J〕.中华普外科杂志,2003,18 (1) :9.
[8]Ikematsu S,Yano A,Aridome K,et al.Serum midkine levels are increased in patients with various types of carcinomas〔J〕.Br J Cancer,2000,83 (6):701.
[9]Shimada H,Nabeya Y,Okazumi S,et al.Increased serum midkine concentration as a possible tumor marker in patients with superficial esophageal cancer〔J〕.Oncol Rep,2003,10(2):411.

