PTEN、MAPK、Cyclin D1在肺癌组织中表达及与其预后的相关性
曾益华 王岳松 张世杰 胡爱民
肺癌的发生发展是一个多阶段、多步骤的过程,在肿瘤的每个发展阶段,都有不同的分子生物学改变。癌基因和抑癌基因失衡、细胞信号传导通路的异常、细胞周期调节的改变,在肿瘤的发生发展中发挥重要的作用。本研究旨在蛋白质水平,检测抑癌基因PTEN蛋白、MAPK信号、及周期素Cyclin D1在肺癌中的表达,从而在蛋白质水平了解肺癌的发生发展机理,为诊断肺癌、评估肺癌的预后和基因治疗提供新的理论依据和线索。
1 材料与方法
1.1 一般资料
收集2005年~2010年空军总医院病理科肺癌手术切除标本和纤维支气管镜(纤支镜)肺癌活检标本共62例,肺癌癌旁组织36例,正常肺组织10例。肺癌根据WHO(2004)标准进行病理分型,其中鳞癌27 例,腺癌24 例,小细胞肺癌11 例。
1.2 抗体及试剂
PTEN、MPAK、Cyclin D1均为鼠抗人浓缩型单克隆抗体,为美国Santa Cruz公司产品。通用型SP试剂盒购自北京中山生物技术有限公司。
1.3 免疫组化检测
所有标本均经10%的福尔马林液固定,常规石蜡包埋,5 μm连续切片,并抗原修复,SP免疫组化染色。用已知阳性切片作为阳性对照,用PBS代替一抗作为阴性对照。实验步骤按试剂盒说明书进行。
1.4 结果判定
在光学显微镜下对切片染色情况进行评估,免疫组化反应以细胞质或胞核出现棕黄色颗粒为阳性,其判断标准如下:高倍镜(40×10)下每张切片观察5个视野,计算1 000个癌细胞,PTEN阳性细胞数<10%为阴性(-),阳性细胞数11%~50%为阳性(+),51%~100%为强阳性(++)。Cyclin D1阳性细胞数<10%为阴性,11%~50%为阳性(+),51%~100%为强阳性(++)。MAPK阳性细胞数<10%为阴性(-),阳性细胞数11%~50%为阳性(+),51%~100%为强阳性(++)。
1.5 统计学处理
应用SAS8.2统计学软件包对所有数据进行处理。各组记数资料的结果采用行×列表的检验或四格表检验,生存情况单因素分析采用Kaplan-meier方法,Wilcoxon检验。多因素对生存的影响采用Cox回归模型分析。
2 结果
2.1 PTEN、MAPK和Cyclin D1表达与肺癌临床病理因素的关系(表1)
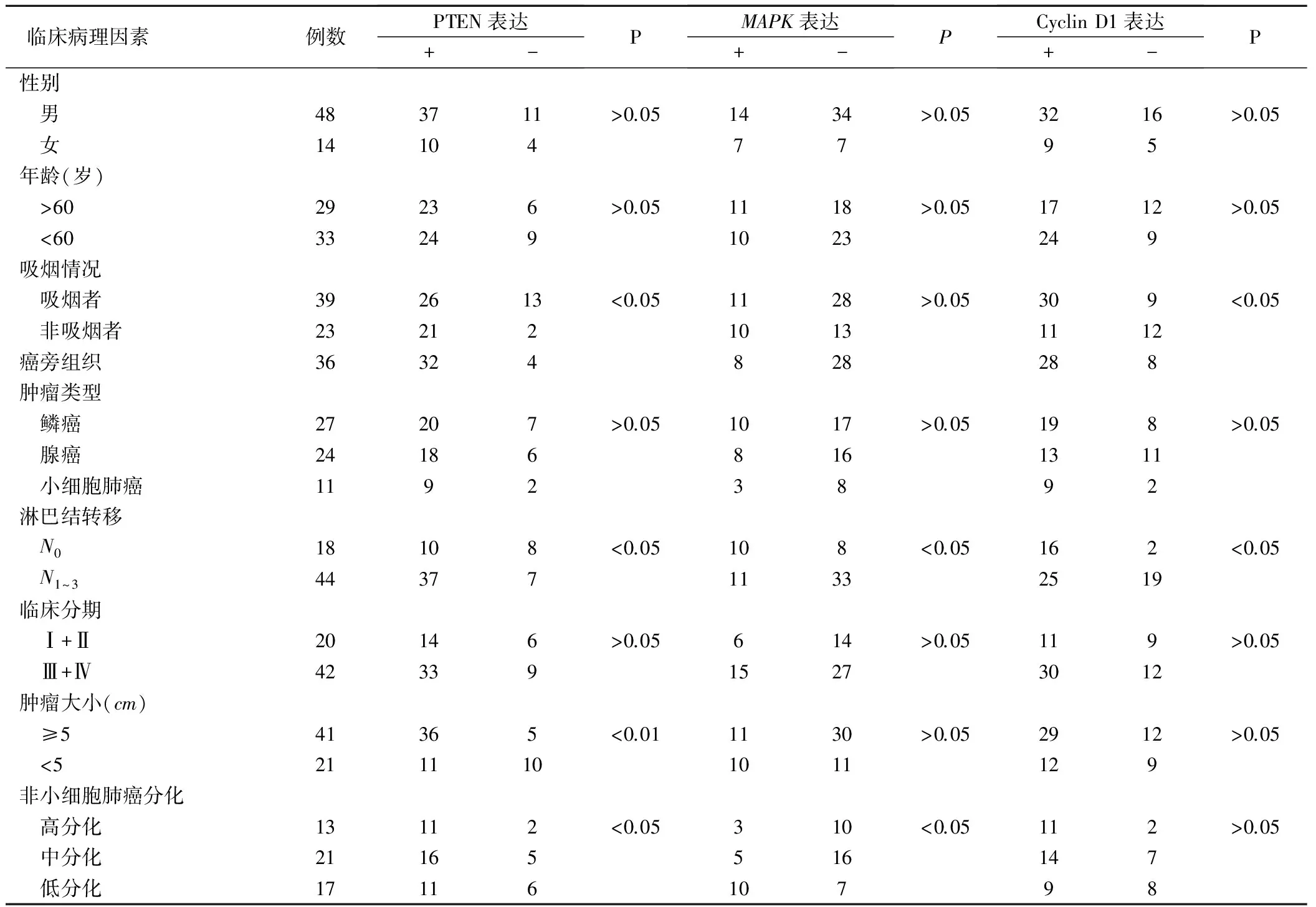
表1 PTEN、 MAPK、Cyclin D1表达与肺癌临床病理因素的关系(例)
2.1.1 正常肺组织、肺癌及癌旁组织中PTEN表达及与其临床病理因素的关系 免疫组化结果显示:PTEN阳性表达信号呈棕黄色,定位于细胞质。10例正常肺组织中PTEN均呈阳性,肺癌中PTEN蛋白阳性率[75.00%(47/62)]明显低于癌旁组织[88.89%(32/36)]。PTEN蛋白阳性表达与肿瘤大小显著相关(χ2=9.5017,P<0.01),与淋巴结转移显著相关(χ2=5.6715,P<0.05),非小细胞肺癌中PTEN阳性表达与肿瘤分化程度显著相关,低分化癌组织中其呈强阳性,癌组织分化越低,PTEN阳性表达越弱。PTEN表达与患者年龄、性别均无明显相关性,PTEN蛋白表达率不吸烟者显著高于吸烟者,有显著性差异(χ2=4.6177,P<0.05)。
2.1.2 正常肺组织、肺癌及癌旁组织中MAPK表达及与其临床病理因素的关系(表1) 免疫组化结果显示:MAPK阳性表达信号呈棕黄色,定位于细胞质。10例正常肺组织中MAPK呈阴性表达,肺癌中其阳性率为33.87%(21/62),高于癌旁组织[22.22%(8/36)]。MAPK阳性表达与肿瘤淋巴结转移显著相关(χ2=5.3274,P<0.05),淋巴结转移者其阳性率高于无淋巴结转移者;低分化癌与中高分化癌其阳性率比较有显著差异,低分化癌组织中MAPK呈强阳性表达,癌组织分化越差,MAPK表达越弱。MAPK表达与患者年龄、性别、吸烟情况及肿瘤大小均无明显相关性。
2.1.3 正常肺组织、肺癌及癌旁组织中Cyclin D1表达及与其临床病理因素的关系(表1) 免疫组化结果显示:Cyclin D1阳性表达信号呈棕黄色,定位于细胞核。10例正常肺组织中Cyclin D1均呈阳性表达,肺癌中Cyclin D1蛋白阳性率为66.13%(41/62),明显低于癌旁组织[77.78%(28/36)]。Cyclin D1蛋白阳性率与患者吸烟情况显著相关,吸烟者其阳性率显著高于非吸烟者;N0与N1~3比较差异显著,无淋巴结转移者显著高于有淋巴结转移者,Cyclin D1表达与患者年龄、性别、肿瘤大小及分化程度均无明显相关性。
2.2 PTEN、MAPK 、Cyclin D1蛋白表达间的相关性
采用对数线性模型分析方法,分析PTEN、MAPK和Cyclin D1蛋白表达间的关系,结果显示PTEN与MAPK表达呈明显负相关性,有显著性差异(χ2=4.2250,P<0.05),见表2。
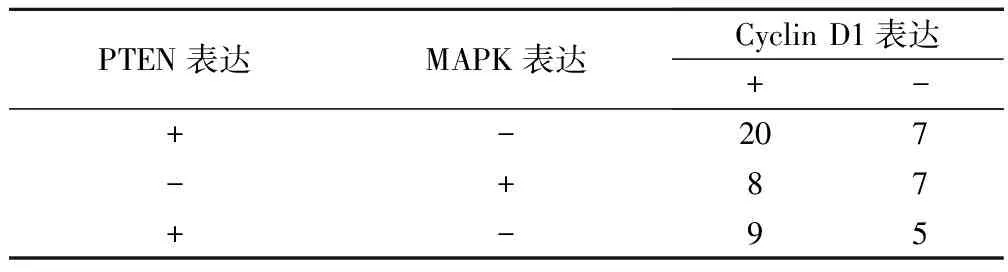
表2 PTEN、 MAPK、Cyclin D1蛋白表达间相关性(例)
2.3 PTEN、MAPK 、CyclinD1蛋白表达与患者生存期的关系
采用Cox比例风险模型,对本组共30例可随访资料进行多因素分析,共11个变量进入Cox模型,包括PT、MAPK、CyclinD1、肿瘤大小、淋巴结转移、TNM分期、病理类型、分化程度、性别、年龄和吸烟。采用逐步回归法筛选上述变量,结果提示吸烟、肿瘤分化程度、PTEN及TNM分期4个列变量有统计学意义(χ2值分别为6.8045、8.1164、6.8165和6.9389,P均<0.05);其危险度分别为3.648、0.377、0.278和2.888,提示上述11个变量中吸烟(smoke)、分化程度(class)、PTEN及分期(fq)4个变量是本组的生存危险因素。
2.3.1 PTEN表达与患者生存的关系 PTEN蛋白表达阳性者平均生存时间为25.9048个月,中位生存时间为24个月,阴性患者平均生存时间为17.7273个月,中位生存时间为17个月,PTEN表达阴性患者较阳性患者生存时间短,有显著性差异,χ2=7.4296,P<0.05。
2.3.2 MAPK表达与患者生存的关系 MAPK蛋白表达阳性患者平均生存时间为25.3529个月,中位生存时间为23个月,阴性患者平均生存时间为20.5333个月,中位生存时间20个月,MAPK表达阴性患者较阳性患者生存时间短,但无显著性差异,χ2=1.2540,P>0.05。
2.3.3 Cyclin D1表达与患者生存的关系 Cyclin D1蛋白表达阳性患者平均生存时间为24.1500个月,中位生存时间为22.5个月,阴性患者平均生存时间为20.8333个月,中位生存时间为18.00个月,Cyclin D1表达阴性患者较阳性患者生存时间短,但无显著性差异,χ2=1.7988,P>0.05。
3 讨论
3.1 PTEN蛋白在正常肺、癌旁和肺癌组织中的表达
PTEN[1~3]是新近发现的第1个具有磷酸脂酶活性的肿瘤抑制基因,其特征类似于双特异性磷酸酶,使酪氨酸和丝/苏氨酸残基磷酸化。PTEN正常表达可以抑制肿瘤细胞侵袭、转移和生长,PTEN基因突变、丢失,导致其蛋白表达下降甚至完全不表达而使其抑癌功能丧失。国内外PTEN与肺癌关系的研究已有报道,结果不完全一致[2,4]。
本研究结果显示,正常肺组织PTEN蛋白表达全部呈阳性,说明正常肺组织无PTEN基因突变或缺失;而62例肺癌PTEN蛋白总阳性表达率为75.00%,明显低于癌旁组织88.89%和正常肺组织,提示肺癌发生发展过程中存在PTEN基因的突变和(或)缺失,PTEN基因突变或缺失在肺癌中是一个常见事件,由于PTEN基因突变或缺失均能导致其蛋白表达阴性;从而导致其抑癌功能的丧失,本文PTEN蛋白阳性率结果略高于Cantley[2]和国内学者窦鹏挥等[5]报道的,PTEN基因突变是否在非小细胞肺癌和小细胞肺癌之间存在差异,国内外研究也不一致,我们的结果显示,PTEN突变在非小细胞肺癌和小细胞肺癌之间无显著性差异,提示此两型肺癌都有PTEN基因表达突变或缺失;本文结果还提示PTEN基因突变与肿瘤大小、吸烟及非小细胞肺癌分化程度有显著性差异,提示肿瘤直径超过5cm者PTEN突变机率增高,肿瘤越大,PTEN基因丢失越多,其抑癌功能也越差;通常认为吸烟是肺癌的诱发因素之一,本文结果也证实了吸烟导致PTEN基因蛋白的丢失,可能是肺癌发生的诱因;细胞分化程度的高低决定肿瘤的恶性程度和预后,PTEN蛋白表达越低,肿瘤分化越差,预后越恶劣,由此提示,PTEN蛋白的高低可作为判断肺癌预后的标志。
3.2 MAPK蛋白在正常肺、癌旁和肺癌组织中的表达
从细胞表面到细胞核的信号转导途径是现代生物学的重要课题之一。PTEN参与多种细胞信号转导的调节[1,6],受体酪氨酸激酶-Ras-MAPK是将外界刺激信号传递到细胞核内的最重要途径之一。参与细胞的生长、发育、分裂及分化等多种生理过程,并在细胞的恶性转化中起重要作用; MAPK属于丝氨酸/苏氨酸激酶,它在生长因子和分化因子刺激的信号转导途径中发挥关键作用。在未受刺激细胞内,MAPK表现为脱磷酸型,只有当它的苏氨酸和酪氨酸残基都被磷酸化后,MAPK才被激活。在人类MAP激酶(Erk1)磷酸化位点为202位的苏氨酸和204位的酪氨酸,这些磷酸化位点被称为MAPK的“TEY”特征顺序,是MAPK的调节位点和结构特征。
本研究结果显示,正常肺组织中MAPK蛋白表达全部呈阴性,说明正常情况下肺组织无MAPK信号蛋白的激活,MAPK在肺癌中蛋白阳性率为33.87%,高于癌旁组织(22.22%)和正常肺组织,提示肺癌发生发展过程中存在MAPK信号基因的突变和(或)缺失,MAPK基因异常表达存在于肺癌的信号转导通路中,由于MAPK基因异常表达导致其蛋白过度表达;从而引起MAPK信号激联反应出现异常激活,最终发生发展为肺癌;本文实验结果MAPK表达阳性与肿瘤的淋巴结转移显著相关,N0与N1~3相比差异显著,有淋巴结转移者阳性率高于无淋巴结转移;低分化癌与中高分化癌相比有显著差异,低分化者MAPK在癌组织中呈强阳性,癌组织分化愈差,MAPK表达愈强。MAPK表达强度与患者年龄、性别、吸烟及大小均无明显关系。由此提示MAPK表达的异常可作为肺癌的一个预后判断因素。
3.3 Cyclin D1蛋白在正常肺、癌旁和肺癌组织中的表达
细胞周期素D1基因定位于11q13,全长15 kb,含有5个外显子,编码由295个氨基酸组成的蛋白产物,简称Cyclin D1,其中第56~141位氨基酸序列为保守序列,称周期素盒子(Cyclin box)。周期素盒子的主要功能是与CDK结合并激活之,如果该区域突变,Cyclin与CDK的结合能力和激活功能同时丧失。当Cyclin D1型蛋白过表达或功能性减少时,G1期缩短,G1~S期进程加速,可使细胞持续增加,最终形成肿瘤[7,8]。Cyclin与CDK的结合能力和激活功能同时丧失。当Cyclin D1型蛋白过表达或功能性减少时,G1期缩短,G1~S期进程加速,可使细胞持续增加,最终形成肿瘤[7,8]。
本研究结果显示,10例正常肺组织均为Cyclin D1阳性,Cyclin D1在肺癌中蛋白总阳性率是66.13%(41/62),与文献报道的相近[8];肺癌中Cyclin D1阳性率明显低于癌旁组织[77.78%(28/36)]。Cyclin D1蛋白阳性率与吸烟情况显著相关,吸烟者阳性率显著高于非吸烟者;提示吸烟是肺癌的诱发因素;N0与N1~3相比差异显著,无淋巴结转移者显著高于有淋巴结转移者,由此说明Cyclin D1可作为判断肺癌预后因素之一;Cyclin D1表达强度与患者年龄、性别、肿瘤大小及分化程度均无明显相关性。
3.4 PTEN、MAPK及Cyclin D1蛋白在肺癌中表达及相关性
PTEN对酸性底物有高度活性,磷脂酰肌醇-3,4,5-三磷酸(PIP3)是PTEN的主要底物,FAK也是PTEN作用的主要底物,Shc是否为PTEN的底物目前尚有争论;由此可知PTEN控制以下3条信号途径[4,9]:①PTEN-FAK- p130Cas 骨架蛋白组装、细胞迁移、侵袭及转移;②PTEN-PIP3-Akt-p27/CyclinD1 控制细胞周期; ③PTEN-Shc/- Grb2/Sos/ras - MAPK-Cyclin D1下调细胞生长和周期控制。
本文应用对数线性模型分析方法分析PTEN、MAPK和Cyclin D1蛋白三者间的关系,结果示PTEN和MAPK两者呈明显的负相关,有显著性意义。表明PTEN蛋白能够有效抑制Ras/Raf/MAPK信号转导级联途径,提示在肺癌的发生中,可能由于PTEN蛋白表达降低或缺失,不能有效抑制由致癌因子异常激活的Ras/Raf/MAPK信号转导通路,从而使肺癌癌细胞异常增殖和恶性转化;此途径的激活可能是PTEN蛋白失表达而不能使Shc脱磷酸所致;但PTEN是否直接使MAPK去磷酸化值得进一步研究。
3.5 PTEN、MAPK及Cyclin D1表达与肺癌预后的关系
本文通过多个预后相关因子对肺癌患者的生存状况的影响作了进一步的研究。采用Cox 比例风险模型,对本组共30例可随访资料进行多因素分析探讨多个预后相关因子对生存状况的影响。共11个列变量进入Cox模型,包括PTEN、MAPK、Cyclin D1、肿瘤大小、淋巴结转移、TNM分期、病理类型、分化程度、性别、年龄和吸烟。经用逐步回归法筛选上述变量后,吸烟、分化程度、PTEN及分期4个变量用Cox比例风险模型可信度检验,有统计学意义,提示上述11个变量中吸烟、分化程度、PTEN及分期4个变量是本组的生存危险因素。
单因素分析采用Kaplan-Meier生存曲线与Wilcoxon检验,PTEN蛋白表达阳性患者平均生存时间为25.9048个月,而PTEN蛋白表达阴性病例平均生存时间为17.7273个月,PTEN表达阴性患者较阳性患者生存时间短,Wilcoxon检验,有显著性差异。提示PTEN蛋白表达是1个有价值的、独立的预后指标,PTEN蛋白失表达与预后不良密切相关。MAPK蛋白表达阳性病例平均生存时间为25.3529个月,阴性病例平均生存时间为20.5333个月,MAPK表达阴性患者较阳性患者生存时间短,但Wilcoxon检验无显著性差异;Cyclin D1蛋白表达阳性病例平均生存时间为24.1500个月,阴性病例平均生存时间为20.8333个月,Cyclin D1蛋白表达阴性患者较阳性患者生存时间短,但Wilcoxon检验亦无显著性差异。
总之,PTEN蛋白作为第一个具有磷酸酶活性的抑癌基因,自发现以来备受关注,我们认为PTEN蛋白的丢失贯穿于肺癌发生发展的整个过程,肺癌发生发展过程中存在PTEN负调控MAPK的信号转导途径,但PTEN如何影响Cyclin D1尚需作进一步的探讨,在临床实践中,可把PTEN、MAPK以及Cyclin D1作为诊断肺癌的参考因素,还可将其列为判断病程是否进展和评估预后的指标。
[1]Li J,Yen C,Liow D,et al. Aputative protein tyrosine phosphatase gene mutated in human brain,breast and prostate cancer 〔J〕.Science, 1997,275(5308):1943.
[2]Cantley LC,Neel BG.New insights into tumor suppression:PTEN suppression tumor formation by restrainingthe phosphoinositide 3-kinase/AKT pathway 〔J〕.PNAS,1999,96(8):4240.
[3]Jian-Min Tang,Quan-Ying He,Rui-Xia Guo,et al.Phosphorylated Akt overexpression and loss of PTEN expression in non-small cell lung cancer confers poor prognosis 〔J〕.Lung Cancer,2006,51:181.
[4]宋英华,李 玉,林晓燕.PTEN、P16和nm23-H1在非小细胞肺癌中的表达及临床意义〔J〕.泰山医学院学报,2009,30(10):737.
[5]窦鹏挥.非小细胞肺癌中PTEN的表达及临床意义〔J〕.黑龙江医药科学,2009,32(2):29.
[6]Qing-Bai She,David B Solit,Qing Ye,et al.The BAD protein integrates survival signaling by EGFR/MAPKand PI3K/Akt kinase pathways in PTEN-deficient tumor cells 〔J〕.Cancer Cell ,2005,8(10):287.
[7]An HJ,Shim JY,Kim SJ,et al.Alteration of PTEN expression in endometrial carcinoma is associated with down-regulation of cyclin-dependent kinase inhibitor,p27 〔J〕.Histopathology,2002,41:437.
[8]谢 军,何 云.非小细胞肺癌中Cyclin D1表达及临床意义〔J〕.临床肺科杂志,2010,15(4):498.
[9]Tamura M,Gu J,Danen EH,et al.PTEN Interactions with focal adhesion kinnase and suppression of the extracellular matrix-dependent phosphatinositol 3-Kinase/akt cell survival pathway 〔J〕.J Biol Chem,1999,274:206.

