SiRNA逆转T24/ADM细胞耐药性的研究
陈从波 姚启盛 王晓康 杨 勇 刘正清
有研究表明,在膀胱癌的多药耐药产生机制中,多药耐药基因(multidrug resistance gene,MDR1)编码的糖蛋白(P-glycoprotein,P-gp)的过度表达是肿瘤细胞产生耐药的分子基础。RNA干扰(RNA interference,RNAi)是1种有效抑制基因表达的技术,能够特异而有效地引起转录后基因沉默在mRNA水平关闭相应基因的表达,具有稳定、特异、低毒以及作用持久等特点。本研究设计以人膀胱癌细胞系/阿霉素(T24/ADM)细胞株MDR1基因为靶标的小干扰RNA,观察其对MDR1基因表达及细胞株耐药性的影响。
1 材料与方法
1.1 材料、试剂及器材
人膀胱癌细胞株T24购于武汉大学中国典型培养物保藏中心。阿霉素(adriamycin,ADM)(深圳益飞医药化工有限公司),RPMI 1640培养液(美国GIBCO公司),小牛血清(杭州四季青生物工程材料有限公司),MTT(Amresco公司),二甲亚砜(DMSO,SIGMA公司),酶联免疫检测仪(BIO-RAD550,美国伯乐公司),流式细胞仪(美国Beckman公司),PCR仪(美国BD公司)。
1.2 siRNA的设计与合成
根据GeneBank mdr1基因已知序列(基因编号NM000927)按siRNA序列设计的原则,从转录本mRNA的AUG起始密码开始,选取3条含21个碱基的序列,由上海生化工程公司合成其正义和反义单链,最后用SilenceTM siRNA Construction Kit(Ambion 公司)试剂盒体外转录正义和反义单链成双链siRNA,设随机序列作为阴性对照(si-neg)。SiRNA的序列如下:5′ GAGCUUAACACCCGACUUAUU3′,5′GAAAGUAUACCUCCAGUUUUU 3′,5′GAC CAUAAAUGUAAGGUUUUU3′。
1.3 细胞培养及转染
T24细胞在RPMI 1640完全培养基中培养(10%小牛血清),于37℃、5% CO2的培养箱中培养。采用ADM浓度梯度递增诱导法,直至细胞能在含1.0 mg/L 阿霉素的培养基中维持生长,并能稳定传代30代以上,即成为耐药人膀胱癌细胞模型T24/ADM,耐药细胞在含0.1 mg/L ADM的培养液中培养。实验前无药培养两周。参照文献[1],用Oligofectamine 转染试剂(Invitrogen Life Technologies,Carlsbad,CA),按试剂盒操作说明优化转染条件,分别将3对siRNA以200 nmol/L的终浓度加入到T24/ADM细胞培养液中,孵育24~48 h后收获细胞进行检测。实验重复3次。
1.4 RT-PCR
应用TRIZOL试剂(Gibico)提取细胞总RNA。根据NCBI中cDNA序列设计引物,以β-actin作为检测的内参照,PCR反应引物由上海生物工程有限公司合成,其序列分别为,β-actin:F 5’-CGTAAAGACCTCTATGCCAA-3’和R 5’-AGCCATGCCAAATGTCTCAT-3’,其cDNA扩增产物为286 bp。MDR1:F 5’-CCCATCATTGCAATAGCAGG-3’和R5’-GTTCAAACTTCTGCTCCTGA-3’,其扩增产物为167 bp。采用一步法进行单管RT-PCR,反应总体系为25 μl。反应完成后取10 μl样品在2%琼脂糖凝胶中电泳,自动电泳凝胶扫描分析系统(Chiemlmage 5500)扫描凝胶并进行定量分析。
1.5 Western方法检测P-gp表达
将经过siRNA转染48 h后的各组T24/ADM细胞,用PBS洗涤2次,取对数生长期的细胞,加入RIPA (美国Pierce)裂解液。冰上静置10 min后,4℃ 、14 000 r/min,离心10 min后取上清。采用BCA法(美国Pierce)进行蛋白定量后,蛋白样品加入等体积的2×SDS凝胶上样缓冲液混匀,置于沸水浴中加热10 min。蛋白样品(每孔上样量均为20 μg总蛋白)用SDS-PAGE凝胶(10% ,Invitrogen公司产品)进行电泳分离,分离的蛋白条带转移至PVD膜,并与抗人P-gP及β-actin的第一抗体于4℃孵育过夜后,再与辣根过氧化物酶标记的第二抗体反应,DAB显色。实验设置4组:①对照组,T24/ADM细胞;②阴性对照组,空转染组;③T24细胞组;④转染组。
1.6 MTT 法检测ADM的半数抑制浓度(IC50)
将经SiRNA转染48 h后的各组T24/ADM细胞,调整细胞浓度至1×105/ml,在96孔板的各孔中加入180 μl 细胞和不同浓度ADM,培养72 h后,加入MTT液20 μl/孔,弃上清液,加入二甲基亚砜(DMSO)150 μl,充分震荡10 min,应用酶联免疫分析仪测波长570 nm处每孔的光密度值(A570值),按以下公式分别计算相对逆转效率。相对逆转效率=(IC50A-IC50B)/(IC50A-IC50C),其中IC50A是T24/ADM细胞的IC50,IC50B是转染siRNA的T24/ADM细胞的IC50,IC50C是T24细胞的IC50。
1.7 细胞内阿霉素(ADM)积累量的测定
将经过siRNA转染48 h后的细胞,按1×106/ml细胞浓度与1 μg/ml的ADM 37℃共同孵育1 h后,冰浴终止ADM的作用,应用流式细胞仪检测细胞内ADM稳态积累量。以未经过处理的T24/ADM细胞作为空白对照。
1.8 统计学处理
应用SPSS13.0进行统计学分析,统计学处理采用t检验,P<0.05 为有统计学意义。
2 结果
2.1 T24/ADM 细胞MDR1 mRNA水平的变化
T24/ADM 细胞经siRNA处理48 h后,3组MDR1mRNA表达水平均下调,见图1。阴性对照组MDR1/β-actin为0.56,另3组MDR1/β-actin分别为0.23、0.18和0.12。
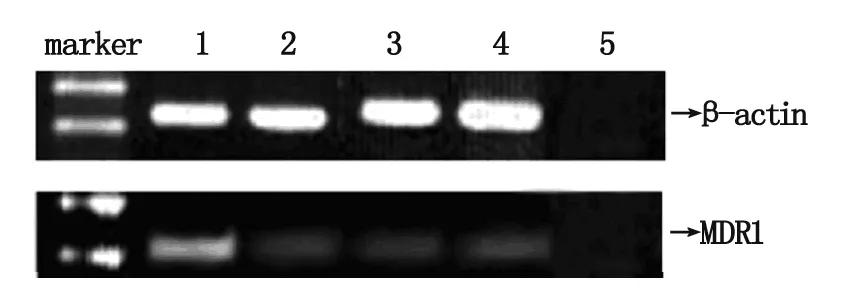
图1 T24/ADM细胞经siRNA作用48 h后MDR1 mRNA表达水平
1为si-negative;2为si-mdr1-1;3为si-mdr1-2;4为si-mdr1-3;5为阴性对照
2.2 T24/ADM 细胞P-gp蛋白表达的变化
经siRNA处理48 h后,P-gp蛋白表达均受到抑制,Western-blot检测结果显示,T24/ADM 细胞中P-gp蛋白表达水平较亲本细胞明显升高,差异有统计学意义(P<0.05)。对照组细胞与阴性对照组细胞P-gp蛋白表达比较,差异无统计学意义。转染siRNA后的细胞P-gp蛋白表达水平明显下降,见图2。
2.3 T24/ADM 细胞药物敏感性的变化
3组siRNA 作用48 h后T24/ADM 细胞对化疗药物的敏感性均增强(表1),表明所设计的siRNA均可恢复T24/ADM 细胞对化疗药物的敏感性。
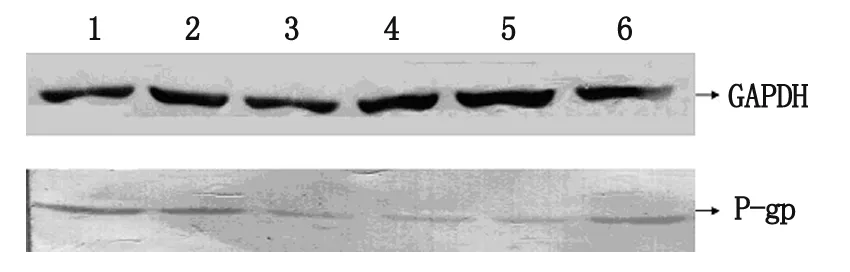
图2 各组细胞中P-gp表达的检测
1为对照组细胞;2为阴性对照组细胞;3为T24/ADM细胞;4为si-mdr1-1细胞;5为 si-mdr1-2细胞;6为si-mdr1-3细胞
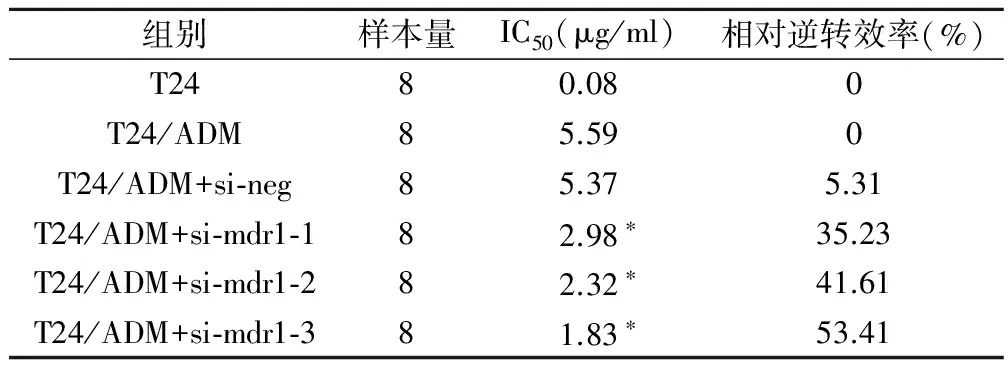
表1 siRNA作用后T24/ADM细胞的IC50
注:与T24/ADM细胞组比较,*为P<0.05
2.4 T24/ADM细胞内ADM积累量的变化
经siRNA处理48 h的T24/ADM细胞内ADM稳态累积量明显增高(表2),但与敏感株T24比较,荧光强度和阳性率仍较低。
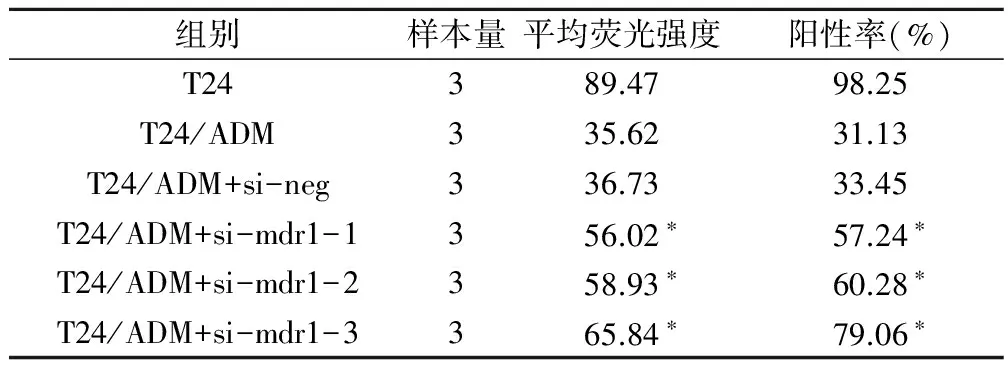
表2 siRNA处理后细胞内ADM积累量情况
注:与未经处理的T24/ADM细胞组比较,*为P<0.05
3 讨论
目前,膀胱癌的化疗效果不明显,究其主要原因是肿瘤细胞中的多药耐药基因(MDR)的存在,导致很多化疗药物作用失败。RNAi 作为1种新的研究工具,已经在功能基因组学领域呈现出巨大的应用前景。研究表明[2,3]体外合成的小分子dsRNA能直接触发RNAi,这些小分子dsRNA被称为小干涉RNA(small interfering RNA),即siRNA。Elbashir等[4]首次报道siRNA在哺乳动物体外培养细胞内成功诱导基因特异阻抑以后,siRNA是否可应用于人类疾病的治疗受到了广泛的关注。在肿瘤基因治疗中,通过人合成特定癌基因靶向的siRNA或构建siRNA的表达载体,并导入肿瘤细胞中,可以特异性地抑制目的基因的表达[5]RNAi技术的发展为逆转多药耐药的基因治疗提供了可能[6]。本研究以MDR1基因为目标,针对MDR1基因设计了3条siRNA序列,以探讨干扰RNA技术进行多药耐药逆转的可行性。结果显示,转染后MDR1 mRNA明显下调,48 h后抑制率很高。并且P-gp蛋白的抑制率在48 h的时候也达到很高的水平。目前的研究发现,外源性的siRNA引发的RNAi仅为短时效应,在绝大多数哺乳动物细胞中转染人工合成的短片段RNA后,进行基因和蛋白抑制检测的高峰时间在转染后的48~72 h,一般在转染后3~5 d蛋白的抑制达到最高,5~7 d则恢复到稳定状态。从我们的结果也可以看到,基因和蛋白的抑制基本遵循上述的规律。本研究中,ADM的IC50和ADM的稳态细胞内积累量分析证实,转染siRNA后T24/ADM细胞对ADM的敏感性及细胞内ADM的积累量与对照组相比均有明显差异,本实验结果肯定了siRNA干扰能够有效抑制MDR1基因编码蛋白P-gp的表达,说明siRNA可能成为逆转多药耐药的新方法。
总之,我们应用了针对MDR1 RNA干扰技术,可以有效地抑制MDR1 mRNA表达,能够有效抑制该基因编码的P-gp蛋白表达,从而有效地逆转了肿瘤细胞的耐药性,如果能联合应用多种耐药机制的siRNA,将能更有效地逆转肿瘤细胞的耐药性,为治疗肿瘤提供新的方法。
[1]何一心,杨少光,张淑靖,等.多药耐药性细胞的鉴别和分离〔J〕.中华血液学杂志,1992,13:173.
[2]Scherr M,BattIIler K,Winlkler T,et al.Specific inhibition of bcr-abl gene expression by small interfering RNA〔J〕.Blood,2003,101:1566.
[3]彭 智,肖志坚,王 一,等.siRNA逆转K562/A02细胞多药耐药研究〔J〕.中华血液学杂志,2004,25:5.
[4]Elbashir SM,Harborth J,Lendeckel W,et,al.Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells〔J〕.Nature,2001,411(6836):494.
[5]Bulk E,Hascher A,Liersch R.Adjuvant therapy with small hairpin RNA interference prevents non-small cell lung cancer metastasis development in mice〔J〕.Cancer Res,2008,68(6):1896.
[6]Duan Z,Weinstein EJ,Ji D.Lentiviral short hairpin RNA screen of genes associated with multidrug resistance identifies PRP-4 as a new regulator of chemoresistance in human ovarian cancer〔J〕.Mol Cancer Ther,2008,7(8):2377.

